
Тимин_О_А_Лекции_по_общей_биохимии
.pdf
Ферменты |
60 |
|
|
|
|
П Р ИКНОЦЛИПЧЫЕС Т В Е Н |
|
Н ОГПОР Е Д Е Л Е Н И Я |
||||
|
А К ТФИЕВРНМОЕСНТТИО В |
|
|
|||
1Акти. ферментавыражаетсяность |
|
скоростинакопленияпродуктаскоростилиубыли |
|
|
||
|
субстрата впересчетенаколичествоматериала,содержащегофермент. |
|
|
|
||
|
Активность |
фермента = |
Количество продукта |
или субстрата |
|
|
|
Количествовремени × Масса или объем пробы |
|||||
|
В практике обычно используют: |
|
|
|
||
o |
единицыколичествавещества |
|
– мольи( |
производныемм, кмоль),граммкг(,мг) |
, |
|
o |
единицывремени |
– минута,час,секунд |
а, |
|
|
|
o |
единицымассилиобъема |
|
– граммкг(,мг),литрмл(). |
|
|
|
Активноиспользуютсядругиепроизводные |
|
|
– катал (моль/с) |
, международная еди- |
|||
ница активности (МЕ, Unit) соответствует мкмоль/мин. |
|
|
|
|
|||
Такимобразом,актив |
ностьферменможевыражаться,н пример, |
|
вммоль/с |
×л, |
|||
г/час ×л,МЕ/л,кат/мли.д. |
|
|
|
|
|
|
|
2. Создстандартныхусловийие |
|
,чтоможнобысравниватьл |
|
результаты, |
полученные |
||
вразныхлабораториях |
– оптимальнаярН,фиксированн |
ая температура,например, С25° |
|
||||
или3 7°С,соблюдвремениинксубсфеациистр. ментомата |
|
|
|
|
|
|
|
3. Избытоксубстрата |
,чтобыработаливсеимеющие |
|
сяврастворемолф .кулырмента |
|
|
|
|
|
|
|
|
|
|
||
|
С В ОФЙЕСР МТВЕАН Т О В |
|
|
|
|
||
|
|
|
|
|
|
|
|
1. Зависимость активностифермента |
отте |
м- |
|
|
|
|
|
пературы – описываетсяколоколообразной |
|
|
|
|
|
||
кривойсмаксимумом |
скорости призначен |
и- |
|
|
|
|
|
яхоптимальной |
температуры |
дляданного |
|
|
|
|
|
фермента. |
|
|
|
|
|
|
|
Закоповышениискоростреакц2 ии |
|
-4 |
|
|
|
|
|
разаприповышениитемпературына10°Сспр |
|
|
а- |
|
|
|
|
веидлфермивяе,накцийтолативных |
|
ь- |
|
|
|
|
|
ковпред елахдо55 |
-60°С,т.е.взначенияхд |
|
о де- |
|
|
|
|
натурациибелков. |
Нарядусэт,какисключм |
|
е- |
|
|
|
|
н,имеютсяферменнекотомикырооргых |
|
|
а- |
|
|
|
|
низмов,существующихводегорячихисточн |
|
|
и- |
|
|
|
|
ковигейзеров. |
|
|
|
Припонижениитемпературыактивнфермеонижаетсясть,нонеисчезаетов |
|
тс о- |
|
всем.Иллюстрациможетслужитьзимспячканеяякоторыхйживотныхсуслики( ,ежи), |
|
|
|
температурателакоторых |
понижаетсядо3 |
-5°С . Этосвойствоферментовтакжеиспользу |
ется |
вхирупргическойприактикепровоперацийнадениигруднпол,кбольноггдастий |
|
о |
|
подвергаютохлаждениюдо22°С. |
|
|
|

biokhimija.ru |
|
|
|
|
|
|
ТиминО.А. |
Лекции по общей биохимии (2018г) |
|
|
61 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
2. Зависимость |
активностифе |
|
р- |
|
|
|
|
|
|
||||||||
мента отрН |
– |
описываетсяк |
о- |
|
|
|
|
|
|
||||||||
локолообразнойкривойсмакс |
|
|
|
|
и- |
|
|
|
|
|
|
||||||
мумом |
|
скорости |
приоптимал |
|
ь- |
|
|
|
|
|
|
||||||
ном дляданногофермента |
|
|
значе- |
|
|
|
|
|
|
||||||||
ния рН. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Длякаждогоферментасущ |
|
|
|
|
|
е- |
|
|
|
|
|
|
||||
ствуетопределенныйузкийинтервал |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
рНсреды,которыйявляетсяопт |
|
|
|
|
|
|
и- |
|
|
|
|
|
|
||||
мальнымдляпроявленияеговысшей |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
активности. |
Например, |
оптимальные |
|
|
|
|
|
|
|||||||||
значениярНдляпепсина1,5 |
|
|
|
|
|
-2,5, |
|
|
|
|
|
|
|||||
трипсина8,0 |
|
-8,5,амилазыслюны7, |
|
|
2,аргиназы9, |
7,кислойфосфат |
азы4,5 |
-5,0,сукцинатд |
е- |
||||||||
гидрогеназы9,0. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Объясняетсяэтоналичием |
|
|
|
|
таких аминокислотвструктурефермента,зарядкот |
|
|
о- |
|
|||||||
|
рыхизменяетсяприизменениирН |
|
|
|
|
(лизин,ар,гининлутамат,аспар) ат |
|
|
.Измен е- |
|
|||||||
|
нионизацаминокислотепризменениюводитконфолекурмации |
|
|
|
|
|
|
лыи, |
|
||||||||
|
следовательно,субстратсвязыилине язываетсяактивнымцентром. |
|
|
|
|
|
|
|
|
||||||||
3. |
Зависимостьот |
количества фермента |
|
|
|
|
|
||||||||||
|
Приувеличенииколичествамолф скоростьрментакулреакциивозрастаетнепреры |
|
|
|
|
|
|
|
в- |
||||||||
ноипрямопропорцио |
|
|
|
нальноколичествуфермента |
|
,т.к. |
большееколичествомолф кул |
|
р- |
||||||||
ментапроизводитбольшеечисломолпродуктакул |
|
|
|
|
|
|
Зависимость активностифермента |
от |
|||||||||
субстрата описываетфермекин,етативнаяетика |
|
|
|
ецентральнымпонятиявляконстатся |
|
|
н- |
||||||||||
таМихаэлиса( |
|
Km) (смниже) |
. |
|
|
|
|
|
|
|
|
||||||
4. Зависимость активности фермента отконцентрациисубстрата |
|
|
|
|
|||||||||||||
|
Приувеличенииконцентрации |
|
|
|
субстрата скоростьреакциисначалавозрастает |
|
,т.к.к |
|
|||||||||
катализудобавмосубстраталяемыхекул |
|
|
|
|
|
|
подключаютсяновыеи |
|
молекулыфермента. |
|
|||||||
Т.е.скоростьнакопления |
|
|
|
продукта возрастает,иэто |
|
начаетувеличениеактивностифе |
все молфекулы |
р- |
|||||||||
мента.З |
атемнаблюдаеэффекнасыщениятся |
|
|
|
|
(плнакривойто) |
,когда |
р- |
|||||||||
мента заняты молекуламисубстрата |
|
|
инепрерывноведуткатализ |
. |
Здесьскоростьреакции |
|
|||||||||||
максимальна. |
В некоторых случаях,п |
ри дальнейшем увеличенииконцентрациисубстрата |
|
|
|||||||||||||
междумолекуламиговозниконкуренциязактивныйетцентрфермент |
|
|
|
|
|
|
|
а и активность |
|||||||||
фермента( |
скоростьреакции |
|
) снижается. |
|
|
|
|
|
|||||||||
|
УравнениеМихаэлиса |
|
-Ментен |
|
|
|
Зависимость активностифермента |
отсубстрата |
описывает уравнениеМи |
хаэлиса- |
|
Ментен,использующее константу Михаэлиса( |
Km), биологический смысл которойзаключ |
а- |
|||
етсяв |
характеристике сродства ферменксубстрату |
. |
,аименно:увеличениевеличиныК |
m |
|
означаетснижениесродстваферменксубстрату |
|
|
|
||

Ферменты |
62 |
|
|
УравнениеМихаэлиса -Ментен показывает взаимосвязь максимальной и реальной скоростей реакции,константыМ иконцентрациихаэлисасубстрата.
|
|
V = |
Vmax×[S] |
|
|
||
|
|
Km + [ S] |
|
|
|
||
|
УравнениеМихаэлиса |
-Ментен |
|
|
|||
Выделяют три решенияуравнения |
: |
|
|
|
|
|
|
1Концентрация. субстрата |
равна величинеконстанстыМихаэлиса |
([S] = Km).Вэтом |
|||||
случае,решур Михаэлисавнениея |
|
-Ментен,получа,чтоскоростьеакциим |
V будетравна |
||||
половине максимальной Vmax.(V = ½ Vmax). |
|
|
|
|
|||
В математическом смысле Km соответствуетконцентрациисубстратапри орой |
|
|
|||||
скоростьреакцииравнаполовине |
|
максимальной. |
|
|
|
|
|
2Концентрация. субстрата |
[S] значительно больше Km ([S] >> Km)В.этомслучае,в |
е- |
|||||
личиной Km можнопренебри ешиполучечьнии |
|
|
|
аем,чтоскоростьреакциимакс мальна |
|
||
(плнаграфикето) |
. |
значительно меньше Km ([S] << Km)В.этомслучае, |
|
||||
3.Концентрациясубстрата |
знаме- |
||||||
нательуравнениямалоизменяется |
|
приизменении |
[S],авеличина |
скоростиреакц и |
V прямо |
||
пропорциональна [S] (графиклинеен).
|
|
С П Е Ц И Ф И Ч Н О С Т Ь Ф Е Р М Е Н Т О В |
|
|
|
Специфичоснкомплементаованаостьструктусубстиактивногорыатаности |
|
цен- |
|
трафермента. |
|
|
|
|
1. Стереоспецифичность – катоаоднлькостереоизомеровго |
,например : |
|
||
o |
специфичностьк |
L- или D-аминокислотам – например, |
почтивсеферментычелов |
е- |
|
кавзаимодействуют |
L-аминокислотами, |
|
|
o |
специфичностьк |
цис- и транс-изомерам. Например,аспартазареагируеттолько |
|
|
|
транс-изомером – фумаркислотой,ннемалеатомвойцис( |
-изомер), |
|
|
biokhimija.ru |
|
ТиминО.А. |
Лекции по общей биохимии (2018г) |
|
|
63 |
|||
|
|
|
|
|
|||||
2. Абсолютная специфичность – ферментпрои |
зводиткатоаоднлькоизвещества.го |
|
|
|
|||||
|
Например, уреаза расщепляеттолькомочевину |
|
, глюкокиназа фосфорилируеттолько |
D- |
|||||
|
глюкозу. |
|
|
|
|
|
|
|
|
3. Групповая специфичность – катализсубстратобщимиструктурвсобенностями, ыми |
|
|
|
||||||
|
т.е.приналичииопределенной |
связи илих мической |
группы: |
субтилизин специфи- |
|||||
o |
наличиепептиднойсвязи |
,например, |
• бактериальныйфермент |
||||||
|
чен кпептиднойсвязинезависимоотстроенияобрееаминокислотзующих, |
|
|
|
|
|
• пепсин |
||
|
катализируетразрывпептиднойсвязи,образованной |
|
|
аминогруппамиароматических |
|||||
|
аминокислотсм( |
|
"Внешнийобменбе |
лков"), • тромбин всвоихсубстратах |
расщепляет |
||||
|
пептиднуюсвязь |
|
толькомеждуаргин |
иномиглицином. |
|
|
|
|
|
o |
наличиеОН |
-груп,напримеры |
, алкогольдегидрогеназа окисляетальдегидов |
|
д- |
||||
|
ноатомнметаспиртэтанол( , ы |
|
|
пропанол, ). |
|
|
|
|
|
4. Относительнаягрупповая |
|
специфичность – превращениесубстранекотоврыми |
|
|
б- |
||||
|
щимипризнаками. |
|
Например, цитохромР |
450 окистогидрофобныелькояетвещества,к |
|
|
о- |
||
|
торыхнасчитываетсяоколо7000. |
|
|
|
|
|
|
|
|
|
|
МЕ Х АСПЕЦИФИЧНОСИ З М Ы |
ТИ |
|
|
Вобщемвидевсводитсяккомплементарномувзаимодейферменсубствию |
|
|
а- |
||
та.Приэтомфункциональныегруппысубстратавзаимодействую |
|
тссоответствующими |
|
||
функциональгруппамиферме. нымита |
|
Наличиесубстратной |
специфичобъясдвеняютости |
|
|
гипотезы: |
|
|
|
|
|
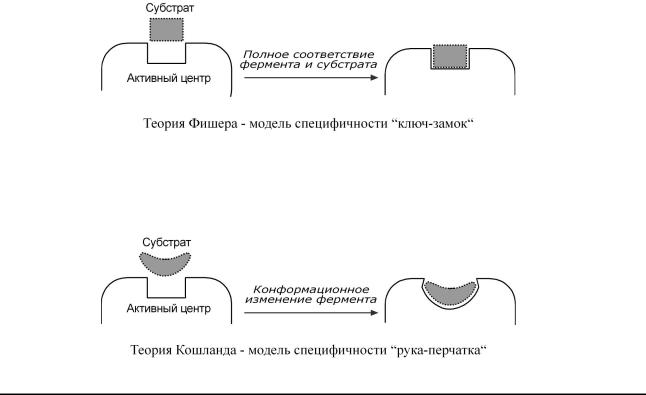
1. ГипотезаФишера |
(модж"ематрицыстль",ключой" |
-замок") |
– активныйцентр |
|
|
ферменстрогосооконфигаветствсубстратанеизмеетрации |
|
няетсяприегоприсоед |
и- |
||
нении.Этамодель |
хорошообъяабсняолютнуюспецифичн,нонегрупп. остьвую |
|
|
|
|
2. ГипКошлтезанда |
(модельиндуцированного" соответствия",рука" |
-перчатка") |
– |
подразумгибктиостьцентра.вПриногоаетсубстратаоединениек |
|
якорномуучастку |
|
ферментавызывизмеконетениефигурациикаталитическцентратакимобразом,чтобыго |
|
|
|
егоформасоответствовалаформесубстрата. |
|
|
|
Р Е ГАУКЛТЯИЦВИНЯО С Т И |
Ф Е Р М Е Н Т О В I N V I V O |
|
Активносфермклнепетнтвременикеьвостоянна.Оначутко |
реагнасирует |
у- |
ацию,вкоторойоказывклетка,наф ,воздействующкторысянаклеткукакснаруж, ие |
|
|
такиизнутри.Главнаяцельэтойреакции |
– отреагироватьнаизменениеокружающейсреды, |
|

Ферменты |
|
|
|
|
|
|
|
|
|
64 |
||
|
|
|
|
|
|
|
|
|
|
|||
приспособиклеткуновымусловиям,датьдолжныйответнагормо |
|
|
|
|
|
|
|
нальныеииныест |
и- |
|||
мулы,авнекоторыхситуациях |
– получитьшансвыжить |
|
|
. |
|
|
|
|||||
1. Доступноссубстратаь |
иликофермента |
|
|
|
|
|
|
|||||
|
|
Здесьработает |
закондействиямасс |
|
|
– фунда- |
|
|
|
|
||
ментальныйзаконхимич:нетикиприпостской |
|
|
|
|
о- |
|
|
|
|
|||
янной температуре скорость химическойреакции |
|
|
|
|
|
|
||||||
пропорциональна произведению концентрации реа- |
|
|
|
|
||||||||
гирующих веществ. Илиупрощенно |
|
– скорость, |
о- |
|
|
|
|
|||||
торойвеществареагидруг,зависитютгом |
|
|
|
|
|
|
|
|
|
|||
ихконцентрации.Такимобразом, |
|
|
изменение количе- |
|
|
|
|
|||||
ства хотябыодного |
|
изсубстратов |
прекращает или |
|
|
|
|
|||||
начинает реакцию. |
|
|
|
|
|
|
|
|
|
|||
|
|
Напр,дляцтрикарбоновыхкламеркислот |
|
|
|
а- |
|
|
|
|
||
кимсубстратомявляется |
|
оксалоацетат (щавелевоук- |
|
|
|
|
||||||
суснаякислота |
). |
|
|
|
|
|
|
|
|
|
||
2. Компартментализация |
|
|
|
|
|
|
|
|
||||
|
|
Компартментализация – |
это |
сосредоточение |
|
|
|
|
||||
ферментовиихсубстратоводномкомпартменте |
|
|
|
|
|
|
|
|
||||
(однойорганелле) |
– |
в эндоплазматическомретику,митохондриях, умеизосома. |
|
|
|
|
Напри- |
|||||
мер, β-окислежиркислотпротекаетныхиевмитохондриях,синтезбелка |
|
|
|
|
|
|
– врибосомах. |
|||||
3. Генетическаярегуляци |
– изменениеколичествафермента |
|
|
|
|
|
||||||
|
|
Изменениеколичествафермента |
|
|
можетпроисходить |
врез ультатеувеличенияилисн |
и- |
|||||
жения его синтеза. Сэтозренияйчкиферментыможноподртриагруппызделить: |
|
|
|
|
|
|
||||||
o |
|
конституитивные – такиеферменты,котор е |
|
|
образуютсяв |
клеткепостоянно. |
|
|||||
o |
|
индуцируемые (адаптивные) |
– синтэтихфермевозрастаетпринтоваличиисоо |
|
|
т- |
||||||
|
ветствующихимуловиндукторов( ). |
|
|
|
|
|
|
|
|
|||
o |
|
репрессируемые – образованиетакихфермклпринеобходимоститкевпода |
|
|
|
в- |
||||||
|
ляется. |
|
|
|
|
|
|
|
|
|
|
|
|
|
Изменескоростисиферментатезаиеиндукция( илирепрессия)обычнозав |
|
|
|
|
|
|
|
иситот |
||
количестваопредегорилименныхоноветабпр.оцессалитов |
|
|
|
|
|
|
|
|
||||
|
|
Примеры индуцируемых ферментов: |
|
|
|
|
|
|
||||
o |
исчезновениепищеварительныхферменпридлиголоданииельномовиндукцияих |
|
|
|
|
|
|
|
|
|||
|
|
синтезаввосстановительперезультатеиодвозобсекрециингоыйвлениярмонов |
|
|
|
|
|
|
|
|||
|
|
ЖКТ, |
|
|
|
|
|
|
|
|
|
|
o |
гормоныглюкокортикоидыстимулируютсинтезферменсинтезаглюкозы(ов |
|
|
|
|
|
|
|
о- |
|||
|
|
неогенеза),чтообестабпечконцильностьваглюкевнтрациикрпридлвизы |
|
|
|
|
|
|
|
и- |
||
|
|
тельнголиустойчданииимЦНСкстрес, востьу |
|
|
|
|
|
|
|
|
||
o |
токсубстратыическнапр( ,этанолибарбитемер |
|
|
|
|
ураты)стимулируютвпечениси |
н- |
|||||
|
|
тезсвоего" "изоферментацитохромаР450,которыйок обезсляетэтивреживает |
|
|
|
|
|
|
е- |
|||
|
|
щества. |
|
|
|
|
|
|
|
|
|
|
|
|
Примеры репрессируемых ферментов: |
|
|
|
|
|
|
||||
o |
подавлениесинтезатриптофанабактериямипридея ельнриптоперонастифа ового |
|
|
|
|
|
|
|
||||
|
|
(смРегуляция" транскр |
ипции"), |
|
|
|
|
|
|
|
||
o |
впеченирепрессияферментасинтезахолестеролаГМГ |
|
|
|
|
-SKoA-редуктазыподвлиянием |
|
|||||
|
|
холестеринажелчныхкислот. |
|
|
|
|
|
|
|
|
|
|
4. Ограниченный (частичный) |
протеолиз проферментов |
|
|
|
||||||||
|
|
Синтез некоторых ферментовосуществляетсявиде |
|
|
болеекрупного |
предшественника |
||||||
(трипсиноген, пепсиноген,прокарбоксипептидазы ,факторысвертыкрования |
|
)и при |
||||||||||
поступлениивнужноеместо |
|
этотфермент |
активируетсячерезотщеплениенегоодного |
|
|
|
||||||
илинесколькихпептидныхфрагментов. |
|
|
|
|
|
|
|
|
|
|||

biokhimija.ru |
|
|
|
|
ТиминО.А. |
Лекции по общей биохимии (2018г) |
65 |
|||
|
|
|
|
|
|
|
|
|||
Секррядафециярментовзапределы |
|
|
|
|
|
|
|
|||
клеткив |
неактивномсостояниипозволяет |
|
|
|
|
|
|
|||
предохранитьклеткиотповреждения( |
|
|
|
и- |
|
|
||||
щеварительныеферменты)илисохранить |
|
|
|
|
|
|
|
|||
белокдонаступленияопределенногом |
|
|
|
|
о- |
|
|
|||
мента( |
протромбин, |
фибриноген, |
белки |
|
|
|||||
комплемента). |
|
|
|
|
|
|
|
|
|
|
5.Аллостерическаярегуляция |
|
|
|
. |
|
|
|
|||
Аллостерическиеферментыпост |
|
|
|
рое- |
|
|
||||
ныиз |
двухиболеесубъединиц |
|
|
: |
одни |
|
|
|||
субъединицы |
содержат |
|
каталитический |
|
|
|||||
центр,друг |
иеявляю |
тсярегуляторн |
ыми. |
|
|
|||||
Присоединениеэффектора |
|
|
|
|
аллостериче- |
|
|
|||
ской (регуляторной) субъединице изменяет |
|
|
||||||||
конформациюбелкаактивность |
|
|
|
|
катали- |
|
|
|||
тической субъединицы. |
|
|
|
|
|
|
||||
Аллостерическиеферментыобычно |
|
|
|
|
|
|
||||
стоятвначалеметабпутей,иотлических |
|
|
|
|
|
|
|
|||
ихактизависиттеченностимногихп е |
|
|
|
|
|
|
о- |
|
|
|
следующихреакций.Поэтомуоничасто |
|
|
|
|
|
|
|
|
|
|
называются ключевыми ферментами. |
|
|
|
|||||||
Вкачестве |
|
отрицательногорегулят |
о- |
|
|
|||||
ра может выступать конечныйметаболит |
|
|
|
|||||||
биохимичепроцесскогоа |
|
|
, |
продукт данной |
|
|
||||
реакции,т.работа |
|
ет механизм обратной |
|
|
||||||
отрицательной связи.Еслирегуляторами |
|
|
|
|||||||
являютсяначальныйметаболитилису |
|
|
|
|
|
б- |
|
|
||
стратреакции,тоговорят |
|
|
|
|
|
прямой регу- |
|
|
||
ляции,о наможетбытькакположительной, |
|
|
|
|
||||||
такиотрицательной. |
|
Такжерегулятором |
|
|
|
|||||
могутбытьметаббиохимическихл ты |
|
|
|
|
|
|
|
|||
путей,каким |
-тообразомсвязд нных |
|
|
н- |
|
|
||||
нойреакцией. |
|
|
|
|
|
|
|
|
|
|
Наприэнергетического,фермент |
|
|
|
|
|
|||||
распадаглюкозы, |
|
|
фосфофруктокиназа, |
|
|
|||||
регулируетсяпромежуточнымиконе |
|
|
|
|
ч- |
|
|
|||
нымипродуктами |
|
этогораспада |
. Приэтом |
|
|
|||||
АТФ, |
лимоннаякислота |
|
|
, фруктозо-1,6- |
|
|
||||
дифосфат являютсяингибитора |
|
|
ми,афру |
к- |
|
|
||||
тозо-6-фосфатиАМФ |
|
|
– активаторами фермента. |
|
|
|||||
6.Белок -белковоевзаимодействие |
|
|
|
|
||||||
Терминбелок |
|
-белковоевзаимодействобозначаетситуац,когдакачриеюствегул |
|
я- |
||||||
торавыступнеметаболитют |
|
|
|
|
|
ыбиохимичепроцес,а совких |
специфичные белки. |
Влияние |
||
каких-либофакторовнаэтибелкиизменяетихактони, ,всвочересть,ювоздеь |
|
|
й- |
|||||||
ствуютнанужныйфермент. |
|
|
|
|
|
|
аденилатциклаза являетсячувствительнымкво |
|
||
К примеру,мембранныйфермент |
|
з- |
||||||||
действиюмембранного |
|
G-белка,которыйс ктивмпрдействиинаруетсяклетнекоту |
|
о- |
||||||
рыхгормонов( |
например, |
адреналинаи глюкагона). |
|
|
||||||

Ферменты |
66 |
|
|
Другимпримеромбелок |
-белкового взаимодействия можбытьрегуляци |
я активности |
||
протеинкиназы А. Протеинкиназа Аявляетсятетрамернымферментом,состоящимизк2 |
|
а- |
||
талитическихС)( регуляторных2 ( |
R)субъед.Актиницватором |
для протеинкиназы Ая в- |
||
ляется цАМФ.ПрисоединениецАМФкрегуляторнферментсубъединицвызывамет |
|
|
||
изменениеих |
конформации |
отхождение откаталитическсубъедин.Каталитическиецх |
|
|
субъединицыприэтомактивируются. |
|
|
|
|
7. Ковалентнаяхимическая( )модификация |
|
|
|
|
Ковалентнаямодификация |
заключвобрприсаетилимомяединениитщеплении |
|
||
опредегруппы,благоденнойчемуизменяактивноряфе.тсярментаЧащестакойеготь |
|
|
|
|
группойявляется |
фосфорнаякислота |
,режеметильныеацетильнгрупп.Фосфорилые |
и- |
|
рованиеферментапроипостаткходит |
|
|
амсерина,треонина,тирозина. |
Присфоединение с- |
форнойкислоты |
кбелку осущферментыствляют |
протеинкиназы, отщепление – протеин- |
||
фосфатазы. |
|
|
|
|

biokhimija.ru |
ТиминО.А. |
Лекции по общей биохимии (2018г) |
|
|
67 |
|
|
|
|
|
|||
Ферменмогутбытьаккакивныфосфорилированном,так |
|
|
дефосфорилирован- |
|||
номсостоян.Напр,фериимернты |
гликогенфосфорилаза и гликогенсинтаза вмышцах |
|||||
принагрузке |
фосфорилируются,приэтомфосфорилазагликогенстановитсяактивной |
|
|
|
и |
|
начинаетрасщеплениегликогена, |
гликогенсинеактивнза |
а.При |
отдыхеи |
синтезаглик |
о- |
|
гена оба фермента дефосфорилируются,синтаза приэтом |
становитсяактивной,фосфорил |
|
а- |
|||
за – неактивной. |
|
|
|
|
|
|
И Н Г И Б И Р О В А Н И Е Ф Е Р М Е Н Т О В
Вмедицинеактивноразрабатываютсяиспользуютсясоедин,измактеняющие |
|
|
|
в- |
|
ностьферментовцельюрегуляциискоростиметаболическихреакцийуменьшениясинт |
|
|
|
е- |
|
заопределенвеществорга. ныхизме |
|
|
|
|
|
Подавлактивфеобычнормиеостиназынтовнгибирают,одэтнеакованием |
|
|
|
|
|
всегдакорректно. |
Ингибитор – этовещество,вызывающее |
|
специфичное снижениеакти |
в- |
|
ностиферме.Такимобразом,нтаеорганичкислотытяжеские |
|
|
ыемет аллыингибиторами |
|
|
неявляются,но |
являются инактиваторами,т.к.снижаютактивность |
многих ферментов,.. |
|
||
действуют неспецифично. |
|
|
обратимым и |
||
1По.прочностисвязыванферментаингингибированиеябиторомбывает |
|
|
|||
необратимым. |
|
|
конку- |
||
2По.отношенингибкактивноцентюторафеингибированиермууентаделятна |
|
|
|||
рентное и неконкурентное. |
|
|
|
|
|
|
Н Е О БИРНАГТИИБМИОРЕО В |
|
А Н И Е |
|
|
Принеобратимомингибированпроисходит |
|
связывание или разрушение функцио- |
|||
нальныхгруппфермента,необходимыхдляпроявле |
|
нияегоактивности. |
|
||
Например, |
вещество диизопропилфторфосфат прочноинеобратимосвязывается |
|
|||
гидроксигруппой серина вактивномцентре |
ацетилхолинэстеразы,гидролизующейацети |
л- |
|||
холинвнервси.нИапсахых |
нгибирование этогофермента |
предотвращает распад ацетилхо- |
|||
линавсинаптищели,врезультадальнейшчегоотсутствускойпередачасигнпот лая |
|
|
|
|
|
нерву. |
|
|
|
|
|

Ферменты |
68 |
|
|
Ещеодинпримерсвязанингибированием |
ацетилсалициловойкислотой |
(аспир и- |
ном)ключевогоферментасинтезапр стагландинов |
– циклооксигеназы.Эт акислота |
входит |
всоставпротивовосредспалительныхтв |
используетсяпривоспалительзаболеванияхых |
|
илихорадсост. оянияхчых |
Присоацегруппытдикгидроксильнойнегруппеие |
е- |
ринавактивномцентфевызыврмеиенактивациютапоследнегоетпрекращение |
синтеза |
|
простагландинов. |
|
|
|
|
К О Н К У Р Е Н Т Н О Е И Н Г И Б И Р О В А Н И Е |
|
|
|||
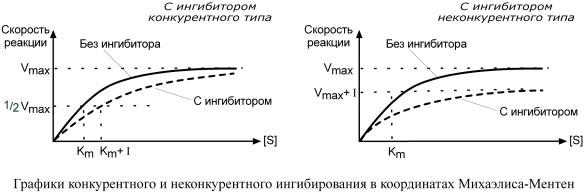
Притакомвиденгингибиторбированияпосвоейструктуре |
|
|
похожнасубстрат |
фер- |
|||
мента.Поэтомуонсоперничабстразаактивныйцентром |
|
|
|
(законтактныйучасток) |
|
,что |
|
приводиткуменьшениюсвязываниясубстфернарушениюментомата |
|
|
катализа. |
Вэтом |
|||
состоит собенность конкурентногоингибирования |
– возможностьусилиослабить |
|
н- |
||||
гибировачерезизмеконениесубстратацентрации. |
|
|
При данном ингибированиим |
акси- |
|||
мальнаяскорреакцииоствполнеаетьдосприятижимконцентрацийсозданиивыс ких |
|
|
|
|
|
||
субстрата. |
Например: |
|
этанола и метанола заактивныйцентр |
алкогольде- |
|||
1Конкурентное. взаимодействие |
|||||||
гидрогеназы. |
сукцинатдегидрогеназы малоновой кислотой,структуракоторой |
|
|||||
2Ингибирование. |
|
||||||
схожасоструктуройсубстратаэтогофермента |
|
|
– янтарнкислойты |
(сукцината) |
. |
|
|
3. Такжеконкурентнымингибиторамотносят |
антиметаболиты или псевдосубстра- |
ты,например,антибактериальны |
е средства сульфаниламиды,схожиепоструктуре |
biokhimija.ru |
|
ТиминО.А. |
Лекции по общей биохимии (2018г) |
69 |
||
|
|
|||||
п-аминобензойной кислотой, компфоклненти.слевотыйм |
При лечении сульфанила- |
|||||
мидами вбактериальнойклетке |
|
конкурентно нарушается использование п-аминобензойной |
||||
кислоты для синтеза дигидрофолиевойкислоты |
,чтоивызываетлечебныйэффект. |
|
||||
4Вкачестве. д |
ругихпримерлекарственныхонкурентныхингибиторовможнопр |
|
и- |
|||
вести |
ингсихолестеринабиторнтеза |
|
ловастатин,ингибирующийГМГ |
-SКоА-редуктазу, |
||
o |
|
|||||
o |
противоопухолевыйпрепарат |
|
метотрексат,подавляющийдигидрофолатредуктазу, |
|||
o |
непрямойантикоагулянт |
дикумарол,ко нкурентвитаминаК, |
|
|||
o |
антигипертензиныйпрепарат |
|
метил-ДОФА,подактивностьвляющийДОФА |
- |
||
декарбоксилазы, |
|
|
аллопуринол,ингибирующийксантиноксидазу. |
|
||
o |
средстволеченияподагры |
|
|
|
||
ИспользуятермкинМихаэлисаологетик ю |
|
|
-Ментенможсказать,чтонкурен |
т- |
||
ныйинги |
биторуменьшаетсродствоферменксубс,повышаятконстантуратуМихаэлиса |
|
|
|||
(Km),макскоростьимальнаяреакции( |
|
|
Vmax)остаетсяприэтомнеизменнной. |
|
||
|
Н Е К О НИКНУГРИЕБНИТ Н О Е |
Р О В А Н И Е |
|
|||
Данвингибидыйсвязанприсоединениемоваингибитораиявактивном |
|
|
|
|
цен- |
|
тре,авдругместемолекулы. |
|
Этомбытьжеталлостерическоеингибирование,когда |
|
|
к- |
|
тивностьфермснижаетсястественныминтамодуляторамисм(выше) |
|
синильнаякислота |
|
, илисвязывание |
|
|
ферментомкаких |
-либотоксинов. |
Например, |
|
(цианиды)связывается |
|
|
гемовымжелф рмензомдыхацепиблокируетовельнойклеточноедыхание. |
|
|
|
|
|
|
Особнеконкурингибинностьюявляетспгоосногосвязыватьсяраобность |
|
|
никакневли |
я- |
||
ферментомнезависиотсубстрата,..измеконениесубстратацентрации |
|
|
|
|||
ет наобразованиекомплексафермент |
|
-ингибитор. |
|
|
|
|
Максимскоростьреальнаякции |
(Vmax) приэтомснижается, |
константаМихаэлиса |
|
|||
(Km)неизменяется, |
т.е.добавлени |
е дополнительного субстратане |
может повлиять на состо- |
|||
яниеактивногоцентраработу |
|
фермента. |
|
|
|
|
|
Б Е С К О Н КИУНРГЕИНБТИНРООЕ |
В А Н И Е |
|
|||
Вэтомслучаеингибитсвязываетсянеконтактномручасткеферментакак(при |
|
|
|
|
н- |
|
курентнингибировании), сферментлько |
|
-субстратнымкомплексом.Поэтомуповыш |
|
е- |
||
ниеконцентрациисубстрата,увеличколичествоферментвая |
|
|
-субстратногокомплекса,ус |
и- |
||
ливаетсвязыванингибитораним. е |
|
Максимскоростьреуменьшаетсялькции. ая |
|
|
||
|
С М Е ШИНАГНИНБОИЕР О В А Н |
|
И Е |
|
||
Притакомнгингибиторбированприсоедспособенкактцентруи,вномуняться |
|
|
ивдругихчастяхмолекулы. |
Максимальнаяскоростьре |
акцииуменьшается. |
