
Тимин_О_А_Лекции_по_общей_биохимии
.pdf
Витамины |
|
|
50 |
|
|
|
|
Сутпотребностьчная |
|
|
|
400мкг . |
|
|
|
Строение |
|
|
|
Витаминпредставлясобойкомплизтрехсоскставляющих |
– птеридина,параамин |
о- |
|
бензойнойкисглукислотыаминовой. |
|
Остатков глутамата,соединенных |
через |
γ-карбоксильнуюгруппу, |
можетбытьразноеколичество. |
|
|
Биохимическиефункции |
|
– перенос одноуглеродных |
|
|
Непосредственнаяфункциятетрагислдр тыфолиевой |
||
фрагментов: |
N5-формил-ТГФКи |
N10-формил-ТГФК, |
|
o |
формила – всоставе |
||
o |
метенила – всоставе |
N5,N10-метенил-ТГФК, |
|
o |
метилена – всоставе |
N5,N10-метилен-ТГФК, |
|
o |
метила – всоставе N5-метил-ТГФК, |
|
|
o |
формимина – всоставе N5-формимино-ТГФК. |
||
|
Благспособностидаперодноуглеродняеносфрагменттьвитамин: ые |
|
|
|
o |
участвусинтезе |
пуриновых оснований |
тимидинмонофосфата, |
и,следовател ь- |
|
но,всинтезеДНК, |
аминокислот – обратимоепревращениегл сцина,рина |
|
|
o |
участвуетобмене |
|
||
|
N5-метил-ТГФК взаимодействуетвитаминомВ |
12, являясьдоноромметильнойгруппы |
|
|
|
припревращении |
гомоцистеина в метионин. |
|
|

biokhimija.ru |
ТиминО.А. |
Лекции по общей биохимии (2018г) |
51 |
|
|
|
|
Гиповитаминоз |
|
|
|
|
|
|
|
|
|
|
|
|
Причина. |
Пищевая |
недостаточность,кислыепродукты,тепловаяобработкапищи, |
|
|
|
|
||||||
приемлекабарбитураты( ств, |
|
|
|
|
сульфаниант,инекбицитостатикиламидыоторые |
|
|
|
– |
|||
аминоптерин, |
метотрексат),алкоголизмбеременность. |
|
|
|
|
|
|
|||||
Клиническаякартина. |
|
|
Впервуюочередьзатрагиваютсяорганык |
|
роветворения: |
ак |
||||||
какклеткинетеряютспособностирас |
|
|
|
|
ти, ивних |
происходитн |
арушениес |
интезаДНК |
с |
|||
остановкойделения, |
|
|
то это приводитк |
образованию мегалобластов (крупныхклеток |
) и ме- |
|||||||
галобластической анемии. Потойжепричине |
отмечается лейкопения. |
|
гастриты, |
|||||||||
Аналогичноразвиваетсяп |
|
|
оражениеслизистых |
желудкаикишечноготр( кта |
|
|
||||||
энтериты), глоссит. |
|
|
|
|
|
|
|
|
|
|||
Отмечаетсяз |
амедлениероста, |
конъюнктивит, ухудшение заживленияран,иммунод |
|
|
е- |
|||||||
фициты,оживлехроничсубфебрилитетесккц.ихй |
|
|
|
|
|
|
|
|
||||
Лекарственныеформы |
|
|
|
|
|
|
|
|
|
|
|
|
Фолинаткальция. |
|
|
|
|
|
|
|
|
|
|
|
|
Антивитамины |
|
|
|
|
|
|
|
|
|
|
|
|
АнтивитаминомВ |
9 |
являетсягруппалекарственныхантибактериальныхсоединений |
– парааминобен- |
|||||||||
сульфаниластруктурносхожихкомфидовпклнентслевотыйм |
|
|
|
|
|
|||||||
зойной кислотойПАБК()В.бактериальнклетпроисхконкуренцияз йдит |
|
|
|
|
аактивный |
|||||||
центрферментаинарушаетиспользованПАБКдлсинтезаяфолк ,чтслевотый |
|
|
|
|
|
|
|
е- |
||||
деткпрекращениюсинтезатимидинуклеотидового |
|
|
|
|
а,подавлениюсинтеДНКраз |
|
|
|
мно- |
|||
жениябактерии. |
|
|
|
|
|
|
|
|
|
|
|
|
|
В И Т А М И Н В 1 2 ( К О Б А Л А М И Н , А Н Т И А Н Е М И Ч Е С К И Й ) |
|
|||
Источники |
|
|
|
|
|
Изпищепродуктоввитаминыхсодержат |
|
толькоживпродукты:тныепечень,рыба, |
|
||
почки,мясо |
.Такжеон |
синтезируетсякишечнмикр,однанедофлоройквоза моана |
|
ж- |
|
новстьасывания |
витамина внижнихотделахЖКТ. |
|
|
||
Сутпотребностьчная |
|
|
|
|
|
2,5-5,0мкг . |
|
|
|
|
|
Строение |
|
|
|
|
Co3+ |
Цианкобаламинс |
одержитпиррольных4 кольца,ионкобальтас(валентностьюот |
|
|||
до Co6+),группу |
CN–. Ворганизмеприсинтезекофформрментных |
цианиднгруппая |
CN– |
||
заменяется метильной или 5'-дезоксиаденозильной.

Витамины |
|
|
|
|
52 |
|
|
|
|
|
|
Метаболизм |
вкишечнике необходим внутреннийфакторКасла |
|
|||
Длявсасывания |
– гликопротеин, |
||||
синтезируобкладочнымиклеткамижелудкамый. |
|
|
Вкровитранспортируетсяввидегидро |
к- |
|
сикобаламспецифичестранспортнымибелкамина( ими |
|
|
α- и β-глобулинами). |
||
Биохимическиефункции |
|
|
– реакции изомеризации и метилирова- |
||
Витамин 12 участвуетд ухидре хкций |
|||||
ния. |
|
|
|
|
|
1. Основой изомеризующего действия витаминаВ |
12 являетсявозможноспособствовать |
|
|||
переносу атома водородана |
атом углерода вобменнакакую |
-либогруппу. |
|
||
Этоимеетзначениевпрокицеослсетатковния |
|
|
|
жиркислотнеыхчетным |
с- |
||
лом атомовуглерода,приутилизацииуглеродногоскелета |
|
|
|
|
треонина, валина, |
лейцина, |
|
изолейцина, метионина,боковойцепи |
холестерола прикотором |
образуетсяостатокпроп |
и- |
||||
оновойкисло |
ты,котокарбоксилируетсяыйдометилмалонила |
|
|
|
идалеепревсуращается |
к- |
|
цинил-SКоА – метаболитЦТК. |
|
|
|
|
|
|
|
2. Вреакции |
трансметилирования присинтеземетионина |
метилкобаламинвыступает |
о- |
||||
средникомприпереносе |
CH3-группыотметил |
-ТГФКнагомоцистеин. |
|
||||
Гиповитаминоз |
|
|
|
Причина. Увегетарианцев – пищеваянедостаточность, |
однако чащеп |
ричиной являет- |
|
ся неотсутствиепище,аплохоевсасывание |
врезультате |
заболеванийжелудкакишечн |
и- |
ка( атрофический гастритэнтериты). |
|
|
|
Также иногда встречаютсяаутоиммунные |
нарушения,прикотооб антитыхазуются |
е- |
|
лапротивобкладочныхклетокжелудкаипротиввнутреннегофактораКасл |
|
|
(пернициозная |
анемия),чтопрепятвитамуетвсасы.ванинаю |
|
|
|

biokhimija.ru |
|
ТиминО.А. |
Лекции по общей биохимии (2018г) |
|
|
53 |
|||
|
|
|
|
|
|
|
|
|
|
Клиническаякартина. |
|
|
|
|
|
|
|
|
|
1. Макроцитарнаяанемия |
, прикоторой |
количествоэритроцитов |
сниженов3 |
|
-4раза. |
Она |
|||
возникаетчащеупожил,номожетбытьиудетейх. |
|
|
|
Непоспричедственной |
инойан |
е- |
|||
мии являетсяпотеряфолкикслеветкамиприонедостаточйывитамиВ ностиа |
|
|
-заснижения |
синтезапурин |
овыхнуклеот |
12 и, |
|||
какследствие, |
замедление деления клетокиз |
и- |
|||||||
дов иТМФ. |
|
|
|
|
|
|
|
|
|
2. Неврологические нарушения: |
|
|
|
|
||
o |
замедлениеокисления |
жирныхкислот |
снечетнымислоатомовуглерода |
инако |
п- |
|
|
ление токсичногометилмалоната |
вызывает жировуюдистрофию |
нейронов и демиели- |
|||
|
низацию нервныхволокон |
.Это проявляетсяонемени |
икистей |
и стоп,ухудшениип |
а- |
|
|
мяти, нарушениипоходк, |
снижении кожнойчувствитель,нарушености |
и сухожиль- |
|||
|
ныхрефлексовахил( ,ко) енный |
|
, |
|
|
|
o |
нехваткаметиопосредуактивностиснижениенинамакц лированияй |
|
|
,в |
|||
|
частности, уменьшается синтез нейромедиатора ацетилхолина. |
|
|
||||
Лекарственныеформы |
|
|
|
|
|
||
|
Цианкобаламин,к обамамид,о ксикобаламин. |
|
|
|
|||
|
|
В И Т А М И Н Н ( Б И О Т И Н , А Н Т И С Е Б О Р Е Й Н Ы Й ) |
|
||||
Источники |
|
|
|
|
|
|
|
|
Изпищепродуктоввитаминыхсоде,почкиржатчень,горох,соя,цветнаякапуста, |
|
|
|
|
||
грибы.Такжеонсинтезируетсякишечной |
|
микрофлорой. |
|
|
|
||
Сутпотребностьчная |
|
|
|
|
|
||
|
150-200мкг . |
|
|
|
|
|
|
Строение |
|
|
|
|
|
|
|
|
Гетероциклчастьмолекулысостоизческаяидазольнт |
|
о- |
|
|
||
гоитиофеноновогоциклов. |
Кпоследнемуприсоединенавалери |
а- |
|
|
|||
новаякислота,которая |
|
через COOH-группу связываетсялиз |
и- |
|
|
||
номбелковойчасти |
молекулы. |
Биотин-лизиновыйко ъюгат |
о- |
|
|
||
ситназвание |
биоцитин. |
|
|
|
|
|
|
Биохимическиефункции |
переносе СО2 либо изНСО 3– (реакциикарбоксилирования),либо |
|
|||||
|
Биотинучаствует |
|
|||||
от R-СООН (реакция транскарбоксилирования). Этотперенос |
необходим: |
|
|
||||
o |
при синтезе оксалоацетата – биотин находивсоспируваткарбоксилазысяаве |
|
(см |
||||
|
"Обменуглеводов") |
, чтообеспечиваетподдержаниеактивностициклатрикарбоновых |
|
|
|
||
|
кислот иглюконеогенеза , |
|
|
|
|
||
o |
в синтезежирныхкислот |
|
– биотин находивсосацетилсяаве |
-SКоА-карбоксилазы |
|||
|
(см "Обменлипидов") |
, |
|
|
|
|
|
o |
в утилизацииразветвленуглеродныхцепей х |
|
прикатаболизме |
лейцина,изоле |
й- |
||
|
цинекоторнажирнкислотых |
|
– находивсоспропионилтсяаве |
-SКоА-карбоксилазы, |
|||
|
образующейметилмалонил |
|
-SКоА. Вдальнейшемметилмалонил |
-SКоАметаболизируетв |
|
||
|
реакцииизомерсучасвитаминазацииB12ием. |
|
|
|
|
|
|

Витамины |
54 |
Гиповитаминоз
Причина.Дисбактекомплекнарпоиозушениесвитаминовноетуплен,например, я
придлительном |
парентеральном питании.Вэкспериментеможетбытьвызванпотр блением |
|
большихколичествсырыхяиц( |
|
менее 12штуквдень)втечениедлитвременильного(2 |
недели),т.к.внихсодержитсягликопротеин |
авидин (анти,связывающийитаминбиотин). |
|
Клиническаякартина. |
Учеловека практически не встречается. Вэ ксперименте обна- |
|
руживаются дерматиты,выделениеж |
ирасальнымижелезамикожсеб( ),поражениеея |
|
ногтей,выпадеволос,анемия, иеорекдепрессия, ,у талость,сонливость |
. |
|

ФЕРМЕНТЫ
Основувсехжизненныхпроцессовсоставляюттысячиимреакций,ческихкатализ |
и- |
|
руемыхфермента.ЗначенточмиобразноеиеопределилтовИ..Павлов,назвавих |
|
|
"возбудителямижизни |
".Нарушвработеферменвозникновениювниякдуттяжелых |
а- |
болеванийфени( ,глкетонугалактоземияикогенозы, ,тир) существенномунемия |
|
|
снижениюкачестважизнидислипопроте( ,гемофил). инемии |
|
|
Известно,чтодля |
у- |
|
ществлхимическойр акцииния |
|
|
необходимо,чтобыреагиру |
ю- |
|
щиевеществаимелисуммарную |
|
|
энергиювыше,чемвеличина, |
|
|
называемаяэнергетическимб |
а- |
|
рьеромреакции.Дляхарактер |
и- |
|
стикивеличиныэнергетического |
|
|
барьераАррениусввелпонятие |
|
|
энергииактивации |
.Преодол е- |
|
ниеэнергактвхимвации |
и- |
|
ческойреакциидостигаетсял |
и- |
|
боувеличениемэнергвзаим |
о- |
|
действующихмолекул, |
напри- |
|
мер, нагреванием,облучением,повышедавления,либос тремждлябуениреамых |
|
|
к- |
|||||
циизатратэнергии..( актии |
|
|
вации)припомощикатализаторов. |
|
|
|
||
|
Посвоейфункцииферментыявляютсябиологическимикатализат.Сущн рамисть |
|
|
|
|
|||
действияферм,такжкакнеорганическихнтовкатализаторов,заключается: |
|
|
|
|
|
|||
o |
вактива циимолекулреагирующихвеществ, |
|
|
|
|
|||
o |
вразбиенреакциинанесколько |
|
стадий,энергетическийбарьеркаждо |
й изкоторых |
||||
|
нижетаковогообщейреакции. |
|
|
|
|
|
||
|
Одэнакоергетичесреакцииневозможныефермекатализироватьбудуттые,они |
|
|
|
|
|||
усктотереакцльяют,комтоирыедтигутвданныхусловиях. |
|
|
|
|
|
|||
|
|
|
Э Т АФПЕЫР М Е Н Т А Т И В Н О Г О |
К А Т А Л И З А |
|
|
||
|
Вф ерментатреакцииможновыделитьследующиевнойэтапы: |
|
|
|
|
|||
1. Присубстратаоединение |
(S) кферменту (E) собразованиемфермент |
-субстратногоко |
м- |
|||||
|
плекса( |
E-S). |
|
|
|
|
|
|
2. |
Преобферментазование |
-субстратного |
|
|
|
|||
|
комплексаводинилинесколькопер |
|
е- |
|
|
|
||
|
ходныхко |
|
мплексов (E-X) заоднуили |
|
|
|
|
|
|
нестадийколько. |
|
|
|
|
|
|
|
3. Превращениепереходногокомпл кса |
|
|
|
|
|
|||
|
комплексфермент |
-продукт (E-P). |
|
|
|
|
||
4. Отделконпрениечныхоферментадуктов. |
|
|
|
|
|
|||
|
|
|
|
М Е Х АК НА ИТ АЗ МЛ ИЫЗ А |
|
|
|
|
|
1. Кислотно-основнойкатализ |
– вактивномцентфенаходятсярмегруентасппы |
|
|
е- |
|||
цифичныхами |
|
нокиостатков,лотявляютсяорыеныххордонорамишимиилиакцепт |
|
|
о- |
|||

Ферменты |
|
|
56 |
|
|
|
|
|
|
|
|
рамипротонов.Такиегруппыпредставляютсобмощныекатализаторыймноорганичих |
|
|
|
е- |
|
скихреакций. |
|
|
|
|
|
2. Ковалентныйкатализ |
– ферменты реагируют |
Доноры |
|
Акцепторы |
|
сосвоимисубст,обприрапомощитамизуяков |
а- |
-СООН |
|
-СОО– |
|
лентныхсвязочнестабильньйферментые |
- |
-NH3+ |
|
-NH2 |
|
субстратныекомплексы,изкоторвходевнутримх |
о- |
-SH |
|
-S– |
|
лекулярныхперестроекобразуютсяпродуреа. кцииты |
|
-OH |
|
-O– |
|
Т И ФП ЫЕР МРЕ Н Т А Т И В Н Ы Х |
Е А К Ц И Й |
|
|
|
|
1. Тип "пинг-понг" – фермент сначалавзаимодействуетсубсА,отбираяратомн |
|
|
е- |
|
|
го какие-либо химическиегруппыпреговсоответствующийращаяпродукт |
|
|
PA.Затемк |
|
|
ферментуприсубстратоединяетсяВ,получающийэтих мическиегруппы.Примя ром |
|
|
|
в- |
|
ляютсяреакциипереносаам ногрупп |
аминокислотнакетокислотысм(Трансаминиров" |
|
а- |
|
|
ние"). |
|
|
|
|
|
2. Типпоследовательныхреакций |
– кферментупоследовательноприсоединяются |
|
|
|
|
субстратыАиВ,образуятройн" комплекс", чегойслеосуществляется |
|
|
катализ.Продукты |
|
|
реакции PA и PB такжепоследовател |
ьноотщепляютсяфермента. |
|
|
|
|
3. Типслучвзаимодействиййных |
– субстАиВприсоатыкфединяютсяврменту |
любомпорядке,неупорядоченно,ипослекатажеотщепляютсялизак. |
|

|
biokhimija.ru |
|
ТиминО.А. |
Лекции по общей биохимии (2018г) |
|
57 |
||||
|
|
|
|
|
|
|
|
|
||
|
|
С Х ОИДОСТФТЛВИЕОЧ И Я |
|
|
Р МИЕ Н Т О В |
|
|
|
||
|
|
Н Е О РКГААТНАИЛЧ Е С К И Х |
И З А Т О Р О В |
|
|
|
||||
|
Сходство |
|
|
|
Отличия |
|
|
|
||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||
|
1. Катализируюттолькоэнергетически |
|
|
|
1. Скоростьферментативнойакции |
|
|
|
||
|
возможныереакции. |
|
|
|
|
|
намноговыше. |
|
|
|
|
2. Неизменяютнапреакциавлен. ия |
|
|
|
|
2. Высокаяспецифичность. |
|
|
|
|
|
3. Ускоряютнаступлениеравновесияреа |
|
|
к- |
3. Мягкиеусловияработывнутриклето( |
ч- |
|
|
||
|
ции,нонесдвигаютего. |
|
|
|
|
|
ные). |
|
|
|
|
4. Нерасходуютвпроцесреакции. ся |
|
|
|
|
4. Возможнрегулискоростьваниясти |
|
е- |
||
|
|
|
|
|
|
|
акции. |
|
|
|
|
|
|
|
|
|
5. Скоростьфермепрнтативнойакции |
о- |
|
|
|
|
|
|
|
|
|
|
порциональнаколичествуфермента. |
|
|
|
|
|
|
|
|
|
|||||
|
|
С Т РФОЕЕРНМИЕЕН Т О В |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||
|
Давновыясн,чтовсеф рментыявляютсянобелкамиобладаютвсемисвойствами |
|
простые и сложные. |
|
|
|
||||
|
белков.Подбелкамделятсябнонина |
|
|
|
|
|
|
|||
|
Простые ферменты состояттолькоизаминокислот |
– нап, римерепстрипсин, ,лиз |
|
о- |
||||||
|
цим. |
|
холоферменты)име ютвсвоемсоставебелковуючасть,состо |
|
|
|
||||
|
Сложные ферменты( |
|
я- |
|||||||
|
щуюизаминокислот |
– апофермент,инебелковуючасть |
– кофактор.Кофактор ,всвоюоч |
е- |
||||||
|
редь,можетназываться |
коферментом или простетической группой. Примероммогутбыть |
|
|
|
|||||
|
сукцинатдегсодержит( ФАД),ам дрогенотрансаза |
|
|
|
|
феразысодержат( пиридоксальфосфат), |
|
|
|
|
|
пероксидазасод( г).мржит |
|
|
|
|
|
|
|
|
|
Усложныхферментовактивномцентобязрае сположенытельнофункциональные |
|
|
группы кофактора. Кофакторучаствсвязываниисубстратаетилиегопревращении. |
Для |
|
осуществлениякатализа |
необходимполнкомапобелкаценныйилекскофактора, |
т- |
дельнкатализониосуществитьтинемогут. |
|
|

Ферменты |
58 |
|
|
2. Аллостерический центр( |
allos – чужой) |
– центррегуляцииактивностифермента, |
|
|
ко- |
|||
торый простротделенанстктивенноног |
|
центра и имеется неувсех |
ферментов.Связ |
ы- |
||||
ваниес |
аллостерическимцентром |
|
какой-либомолекулыназываемой( актиингливатором |
|
|
и- |
||
би,такжеэффектороммодулятором, ,регулятором)вызываетизмеконениефигур |
|
|
|
|
а- |
|||
циибелка |
|
-фермента и,какследствие,скоростиферме.нтативнойакцииВ |
|
|
качестветакого |
|
||
регулятора можетвыс упать |
продуктданнойилиоднзослйредующихакций |
|
,субстрат |
|||||
реакцииилииноевещество |
(смРегуляция" активностиферментов") |
|
. |
|
|
|||
Аллостерическиеферментыявляются |
|
полимернымибелками |
, |
ихактивныйрегул |
я- |
|||
торныйцентры |
находятсявразныхсубъединицах. |
|
|
|
|
|||
|
ИЗ О Ф Е Р М Е Н ТЫ |
|
Изоферменты – этомолекулярныеф рмыднтогои жефермента,возникшие |
е- |
|
зультатенебольшихгенетическихразличий |
впервичнойструктурефермента, катализ |
и- |
рующие однуитужереакцию |
. |
|
Изоферментыотличаются |
сродством ксубстрату,максимальной |
скорости катализиру- |
емойреакции,разной |
чувствительности крегулятораминг( активаторыбиторы), |
усло- |
виям рабооп( тимумы |
pH итемпературы). |
|
|
|
|
||
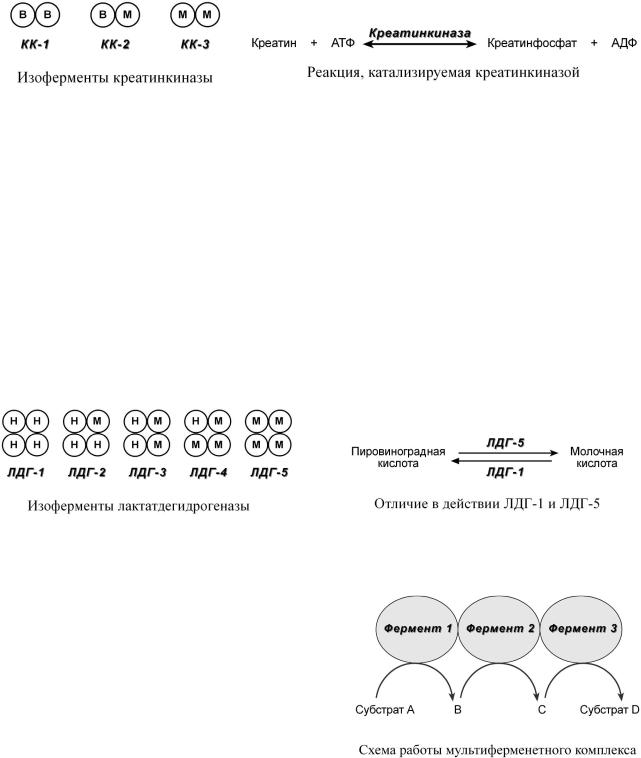
Какправило,изоферментыимеют |
четвертичную структуру, |
т.е.состоятиздвухили |
|
|
|||
болеесубъединиц. |
|
Например, |
димерный фермент креатинкиназа представлентремяиз |
о- |
|||
ферментнымиформами,составленнымииздвухсубъедпов ниц |
|
|
: M (англ. |
muscle – мыш- |
|||
ца) и B (англ. |
brain – мозг) .К реатинкиназа-1 состоитизсубъединиц |
|
ипа B,локализуетсяв |
||||
головноммозге |
,креатинкиназа -2 – пооднойМиВсубъединице |
активнамиокарде |
, креа- |
||||
тинкиназа-3 – двеМ |
-субъединицы,специфичнадляскелетноймышцы. |
|
|
|
|
||
biokhimija.ru |
ТиминО.А. |
Лекции по общей биохимии (2018г) |
59 |
|
|
|
|
Ещеоднимпр меромзоферментовявляетсягруппа |
|
|
|
гексокиназ,которые присоеди- |
||||
няютфосфатнглюкозегруппк у |
|
|
|
и вовлекаютглюкозувреакцииклеточногометаболизма. |
|
|
||
Изчетырехизоферментов |
|
выделяется гексокиназа IV (глюкокиназа) котораяотличается |
|
|||||
остальизоферменизкимыхсродсглюкозеинечувствительностьюовм кин |
|
|
|
|
гибирова- |
|||
ниюпродуреа. ктомции |
|
|
|
|
лактатдегидрогеназы (ЛДГ) |
|
|
|
Также существуетпятьизоферментов |
|
|
– фермента,учас |
т- |
||||
вующегообменеглюкозы.Отличиямеждунимизаключаютсявразнсоотношениисубм |
|
|
|
|
|
ъ- |
||
единиц Н (англ. |
heart – сердце)и |
М (англ. |
muscle – мышца) |
. Лактатдегидртиповгеназы |
1 |
|||
(Н 4) и 2 (H3M1) присутствуют втксаэробнымняхобменом( |
миокард, |
мозг,корксловый |
и- |
|||||
почек), обладаютвысосродствомкмолочнимкислолак( ) тйатуе |
|
|
|
ипревращаютего |
||||
руват. ЛДГ-4 (H1M3)иЛДГ |
-5 (М4)наход ятся втканях,склонных |
канаэробобме( ному |
пе- |
|||||
чень, скелетные мышцы,кожа,мозгслпочеквой |
|
),облада ютнизкимсродствомлактату |
|
|||||
икатализируютпревращениепируваталак. |
|
|
|
|
Втканяхспромежуточнымтипомобмена |
|
|
|
(селезенка,поджелудочн ая железа,надпочечник и,лимфатически е узлы) преобладает ЛДГ-3 (H2M2).
|
|
МУ Л Ь Т И Ф Е Р М Е Н Т Н ЫЕ КОМ ПЛЕКСЫ |
|
|||
Вмультифкомплексен рментномскол |
|
|
ь- |
|
|
|
коферментовнапример( ,Е |
|
1,Е 2,Е 3)прочносв |
я- |
|
|
|
занымеждусобойвединыйкомплексос |
|
|
|
у- |
|
|
ществляютрядпоследовательныхреакций, |
|
|
о- |
|
|
|
торыхпродуктреакции |
|
непосредственнопер |
е- |
|
|
|
даетсянаследующийферментявляетсятолько |
|
|
|
|
|
|
егосубстр.Благодарякомплексамкитом |
|
|
|
|
|
|
значительноускоряетсяп остьевращения |
|
|
|
|
|
|
молекул. |
|
|
пируватде- |
|
|
|
Книмотносятся, |
|
апример, |
|
|
||
гидрогеназный комплекс,превращающий |
и- |
|
|
|||
руватацетил |
-SКоА, |
α-кетоглутарат–дегидрогеназный комплекс,превращающий |
||||
α-кетоглутаратвсукцинил |
|
-SКоА,комплексподназванием |
"синтазажирныхкислот |
" (или |
||
пальмитатсинтаза),синтезирующийпальмитиновуюкислоту |
|
. |
|
|||
