
Гидролиз солей
Молекулярная причина гидролиза – поляризационное взаимодействие ионов с сильно полярной молекулой воды. Катионы и анионы вторгаются в равновесие диссоциации воды, нарушают его, в результате в случае катиона р-р становится кислым (гидролиз по катиону), в случае аниона – щелочным (гидролиз по аниону).
Гидролиз по катиону - гидролиз соли образованной катионом слабого основания и анионом сильной кислоты. В результате гидролиза по катиону будет происходить подкисление среды (pH< 7). Лакмус изменяет цвет на красный, фенолфталеин не изменяет цвет.

Гидролиз по аниону - гидролиз соли образованной катионом сильного основания и анионом слабой кислоты. В результате гидролиза по аниону будет происходить подщелачивание среды (pH> 7). Лакмус изменяет цвет на синий, фенолфталеин на красный.
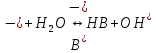
Соль слабой кислоты и слабого основания. Здесь в обменной реакции с водой участвуют и катионы и анионы. Гидролиз имеет место и по катиону, и по аниону одновременно; рН может быть равно 7, может быть <7, может быть ˃7. Это зависит от величин констант диссоциации кислоты и щелочи. Чья константа диссоциации больше – та и реакция.

Промышленное получение водорода.
Основное сырье для получения молекулярного водорода в промышленности-природный газ,преобладающий компонент которого метан. Переработка газа осуществляется 2 способами:
1)конверсия метана CH4 + H2O(пар)=3H2 + CO (800°С; кат.-Ni)
2)неполное окисление метана 2CH4 + O2 = 4H2 + 2CO
Образующийсямонооксид углерода также используют для получения водорода:
CO + H2O(пар) = Н2 + CO2 (500°С; кат.- Fe).Этот процесс называется конверсией CO.
Щелочные металлы
Всегда проявляют степень окисления +1. В свободном состоянии щелочные металлы не встречаются.
Получение Li — электролиз расплава хлорида и гидроксида лития
4) Si + 2Li2O = SiO2 + 4Li
Основной способ производства натрия – электролиз расплавов хлорида или гидроксида натрия
Методы, используемые для производства натрия, нельзя применить для получения калия вследствие его высокой реакционной способности. Получение - восстановлением КСl или КОН металлическим натрием или кальцием
Удобным методом получения рубидия и цезия является термическое восстановление их из хлоридов с помощью кальция в вакууме:
2CsCl + Са = CaCl2 + 2Cs
Очищают Na, К, Rb, Cs вакуумной перегонкой.
Свойства.
Li, Na, К, Rb, Cs – легкоплавкие металлы, Li, Na, К, Rb имеют серебристо-белую окраску, а Cs – золотисто-желтую, не такую яркую, как у золота, хотя и вполне заметную. Хранящиеся под слоем керосина щелочные металлы обычно покрыты пленкой из оксидов и пероксидов (литий – смесью нитрида и оксида).
Литий – самое легкое из твердых веществ, существующих при комнатной температуре.
На воздухе щелочные металлы легко окисляются (Rb и Cs самовозгораются), реакция ускоряется под действием влаги. В совершенно сухом кислороде при комнатной температуре натрий не окисляется и сохраняет блестящую поверхность.
Франций не имеет долгоживущих изотопов. Природный изотоп – радиоактивен, период полураспада 21 мин.
Щелочные металлы растворяются в жидком аммиаке.
Связь в молекулах большинства соединений щелочных металлов близка к ионной, причем отклонение эффективного заряда от единицы уменьшается при переходе от соединений лития к соединениям цезия. В расплавленном состоянии соединения щелочных металлов, как правило, ионизированы и проводят электрический ток. Комплексообразование для ионов щелочных металлов нехарактерно.
Соединения. Щелочные металлы реагируют с сухим водородом при нагревании, образуя гидриды ЭН. Об отрицательном заряде водорода в гидридах свидетельствует тот факт, что при электролизе LiH (в расплавленном состоянии или в растворе в жидком NH3) водород выделяется на аноде.
Гидриды щелочных металлов – сильные восстановители. С водой они энергично peaгируют с выделением водорода
При нагревании NaH в атмосфере СO2 образуется формиат натрия
NaH + CO2 = HCOONa
Реакционная способность гидридов ЭН значительно увеличивается при переходе от LiH к CsH.
Все щелочные металлы весьма энергично реагируют с кислородом. При избытке кислорода литий образует оксид Li2O, натрий – пероксид Na2O2, а К, Rb, Cs – надпероксиды ЭO2.
Оксиды Na2O, K2O, Rb2O, Cs2O могут быть получены при недостатке кислорода
Пероксиды и надпероксиды щелочных металлов – сильные окислители. Горючие вещества (алюминиевый порошок, древесные опилки и др.), смешанные с Na2O2, дают яркую вспышку при поджигании. Реакцию можно вызвать также введением в смесь небольшого количества воды или H2SO4.
Пероксиды при растворении в воде подвергаются почти полному гидролизу
Na2O2 + 2Н2O =2NaOH + H2O2
При взаимодействии надпероксидов с водой получаются Н2O2 и кислород
4КO2 + 2Н2O =4KOH + 2H2O2 + O2
LiOH плохо растворим в воде
Щелочи при плавлении разрушают стекло и фарфор:
2NaOH +SiO2= Na2SiO3 +H2O
Гидроксиды ЭОН (за исключением LiOH) термически устойчивы до температуры более 1000°С, LiOH разлагается при температуре красного каления на Li2O и Н2O.
Из щелочей наибольшее практическое значение имеет едкий натр. Его получают в основном электролизом раствора NaCl.
Все щелочные металлы реагируют с кислотами, при этом выделяется водород и образуются соли, например
2Э + 2НСl = 2ЭСl + Н2
Сильно экзотермичные реакции щелочных металлов с галогенами приводят к образованию галогенидов ЭГ.
С азотом щелочные металлы, за исключением Li, непосредственно не реагируют. Литий взаимодействует с азотом даже при комнатной температуре, образуя нитрид Li3N, который легко реагирует с водой
Li3N + 3Н2O =3LiOH + NH3
Нитриды других щелочных металлов могут быть получены из их паров и азота в электрическом разряде. Они малоустойчивы.
Из солей щелочных металлов большое практическое значение имеет карбонат натрия Na2CO3 .Ее получают из хлорида натрия по аммиачному способу, предложенному в 1863 г. Сольве.
NaС1 + NН3 + СO2 + Н2O = NаНСО3 + NН4С1
2NаНСО3 = Nа2СО3 + СО2 + Н2О
Особенности лития
Литий существенно отличается от остальных элементов подгруппы IA (проявляет диагональное сходство с Mg). Подобно соответствующим соединениям магния, малорастворимы в воде LiF (аналитическая реакция на катионы Li+), Li2CO3, Li3PO4. Как и магний, литий взаимодействует с азотом, давая нитрид Li3N, и сравнительно легко (в отличие от других щелочных металлов) образует с углеродом ацетиленид Li2C2, а с кремнием – силициды Li4Si и др.
Кислородсодержащие соединения лития (LiOH, LiNO3, Li2CO3) при нагревании разлагаются с образованием оксида Li2O
4LiNO3 = 2Li2O + 4NO2 + O2
Малый радиус иона Li обусловливает возможность координации лигандов вокруг этого иона, образование большого числа двойных солей , а также высокую растворимость ряда солей лития (в противоположность солям других щелочных металлов) во многих органических растворителях.
Мышьяк, сурьма, висмут
Природные источники и получение:
Встречаются в основном в виде сульфидов. Преимущественный способ получения:
Сульфид\s\up9(обжигОксид\s\up9(CЭлемент
As можно получить термическим разложением FeAsS(арсенопирит).
Химические свойства:
Степени окисления от -3 до +5. Чем ниже по группе, тем стабильней +3.
При взаимодействии с недостатком галогена образуется ЭГ3,с избытком – ЭГ5(известны только фториды и SbCl5). При спекании As, Sb и даже Bi с порошком активныхМе, образуются арсениды, антимониды и висмутиды.
Реакции простых веществ с серной к-той:
4As+6H2SO4(конц)=As4O6+6SO2+6H2O
2Sb+6H2SO4(конц)=Sb2(SO4)3+3SO2+6H2O
2Bi+6H2SO4(конц)=Bi2(SO4)3+3SO2+6H2O
Biпассивируется в концентрированной азотной кислоте. Взаимодействие простых веществ с азотной кислотой:
As+5HNO3(конц)=H3AsO4+5NO2 + H2O
2Sb+10HNO3(конц)=Sb2O5+10NO2+5H2O
As+HNO3(разб)+H2O=H3AsO3+NO
4Sb+4HNO3(разб)=Sb4O6+4NO+2H2O
Bi+4HNO3(разб)=Bi(NO3)3+NO+2H2O
