
- •Будова твердих тіл.
- •Основні види поляризації
- •Пробій газів
- •Магнітні матеріали. Фізична природа магнетизму
- •Класифікація магнітних матеріалів і області їх застосування.
- •Магнітом’які матеріали, їх основні характеристики.
- •Низькочастотні магнітом’які матеріали
- •Електротехнічна сталь, пермалої
- •Високочастотні магнітні матеріали: магнітодіелектрики, магнітом’які ферити.
- •8.Напівпровідникові матеріали. Класифікація напівпровідникових матеріалів
- •Зонна структура
- •Власні і домішкові напівпровідники.
- •Домішкові
- •Донори і Акцептори
- •Основні та неосновні носії заряду
- •Процеси генерації і рекомбінації носіїв
Будова твердих тіл.
Тверді тіла - метали і діелектрики - це напівпровідники, що лежать в основі сучасної електроніки, магніти, понад провідники, конструкційні матеріали.
Тверде тіло складається з мільярда частинок, які взаємодіють між собою. Це обумовлює появу певного порядку в системі і особливих властивостях всієї кількості мікрочасток.
Структура твердих тіл багатообразна. Проте всі тверді тіла можна розділити на два великі класи: кристали і аморфні тіла.
Геометрична класифікація кристалів недостатня для розпізнавання струк-
тур, що здаються тотожними. Вони можуть виявляти відмінність по подвійно-
му променезаломленню, по п'єзо- і піроелектричним властивостям, утворенню
адсорбційних центрів, роботі виходу електронів і тому подібне. Це обумовлено
різними видами симетрії, яких налічують 32 класи, об'єднуючих до 230 можли-
вих просторових груп.
Причина утворення яким-небудь елементом або з'єднанням даних просторо-
вих ґраток в основному залежить від розмірів атома і електронної конфігурації
його зовнішніх оболонок.
Основні типи кристалічних ґраток металів приведені на рис.1.

Рисунок 1. схеми кристалічних ґраток металів: а - об’ємно – центровані
кубічні ґратки; б - гранецентровані кубічні ґратки; в – гексагональні ґратки.
Модель ковалентного, іонного, металевого та молекулярного зв’язку.
Залежно від будови зовнішніх електронних оболонок атомів можуть утворюватися різні види зв'язку.
Ковалентним називається зв'язок атомів один з одним, що досягається за рахунок електронів, які стають, спільними, як це схематично показано для двоатомної молекули на рис. 1.1.
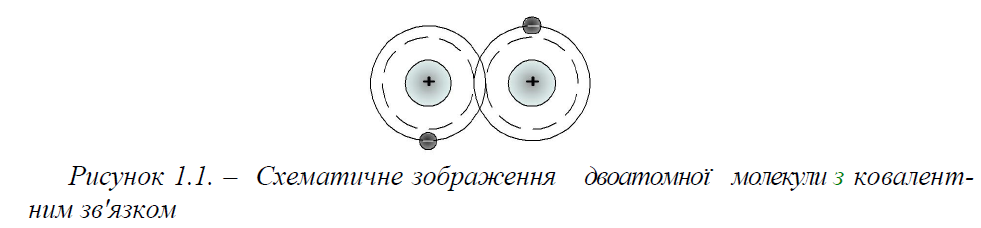
Молекули, в яких центри позитивних і негативних зарядів співпадають, є нейтральними. Якщо ж в окремих молекулах центри протилежних по знаку зарядів не співпадають і знаходяться на деякій відстані один від одного, то такі молекули називаються полярними або диполярними. Полярна молекула характеризується величиною дипольного моменту, який визначається як добуток заряду на відстань між центрами позитивних і негативних зарядів.
Ковалентний зв'язок спостерігається в молекулах, утворених атомами металоїдів (наприклад в молекулі хлору (Сl), також в трьох агрегатних станах, між атомами, що утворюють решітку кристалів (наприклад: алмаз, германій, кремній), Ковалентним зв’язком утримуються не тільки однорідні (–Сl–Cl–), але й різні атоми (наприклад:
– С – Н – , – Si – C –) і інші.
Іонний зв'язок (ІС) визначається силами тяжіння між позитивними і негативними іонами. Іонний зв'язок може утворюватися, як між співвимірними іонами, так і з різнорозмірними іонами речовини (рис. 1.2), створюючи щільні або нещільні упаковки.

Тверді тіла іонної структури характеризуються підвищеною механічною
міцністю і досить високою температурою плавлення (наприклад: солі лужних
металів, галоїди тощо).
Металевий зв'язок (МС) приводить до утворення твердих кристалічних
тіл. Метали – це впорядковані системи позитивно заряджених атомів (іонів),
що знаходяться в середовищі вільних електронів. Атоми знаходяться в вузлах
і складають угрупування, що називають кристалічні решітки або ґратки.
Сили міжатомного тяжіння між атомами і електронами обумовлюють моно-
літність і механічну міцність металів. Рухливі електрони, які можуть перехо-
дити з орбіт, забезпечують високу електропровідність і теплопровідність, а
також блиск металу.
Молекулярний зв'язок (МС) – зв'язок між молекулами з ковалентними
внутрішньо молекулярними зв'язками. Міжмолекулярне тяжіння в такому ра-
зі обумовлене узгодженим рухом валентних електронів в сусідніх молекулах.
Цей тим хімічного зв’язку називають зв'язком Ван-дер-Ваальса. Молекуляр-
ний зв'язок характеризується взаємодією нейтральних молекул (або атомів)
на основі слабих електростатичних сил. Молекулярний зв'язок характерний
для атомів з електронними оболонками, що відносно легко деформуються, і
для тих, що об'єднали в молекули атоми, здібні до деформації зовнішніх з'єд-
наних оболонок (наприклад: більшість полімерів, органічних речовин, пара-
фін).
Кристалічна структура твердих тіл.
Кристалічна структура — структура матеріалів, яка характеризується неповторним (унікальним) розташуванням атомів в кристалі, основними параметрами якої є тип кристалічної гратки (сингонія), просторова група, число формульних одиниць, лінійні розміри та кути елементарної ґратки, координати атомів (заповненість правильних систем точок), координаційні числа та координаційні многогранники для усіх атомів.
Основні типи кристалічних ґраток металів приведені на рис.1.
Рисунок 1. схеми кристалічних ґраток металів: а - об’ємно – центровані
кубічні ґратки; б - гранецентровані кубічні ґратки; в – гексагональні ґратки.
4. Індекси Міллера.
Індекси Міллера - кристалографічні індекси, що характеризують розташування атомних площин у кристалі.
Можливі три варіанти відносного розташування осей та площини:
площину перетинає всі три осі
площину перетинає дві осі, а третьою паралельна
площину перетинає одну вісь і паралельна двом іншим
Напрямок задається трьома числами [lmn] у базисі ортогональних векторів, які задають обернену кристалічну ґратку, взятими в квадратні дужки.
(lmn) позначає площину, перпендикулярну напрямку [lmn].
{lmn} — позначає сімейство площин, еквівалентних (lmn) з врахуванням операцій симетрії.
<lmn> — позначає сімейство напрямів [lmn] з врахуванням операцій симетрії.
Від'ємні значення
заведено позначати рискою над числом,
наприклад [11![]() ].
].
Усі індекси приводяться до взаємно простих чисел.
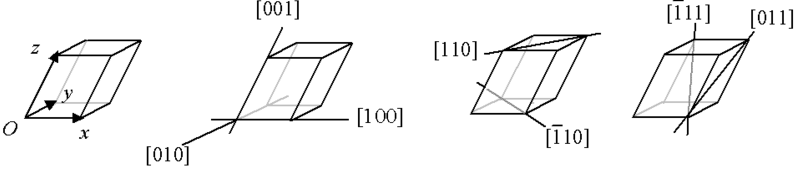
ПРИКЛАДИ ІНДЕКСІВ ДЛЯ РІЗНИХ НАПРЯМКІВ
Зонна модель будови твердих тіл.
У зонній теорії розглядаються ідеальні кристали із трансляційною симетрією. Вона спирається на теорему Блоха, яка визначає загальний вид одно електронних хвильових функцій, визначаючи для них квантове число, яке називається квазі-імпульсом. Квазі-імпульси призводяться до так званої першої зони Брілюена. Рівні одноелектронних станів розбиваються на неперервні смуги, які називаються дозволеними зонами.
Між дозволеними зонами існують заборонені зони. Усі одноелектронні стани характеризуються трьома квантовими числами:квазі-імпульсом, номером зони й спіном.
Найважливішими для визначення фізичних властивостей кристалу зонами є валентна зона і зона провідності.
Основний стан усього тіла будується, послідовно заповнюючи електронами всі одноелектронні стани, починаючи з найнижчого. Найвищий заповнений стан визначає положення рівня Фермі. Усі одноелектронні рівні з енергією нижчою за рівень Фермі в основному стані заповнені, а всі одноелектронні рівні з енергією вищою за рівень Фермі незаповнені.
У випадку напівпровідників і діелектриків рівень Фермі співпадає з верхом валентної зони, тобто валентна зона повністю заповнена. Наступна за нею зона називається зоною провідності, оскільки провідності кристалів визначається електронами, які потрапляють у зону провідності при збудженні кристалу.[5]
У випадку металів, валентна зона заповнена наполовину, а тому є водночас і зоною провідності.
Сучасна квантова теорія твердого тіла ґрунтується на ряді спрощень. Такою теорією є теорія твердого тіла. Назва пов'язана з характерним угрупованням енергетичних рівнів електронів в кристалах у зони рівнів.
Зону, що утворилась від валентних рівнів атомів, що утворюють кристал, називають валентною зоною.
Зони, що утворились від внутрішніх рівнів, завжди повністю заповнені електронами.
Частково заповненим або незаповненим може бути зовнішній валентний рівень (зона провідності).
Найбільш слабко зв'язано 3S-Електрони. При утворенні твердого тіла з окремих атомів відбувається перекриття хвильових функцій цих електронів.
Просторова довжина електронних хвильових функцій залежить від квантових чисел. Для більших квантових чисел електронні хвильові функції простираються на більші відстані від ядра, для цих рівнів взаємний вплив атомів буде проявлятися при більших відстанях між атомами. Що добре видно на мал.7, на прикладі рівнів атомів натрію.

На рівнях 1S, 2S, 2P практично не позначається вплив сусідніх атомів, тоді як для рівнів 3S, 3P і більш високих рівнів цей вплив істотний і ці рівні перетворюються в енергетичні зони. Для 3S – електронів є енергетичний мінімум, що забезпечує стійку твердотільну конфігурацію атомів натрію при середній міжатомної відстані R~ 3Å. В атомі натрію на енергії 3S – електрона позначається вплив сусідніх атомів, означає також помітне перекриття хвильових функцій цих електронів. Тому вже не можна говорити про те, що конкретний 3S – електрон пов'язаний з якимось конкретним атомом. Коли присутність інших атомів змінює потенціальну яму окремого атома (мал.5, мал.6), що результуючий кулонівський потенціал уже не буде втримувати 3S – електрони близько конкретних атомів, так що вони можуть перебувати у твердому тілі де завгодно в результаті перекриття хвильових функцій 3S – електронів. Але 3S – електрони не можуть вільно залишати тверде тіло, тому що їхні хвильові функції не «виходять» за межі речовини. Енергія зв'язку електронів у твердому тілі дорівнює роботі виходу φ.
Тверде тіло із чотирьох атомів буде мати всього чотири рівні, розподілені по деякому енергетичному інтервалу.
Діелектрики
Діелектриками (або ізоляторами) називаються речовини, нездатні проводити електричний струм.
У природі ідеальних
ізоляторів не існує, вони проводять
струм в
![]() -
-
![]() разів гірше, ніж провідники.
разів гірше, ніж провідники.
Питомий опір
діелектриків становить
![]() .
У діелектриках немає вільних електричних
зарядів (електронів), як в металах або
інших провідниках.
.
У діелектриках немає вільних електричних
зарядів (електронів), як в металах або
інших провідниках.
Кожна молекула (або атом) діелектрика має позитивно заряджені ядра і негативно заряджені електрони, які рухаються навколо ядер. Позитивні заряди всіх ядер дорівнюють абсолютній величині заряду всіх електронів, а тому молекула речовини загалом електрично нейтральна.
Діелектрики поділяються на три типи.
І. Неполярні діелектрики – це діелектрики, які складаються з молекул, центри мас позитивних і негативних зарядів яких збігаються за відсутності електричного поля (рис. 119).
Прикладом неполярних
діелектриків є гази
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
Молекули таких діелектриків називаються
неполярними. Дипольний момент
таких молекул за відсутності
зовнішнього електричного поля
дорівнює нулю.
.
Молекули таких діелектриків називаються
неполярними. Дипольний момент
таких молекул за відсутності
зовнішнього електричного поля
дорівнює нулю.
I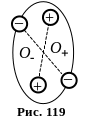 І. Полярні
діелектрики – це діелектрики,
в яких центри мас позитивних і негативних
зарядів не збігаються, тобто мають
асиметричну будову (рис. 120).
І. Полярні
діелектрики – це діелектрики,
в яких центри мас позитивних і негативних
зарядів не збігаються, тобто мають
асиметричну будову (рис. 120).
Д о
полярних діелектриків належать гази
о
полярних діелектриків належать гази
![]() ,
,
![]() ,
,
![]() та ін., рідини – вода
та ін., рідини – вода
![]() ,
соляна кислота
,
соляна кислота
![]() ,
бензол
,
бензол
![]() тощо.
тощо.
Молекули таких
діелектриків називають полярними.
Ці молекули за відсутності зовнішнього
поля мають дипольні моменти
![]() .
Їх називають жорсткими диполями.
.
Їх називають жорсткими диполями.
ІІІ. Іонні діелектрики – це речовини, молекули яких мають іонну будову.
Прикладом таких
діелектриків є
![]() ,
,
![]() та інші.
та інші.
І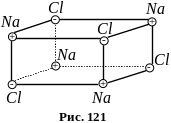 онні
кристали є просторовими ґратками з
правильним чергуванням іонів різних
знаків (рис. 121). У цих
кристалах не можна виділити окремі
молекули. Іонні кристали необхідно
розглядати як систему вміщених одна в
одну іонних підґраток. У цих діелектриках
кожна пара сусідніх різноіменних іонів
подібна до диполя.
онні
кристали є просторовими ґратками з
правильним чергуванням іонів різних
знаків (рис. 121). У цих
кристалах не можна виділити окремі
молекули. Іонні кристали необхідно
розглядати як систему вміщених одна в
одну іонних підґраток. У цих діелектриках
кожна пара сусідніх різноіменних іонів
подібна до диполя.
7. Електричні властивості діелектриків.
Основні електричні характеристики:
Питомий електричний опір,
Діелектрична проникність,
Тангенс кута діелектричних втрат,
Напруженість електричного поля за якої відбувається пробій.
Пито́мий о́пір — кількісна характеристика речовини, якою визначається здатність створювати опір електричному струму.
Статична
діелектрична проникність встановлює
зв'язок між вектором
електричної індукції ![]() й напруженістю
електричного поля
й напруженістю
електричного поля ![]() .
Загалом напрямки цих векторів не
збігаються, тож діелектрична проникність
є тензорною величиною.
.
Загалом напрямки цих векторів не
збігаються, тож діелектрична проникність
є тензорною величиною.
![]() .
.
Відносна діелектрична проникність εr може бути визначена шляхом порівняння електричної ємності тестового електричного конденсатора з певним діелектриком (Cx) і ємності того ж конденсатора у вакуумі (Co):
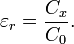
Залежну
від частоти діелектричну проникність
часто називають діелектричною
функцією.
Вона зв'язана із залежною від
частоти поляризовністю ![]() співвідношенням
співвідношенням
![]()
Якщо дійсна складова діелектричної проникності аналогічна діелектричній сталій, описуючи зумовлене поляризацією зменшення електричного поля в речовині, то уявна частина описує струми, які виникають в речовині в змінному електричному полі. Діелектрики, які не проводять постійного струму, можуть проводити змінні струми, зв'язані із періодичним зміщенням зв'язаних електронів відносно ядер.
В оптичному діапазоні дійсна складова діелектричної проникності зв'язана з показником заломлення, а уявна частина - іззатуханням світла. Уявна частина діелектричної функції завжди додатня для середовища, яке поглинає світло
![]() .
.
Та́нгенс кута́ діелектри́чних втра́т — характеристика ізоляційних властивостей діелектриків та конденсаторів, яка визначається як відношення активної потужності до реактивної.
Напру́женість електри́чного по́ля — це векторна фізична величина, яка дорівнює силі, яка діє у даній точці простору у даний момент часу на пробний одиничний електричний заряд у електричному полі.
![]()
де ![]() — сила,
— сила, ![]() — електричний
заряд,
—
напруженість електричного поля.
— електричний
заряд,
—
напруженість електричного поля.
В системі СІ вимірюється у В/м, на практиці здебільшого у В/см.
Пробі́й — явище втрати діелектриком електроізоляційних властивостей з утворенням каналу електропровідності при розміщенні його в електричному полі. Кожний діелектрик може бути використаний тільки при напруженостях електричного поля, що не перевищують певного граничного значення. Якщо напруженість поля перевищить деяке критичне значення, відбудеться пробій діелектрика або порушення його електричної міцності. При цьому наскрізний струм, що проходить через діелектрик, різко зростає, а опір діелектрика падає, що приводить до втрати його електроізоляційних властивостей. При пробої газоподібного або рідкого діелектрика в результаті рухливостімолекул після зняття напруги «пробита» ділянка відновлює свої початкові властивості.
8. Поляризація діалектриків
Поляризацією називається такий стан діелектрика, коли сумарний еле-
ктричний момент відмінний від нуля.
Поява поляризації є наслідком дії різних чинників: електричного поля,
температури, механічної напруги і ін. У більшості діелектриків поляризація
виникає під дією електричного поля, тому в основному ми розглядатимемо
цей випадок.
При розміщенні діелектрика в електричному полі диполі в полярних діе-
лектриках повертаються по полю; при відсутності поля диполі дезорієнту-
ються внаслідок теплового руху.
У неполярних діелектриках зовнішнє електричне поле приводить до ліній-
ного зсуву зарядів усередині електрично нейтральних молекул, що також
приводить до появи електричних диполів. Таким чином, усередині діелект-
рика виникає власне поле, направлене протилежно зовнішньому полю. У ре-
зультаті напруженість зовнішнього поля в діелектрику слабшає в певну кіль-
кість разів.
Особливу групу складають діелектрики в яких із зміною напруженості
поля зміщення відбувається нелінійно, виявляючи насичення зарядів при де-
якому значенню напруженості поля. Такі діелектрики називають сегнетоеле-
ктрики.
9. Види поляризації.
