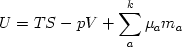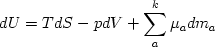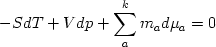- •Электронная структура и размеры атомов в кристаллах: ионные, атомные и ковалентные радиусы. Типы химической связи и координации атомов.
- •Принципы теории плотнейших упаковок и полиэдрическое описание кристаллических структур минералов.
- •Гомо- и гетеродесмические структуры кристаллов. Структурные типы минералов.
- •Полиморфизм и политипия.
- •5. Морфология и внутреннее строение кристаллов и их зависимость от условий роста.
- •6. Искаженные формы кристаллов. Закономерные сростки кристаллов: двойники, топо-, син- и эпитаксические сростки.
- •7. Морфология кристаллических агрегатов минералов. Сферолиты.
- •8. Химический состав минералов. Изоморфизм, твердые растворы, явление упорядочения и распад твердых растворов.
- •9. Физические свойства минералов, их природа и зависимость от химического состава и структуры. Оптические свойства.
- •10) Инструментальные методы исследования минералов, руд и горных пород.
- •11. Принципы систематики и общая характеристика основных классов минералов.
- •12. Генезис минералов. Минеральные ассоциации важнейших типов природного минералообразования.
- •Ассоциации минералов в магматических горных породах
- •Ассоциации минералов в пегматитах
- •3. Ассоциации минералов в метасоматических породах и связанных с ними гидротермальных жилах
- •4.Ассоциации минералов связанные с поздней вулканической деятельностью
- •5.Метаморфические ассоциации минералов
- •6.Ассоциации минералов в зоне выветривания
- •7.Ассоциации минералов в осадочных горных породах
- •13. Типоморфизм минералов, его генетическое, поисковое и технологическое значение.
- •14. Магма, её состав и свойства. Роль летучих в магмообразовании. Причины разнообразия магматических горных пород.
- •15. Принципы классификации магматических горных пород, петрохимическая систематика изверженных пород.
- •21. Физико-химические основы минералогии, петрологии и геохимии. Правила фаз и диаграммы состояния.
- •22. Космическая распространенность элементов. Нуклеосинтез.
- •23. Изотопная геохронология. Области применения и ограничения.
- •24. Оболочки Земли, распространенность элементов в земной коре, гипотезы о химическом и фазовом составе мантии и ядра.
- •26. Геохимия гидросферы.
- •27. Биосфера и геохимическая функция живого вещества.
- •28. Геохимический фон и геохимические аномалии.
- •29. Основы поисковой геохимии.
- •30. Геохимические, минералогические, петрографические и литологические поисковые и оценочные критерии.
21. Физико-химические основы минералогии, петрологии и геохимии. Правила фаз и диаграммы состояния.
В настоящее время в пределах геохимии как общей науки о распространении, распределении, сочетании и миграции элементов на Земле, в пределах минералогии, петрологии и учения о минеральных месторождениях как наук о составе, строении, свойствах и условиях образования соответственно минералов, пород и месторождений выделяется область знаний, охватывающая физико-химические закономерности природных процессов. Она известна как физическая химия процессов минералообразования, как физико-химическая петрология. Предметом изучения этой науки являются физико-химические процессы формирования минералов, горных пород и руд, физико-химические процессы формирования геосфер Земли. Обозначить ее целесообразно как физическую геохимию. Тогда можно дать общее определение: "Физическая геохимия - наука о физико-химических процессах формирования минералов, горных пород и руд, наука о физико-химических процессах формирования геосфер Земли. Рассматривая соотношения физической геохимии с другими науками, можно заметить следующее. Физическая геохимия в виде отдельных, частных разделов входит в другие геологические науки: в минералогию как физико-химическая минералогия, в петрологию - как физико-химическая петрология и т. д. Но в то же время это, несомненно, самостоятельная наука, поскольку она характеризуется единством методов: методы физико-химической минералогии, методы физико-химической петрологии, физико-химические методы познания процессов оруденения одинаковы, это суть методы физической геохимии. Задачи физической геохимии определяются изучением таких процессов в земной коре и мантии, которые имеют физико-химическую сущность, т. е. характеризуются совместным и взаимосвязанным проявлением физических и химических процессов.
Физическая геохимия базируется на общем знании о строении, физических и химических свойствах элементов и их соединений. Вместе с тем, физическая геохимия наряду с обычными, присущими другим геологическим наукам методами изучения природных объектов и их соотношений для своих целей познания физико-химической сущности геологических процессов использует свои, специфические, методы исследования. Можно указать на четыре главных метода: физико-химического анализа парагенезисов; экспериментального моделирования; физико-химических расчетов; теоретического физико-химического моделирования. Раскроем кратко сущность этих методов.
Правила фаз
Рассмотрим теперь в самом общем виде соотношение между числом интенсивных и экстенсивных параметров равновесных систем. Общее число независимых параметров равновесной системы, как было показано, равно:
ƒin + ƒex = k + 2 |
(2.35) |
Определим число экстенсивных параметров. Обратимся сначала к равновесной гомогенной изохоро-изоэнтропической системе, состояние которой также определяется k+2 независимыми параметрами.
Уравнения состояния системы:
|
(2.26) |
и
|
(2.12) |
Дифференцируя первое уравнение по всем параметрам и сравнивая с ним (вычитая) второе уравнение, получим следующее выражение, известное как уравнение Гиббса-Дюгема:
|
(2.36) |
Нетрудно убедиться,
что такое же выражение будет получено
при рассмотрении любой другой
термодинамической системы; например,
для изотермо-изобарической системы,
где
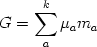 ,
дифференцируя это выражение по обоим
параметрам
,
дифференцируя это выражение по обоим
параметрам
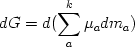 и, вычитая это выражение из
и, вычитая это выражение из
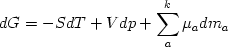 ,
получим уравнение (2.36):
,
получим уравнение (2.36):
|
(2.36) |
Уравнение Гиббса-Дюгема содержит дополнительную характеристику равновесных термодинамических систем. Оно показывает существование зависимости между интенсивными параметрами системы. Следовательно, из k+2 параметров гомогенной системы по крайней мере один, вследствие уравнения связи (2.36), должен быть экстенсивным (например, масса или объем фазы). Физическое содержание этого заключения очевидно: не может, конечно, существовать систем или фаз, заданных только одними интенсивными параметрами - такие системы нематериальны.
Гетерогенная система, состоящая из r фаз, должна содержать, по крайней мере r экстенсивных параметров, так как каждая фаза должна быть задана в силу уравнения (2.36) одним экстенсивным параметром:
r = ƒex. |
(2.37) |
Тогда, сопоставляя выражение (2.37) с уравнением (2.35), видим, что ƒin = k + 2 - ƒex = k + 2 - r и, обозначая ƒin = n, получим выражение
n = k + 2 - r. |
(2.38) |
Это уравнение представляет одну из фундаментальных зависимостей термодинамики - правило фаз Гиббса. Правило фаз Гиббса. устанавливает соотношение между числом независимых интенсивных параметров, или числом степеней свобод (n), числом фаз и числом компонентов в системе. Оно показывает каково максимальное число независимых интенсивных параметров, совместимое с данным фазовым составом данной k-компонентной системы. Правило фаз имеет широкое приложение в термодинамике, особенно в физико-химическом анализе.
Формула правила фаз может быть выведена различными способами. Покажем еще один - наиболее часто встречающийся. Поскольку максимальное число интенсивных параметров, характеризующих одну фазу, равно k+1, то в системе из r фаз возможно (k+1)r интенсивных параметров. Однако эти интенсивные параметры в равновесной системе связаны как мы видели (k+2)(r-1) уравнениями равенства параметров по фазам (уравнения 2.24). Тогда максимальное число интенсивных параметров, или число степеней свобод, равно
n = (k+1)r - (k+2)(r-1) = k + 2 - r |
Сопоставляя уравнения (2.35), (2.37) и (2.38), можно определить общие пределы изменения числа экстенсивных и интенсивных параметров в равновесной системе:
k + 2 ≥ ƒex = r, 0 ≤ ƒin ≤ k + 2 - r. |
(2.39) |
Соотношения (2.39) показывают что число экстенсивных параметров не может быть меньше числа фаз и максимальное число интенсивных параметров должно быть совместимо с этим. Другим крайним случаем является случай, когда система не имеет независимых интенсивных параметров (ƒin =0), а полностью задана k+2 экстенсивными параметрами. В физико-химическом анализе число независимых интенсивных параметров, характеризующее данное состояние системы, принято называть вариантностью системы, обозначая соответственно нонвариантное (n= ƒin =0), моновариантное (n= ƒin =1), дивариантное (n= ƒin =2) и т. д. состояния систем.
Правило фаз в системах с вполне подвижными компонентами
Рассмотрим теперь правило фаз применительно к системам с вполне подвижными компонентами. Общее число независимых параметров системы ƒin + ƒex = k + 2 для систем с вполне подвижными компонентами может быть очевидным образом раскрыто как
ƒin + ƒex = ki + km + 2 |
(2.51) |
где ki, km - соответственно число инертных и вполне подвижных компонентов. Полагая, как и выше, ƒex = r и обозначая n = ƒin, получим
n = ki + km + 2 - r |
(2.52) |
Введем представление о внутренних степенях свободы. Под внутренними степенями свободы будем понимать те независимые интенсивные параметры, которые может иметь система при произвольных, но определенных значениях интенсивных факторов состояния. Разъясним это определение.
Термин <произвольные, но определенные> (далее в зависимости от контекста сокращенно <произвольные> или <определенные>) вместо обычного <постоянные> кажется предпочтительнее, поскольку точнее отражает существо состояния системы: он означает, что интенсивные параметры произвольны, т. е. независимы от процессов, происходящих внутри системы, но в то же время они определенны в том смысле, что их изменения должны быть совместимы с данным фазовым составом системы, т. е. не должны вызывать исчезновения или появления новых фаз системы. В зависимости от особенностей фазового состава системы, точности его определения, от целей и задач исследования диапазон возможного изменения произвольных, но определенных интенсивных факторов состояния будет различным. Чем точнее задан фазовый состав системы, тем уже интервал <определения> факторов состояния, но во всех случаях они представляют внешние параметры, независимые от внутреннего состояния системы. Например, для изотермо-изобарической системы с вполне подвижными компонентами произвольное, но определенное значение будут иметь km+2 интенсивных фактора равновесия: химические потенциалы вполне подвижных компонентов (числом km), температура и давление.
Число внутренних степеней свобод nw определяется следующим образом. Из уравнения (2.52), раскрывая число степеней свобод как сумму внешних интенсивных факторов состояния и внутренних степеней свобод n = ƒin + nw, получим
nw = n - ƒin = ki + km + 2 - r - ƒin |
(2.53) |
Уравнение (2.53) показывает, что nw зависит от интенсивных факторов состояния, число которых в системах с вполне подвижными компонентами изменяется в пределах km ≤ ƒin ≤ km+2. Нетрудно убедиться также, что максимальное число фаз в системах с вполне подвижными компонентами при произвольных ƒin образуется в нонвариантных состояниях, когда nw = 0 и равно соответственно
rmax = ki + km + 2 - ƒin |
(2.54) |
Общие уравнения (2.53) и (2.54) легко приводятся к формам правила фаз, соответствующим конкретным типам природных систем. Термодинамический анализ различных процессов показал, что в природных условиях осуществляются три главных типа систем с вполне подвижными компонентами: 1) изотермо-изобарические системы с вполне подвижными компонентами Gm = ƒ(T, p, ma,..., mi, μj,...,μk), которые характеризуют метаморфические и некоторые метасоматические процессы; 2) изохоро-изотермические системы с вполне подвижными компонентами Fm = ƒ(T, V, ma,..., mi, μj,...,μk), типичные для метасоматических образований, и 3) изобарно-изоэнтропические системы с вполне подвижными компонентами Hm = ƒ(S, p, ma,..., mi, μj,...,μk), которые осуществляются при эвтектической кристаллизации магматических расплавов. Для каждого типа систем можно написать соответствующую форму правила фаз (где индексы при n и r обозначают произвольные интенсивные факторы состояния):
nT, p, μ = ki + km + 2 - r -ƒin = ki - r, rT, p, μmax = ki |
(2.55) |
nT, μ = ki + km + 2 - r -ƒin = ki + 1 - r, rT, μmax = ki + 1 |
(2.56) |
np, μ = ki + km + 2 - r -ƒin = ki + 1 - r, rp, μmax = ki + 1 |
(2.57) |
Полученные соотношения приводят к следующим важнейшим выводам.
1. Число фаз в системах с вполне подвижными компонентами не зависит от числа вполне подвижных компонентов и определяется экстенсивными параметрами систем, в число которых входят массы инертных компонентов, а также (в соответствующих системах) объем и энтропия.
2. Химические потенциалы вполне подвижных компонентов, являясь интенсивными факторами состояния, играют такую же роль, как температура и давление, определяя разнообразие фазового (минерального) состава и фазовых равновесий (парагенезисов), и условия их существования в системах с вполне подвижными компонентами.
Рассмотренные положения имеют фундаментальное значение для физико-химического анализа природных систем. Они показывают принципиальную особенность природных систем, состоящую в том, что число минералов в природных системах всегда меньше числа слагающих их компонентов и, напротив, разнообразие минерального состава и парагенезисов значительно шире, поскольку оно зависит не только от температуры и давления, но и от величин химических потенциалов (или других интенсивных параметров) вполне подвижных компонентов.
В свете изложенного становятся ясными неудачи первоначального применения правила фаз к анализу парагенезисов: минералогическое правило фаз Гольдшмидта (r=k) не учитывало главной особенности природных систем - вполне подвижного поведения ряда компонентов, не влияющего на число фаз. Только открытие систем с вполне подвижными компонентами и, как следствие, новая форма правила фаз создали необходимую теоретическую основу физико-химического анализа парагенезисов. Соотношения (2.55) - (2.57), впервые выведенные Д. С. Коржинским, со временем получили наименование <правила фаз Коржинского>.
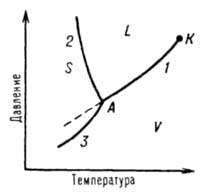
ДИАГРАММА СОСТОЯНИЯ (фазовая диаграмма), графич. изображение всех возможных состояний термодинамич. системы в пространстве осн. параметров состояния т-ры Т, давления р и состава х (обычно выражаемого молярными или массовыми долями компонентов). Для сложных систем, состоящих из многих фаз и компонентов, построение диаграммы состояния является единственным методом, позволяющим на практике установить, сколько фаз и какие конкретно фазы образуют систему при данных значениях параметров состояния. Каждое реально существующее состояние системы на диаграмме состояния изображается т. наз. фигуративной точкой; областям существования одной фазы отвечают участки пространства (на трехмерных диаграммах состояния) или плоскости (на двухмерных диаграммах состояния), условиям сосуществования фаз - соотв. пов-сти или линии; изменение фазового состояния системы рассматривается как движение фигуративной точки на диаграмме состояния. Анализ относит. расположения объемных участков, пов-стей, линий и точек, к-рые образуют диаграмму состояния, позволяет однозначно и наглядно определять условия фазового равновесия, появления в системе новых фаз и хим. соед., образования и распада жидких и твердых р-ров и т. п. Диаграммы состояния используют в материаловедении, металлургии, нефтепереработке, хим. технологии (в частности, при разработке методов разделения в-в), произ-вах электронной техники и микроэлектроники и т. п. С ее помощью определяют направленность процессов, связанных с фазовыми переходами, осуществляют выбор режимов термообработки, отыскивают оптимальные составы сплавов и т. п. Теоретич. основами построения и интерпретации диаграмм состояния равновесных систем являются: 1) условие фазового равновесия, согласно к-рому хим. потенциалы i каждого i-го компонента во всех фазах при равновесии равны; 2) условие химического равновесия, согласно к-рому сумма хим. потенциалов вступающих в р-цию в-в при равновесии равна аналогичной сумме для продуктов р-ции; 3) фаз правило Гиббса, согласно к-рому число компонентов К, число фаз Ф и вариантность системы v (т. е. число независимых параметров состояния, к-рые можно в определенных пределах изменять без изменения числа и природы фаз) связаны соотношением: v = К — Ф + 2. Цифра 2 означает, что учитываются только два интенсивных параметра состояния - т-ра и давление. Если учитываются и др. параметры, напр., напряженности электромагнитного или гравитационного полей, вариантность системы соотв. увеличивается. Различают нонвариантные (v = 0), моновариантные (v = 1), дивариантные (v = 2) и т. д. состояния (равновесия); 4) правило о соприкасающихся пространствах состояния, согласно к-рому если два разных пространства состояния (поля в случае плоской диаграммы) соприкасаются по линии, то они различаются между собой на одну фазу, если поля соприкасаются в точке, то состояния различаются на две фазы. Для построения диаграмм состояния расчетным путем необходимо знать зависимости хим. потенциалов всех компонентов системы от Т, р и состава фаз. Приближенные методы расчета с применением ЭВМ интенсивно развиваются, в частности, для многокомпонентных сплавов. Однако пока диаграммы состояния строят на основе эксперим. данных, получаемых гл. обр. термическим анализом, к-рый позволяет определять зависимости т-р плавления или кристаллизации от состава, а также изучением равновесий жидкость - пар и жидкость - жидкость. Широко используют рентгеновский фазовый анализ, данные о микроструктуре затвердевших расплавов, измерения физ. св-в фаз (см. Диаграмма состав-свойство). Изучение диаграмм состояния составляет осн. содержание физико-химического анализа. Однокомпонентные системы. Однокомпонентной системой является любое простое в-во или хим. соед., обладающее строго определенным составом в газообразном, жидком и твердом состояниях. Диаграммы состояния обычно строят на плоскости в координатах Т-р (рис. 1). Фазовые поля (области существования) пара V, жидкости L и твердой фазы S дивариантны, т.е. допускают одновременное изменение двух параметров состояния - Т и р.
Рис. 1 Диаграмма состояния однокомпонентной системы. S, L и V - соотв. области существования твердой, жидкой и паровой фаз; 1, 2 и 3 кривые кипения (испарения), плавления и возгонки (сублимации) соотв., К критич. точка; А тройная точка. Двухфазное равновесие между жидкостью и паром изображается кривой кипения (или испарения) 1, между жидкостью и кристаллами - кривой плавления 2, между кристаллами и паром - кривой возгонки (или сублимации) 3. Все двухфазные равновесия моновариантны, т. е. не нарушаются при произвольном изменении только одного из параметров, Т или р; при этом значение другого определяется из диаграммыа состояния. Кривая кипения 1 характеризует зависимость давления насыщенного пара в-ва от т-ры или зависимость т-ры кипения в-ва от внеш. давления. Со стороны повышенных T и р эта кривая заканчивается в критич. точке К, где исчезает различие в св-вах между жидкостью и ее паром (подробнее см. ст. Критическое состояние). Жидкость может находиться в переохлажденном состоянии (пунктирная линия на рис. 1). Аналогично кривая плавления характеризует зависимость т-ры плавления от внеш. давления, кривая возгонки - температурную зависимость давления насыщенного пара над твердым в-вом. На рис. 1 ход кривой плавления соответствует повышению т-ры плавления с ростом давления, однако возможно и понижение т-ры плавления с давлением (см. Клапейрона - Клаузиуса уравнение). Все три кривые моновариантных фазовых равновесий сходятся в тройной точке А, отвечающей параметрам состояния, при к-рых находятся в нонвариантном равновесии три фазы. Диаграмма состояния усложняется, если в-во в твердом состоянии может существовать в разл. кристаллич. модификациях. Каждой модификации отвечает свое фазовое поле. Линии моновариантных равновесий, разграничивающие эти поля, наз. кривыми превращений. Двойные системы. Состояние двойной системы определяется тремя независимыми параметрами - Т, р и содержанием х одного из компонентов, поэтому диаграмма состояния такой системы трехмерна. Обычно принимают постоянными Т или р и рассматривают соответствующие плоские сечения диаграммы состояния, называемые соотв. изотермич. (р — х)или изобарными (Т — х)диаграммами состояния. В конденсир. системах роль давления сравнительно невелика и в качестве параметров состояния обычно выбирают Т и состав (концентрацию одного из компонентов).
Д и а г р а м м ы
п л а в к о с т и. Такие диаграммы
состояния служат для установления
условий равновесия
между твердыми и жидкими фазами.
Рассмотрим их осн. типы. Простейший
вариант соответствует случаю, когда
компоненты А и В образуют одну жидкую
фазу (расплав
или р-р), при охлаждении к-рой только
выделяются (кристаллизуются)
индивидуальные в-ва (не образуются ни
твердые р-ры, ни хим. соед.).
|
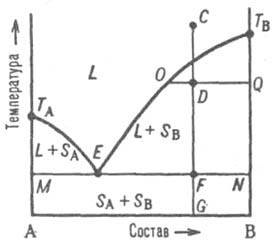
Рис. 2. Диаграмма плавкости двойной системы, компоненты к-рой А и В не образуют твердых р-ров. L - область существования жидкости (расплава), (L + SA) и (L + SB) области сосуществования жидкой фазы и твердых А и В соотв.; (SA + SB) область существования мех. смеси твердых А и В. ТАETВ и MEN - линии ликвидуса и солидуса соотв., E-эвтектич. точка. С, D, F, G, О и Q фигуративные точки (пояснения в тексте). На диаграмме состояния (рис. 2) линия, изображающая зависимость от состава т-ры начала выделения из жидкой фазы твердого компонента (начала равновесной кристаллизации), наз. линией ликвидуса. Она состоит из двух ветвей ТАЕ и ТВЕ, отграничивающих фазовое поле жидкости L от полей сосуществования жидкой фазы с твердыми А и В соотв. (поля L + SA и L + SB). Линия, изображающая зависимость от состава т-ры окончания равновесной кристаллизации при охлаждении (или начала плавления при нагр.), наз. линией солидуса. Ниже нее расположено фазовое поле SA + SB твердого состояния системы, отвечающее условиям сосуществования двух твердых фаз. В точке F пересечения прямой CG с линией солидуса начинается кристаллизация компонента А. Система становится трехфазной (жидкость и две твердые фазы А и В) и моновариантной (условно нонвариантной), т.е. при постоянном давлении совместная кристаллизация двух твердых фаз (т. наз. эвтектич. кристаллизация) протекает при постоянных т-ре и составе жидкой фазы, отвечающих координатам эвтектич. точки Е. После завершения эвтектич. кристаллизации система состоит из двух твердых фаз и является дивариантной (условно моновариантной). В обсуждаемом случае система после затвердевания состоит из относительно крупных кристаллов В и мелкодисперсной смеси совместно возникших при эвтектич. кристаллизации кристаллов А и В; такую смесь наз. эвтектикой. Если исходная жидкость имела эвтектич. состав, продукт ее затвердевания - мелкодисперсная эвтектика без примеси крупных кристаллов к.-л. из компонентов.
Второй тип
диаграммы характерен для случая
ограниченной р-римости компонентов
в твердом состоянии. Твердый р-р В в А
(обозначается -раствор)
образуется лишь до определенной
концентрации
В, твердый р-р А в В (-раствор)
- лишь до определенной концентрации
А. Для таких систем возможны два случая
трехфазного равновесия:
1) эвтектич. равновесие
жидкого расплава
состава Е, твердого р-ра ,
концентрация
к-рого соответствует точке М, и твердого
р-ра ,
концентрация
к-рого соответствует точке N,
при эвтектич. т-ре, к-рая, как правило,
ниже т-р плавления
TA
и ТB
обоих компонентов (рис. 3).
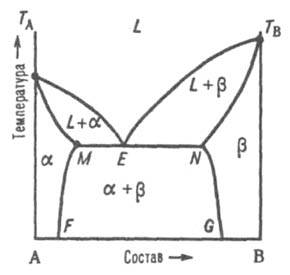
Рис. 3. Диаграмма плавкости двойной системы эвтектич. типа с ограниченными твердыми р-рами. L, и - области существования жидкой фазы (расплав) и твердых р-ров В в А и А в В соотв.; (L + ) и (L + ) - области сосуществования жидкой фазы и твердых р-ров и соотв.; ( + ) - область сосуществования двух твердых р-ров. ТАЕТВ и MEN - линии ликвидуса и солидуса соотв., E - эвтектич. точка.
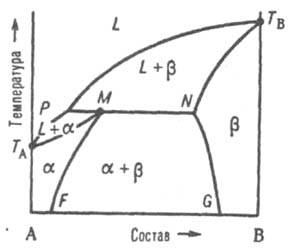
Рис. 4. Диаграмма плавкости двойной системы перитектич. типа. Р - перитектич. точка, остальные обозначения те же, что и на рис. 3. Эти ветви пересекаются в т. наз. перитектич. точке Р - фигуративной точке жидкой фазы, к-рая может равновесно сосуществовать одновременно с двумя твердыми р-рами и , составы к-рых определяются точками М и N. Линия солидуса состоит из трех ветвей: ТAМ, MN и NTB. При охлаждении двухфазной системы (L + ) до перитектич. т-ры Тр в системе появляется третья фаза - р-р . При протекании перитектич. превращения (фазовой р-ции) жидкость (расплав) + твердый р-р D твердый р-р система моновариантна, или условно нонвариантна, т. е. при данном давлении равновесие возможно лишь при постоянных т-ре и составах каждой из фаз. Если после окончания перитектич. р-ции остается избыток жидкой фазы, система переходит в двухфазное поле (L + ). При дальнейшем охлаждении происходит кристаллизация твердого -раствора. Если после окончания перитектич. р-ции полностью исчезает жидкая фаза, система переходит в двухфазное поле + ; по мере снижения т-ры составы - и -растворов изменяются в соответствии с ходом линий MF и NG. Третий тип диаграммы описывает состояния двойной системы, компоненты к-рой А и В образуют устойчивое хим. соед., к-рое не разлагается вплоть до т-ры плавления и переходит в жидкую фазу того же состава, т. е. плавится конгруэнтно.
|
Рис. 5. Диаграмма плавкости двойной системы, компоненты к-рой А и В образуют конгруэнтно плавящееся хим. соед. АmВn. D - сингулярный максимум, Е1 и Е2 - эвтектич. точки; остальные обозначения те же, что и на рис. 3 и 4. В точке плавления, соответствующей стехиометрич. составу АmВn, на линии ликвидуса имеется сингулярный максимум (рис. 5); это значит, что линия D - АmВn разделяет систему на две подсистемы. На диаграмме максимуму отвечает излом (показан пунктиром на рис. 5). В каждой из подсистем взаимод. между компонентами, соотв. А и АmВn, В и АmВn, может быть представлено диаграммами эвтектич. или перитектич. (или любого другого) типа. Общий характер фазового равновесия в системе определяется характером взаимод. соед. АmВn с компонентами А и В. Рис. 6. Диаграмма плавкости двойной системы, компоненты к-рой А и В образуют инконгруэнтно плавящееся хим. соед. АmВn, обозначения те же. что и на рис. 4 и 5.
Четвертый тип диаграмм. Компоненты А и В образуют хим. соед., разлагающееся ниже т-ры плавления (т. наз. инконгруэнтное плавление). Напр., при охлаждении жидкости (расплава) до нек-рой т-ры Тр (рис. 6) кристаллизуется только компонент В; при Тр происходит перитектич. р-ция с образованием хим. соед. АmВn в твердом состоянии, т. е. р-ция твердая фаза SВ + расплав перитектич. состава D твердая фаза SА(m)В(n). Если при этом в твердой фазе компонент В имеется в избытке, в результате перитектич. р-ции исчезает жидкая фаза и при дальнейшем охлаждении ниже Тр остается смесь двух твердых фаз SB и SА(m)B(n). Если же в твердой фазе компонента В недостает, в результате р-ции исчезают кристаллы В и жидкость при дальнейшем охлаждении выделяет кристаллы соед. АmВn, изменяя свой состав по линии ликвидуса РЕ. При т-ре ТЕ происходит эвтектич. кристаллизация AmBn и А. Возможны и др. варианты диаграммы. Описанные типы диаграмм плавкости могут усложняться из-за полиморфизма как компонентов А и В, так и соед. АmВn.
Тройные системы.
Состояния тройных систем однозначно
определяются четырьмя независимыми
параметрами: Т, р и молярными (массовыми)
долями двух компонентов (доля третьего
компонента определяется из условия
равенства единице суммы долей всех
компонентов). Поэтому при построении
диаграмм состояния тройных систем
один из независимых параметров (р или
Т) или два (р и T)
фиксируют и рассматривают пространственные
изобарные или изотермич. диаграммы
или плоские изобарно-изотермич.
диаграммы, соответствующие одному из
сечений пространственной диаграммы
состояния. Каждому составу тройной
смеси отвечает определенная точка на
плоскости составов. Область возможных
составов тройных систем наз.
композиционным треугольником или
треугольником составов. В системе
прямоугольных координат он представляет
собой прямоугольный равнобедренный
треугольник, вершины к-рого отвечают
компонентам А, В и С, а стороны - двойным
смесям АВ, ВС и СА. Более распространено
использование равностороннего
композиц. треугольника. Для построения
пространств. изобарной или изотермич.
диаграммы состояния по координатной
оси, перпендикулярной композиц.
треугольнику, откладывают соотв. T
или р. При этом фигуративные точки
системы в целом и ее трехкомпонентных
фаз оказываются расположенными внутри
трехгранной призмы, грани к-рой
изображают двойные системы, ребра
-однокомпонентные системы. На рис. 9,
а изображена простейшая диаграмма
плавкости тройной системы, компоненты
к-рой А, В и С не образуют друг с другом
твердых р-ров и (или) хим. соед. и не
расслаиваются в жидком состоянии
(неограниченно взаимно растворимы).
Пов-сть т-р начала кристаллизации
тройных расплавов
(пов-сть ликвидуса) состоит из трех
полей -ТAЕ1ЕЕ3,
TBE1EE2
и ТCE2EE3,
отвечающих кристаллизации
А, В и С соотв. и разделенных тремя
пограничными кривыми E1E,
E2E
и E3E.
Ортогональные проекции пограничных
линий на композиц. треугольник образуют
т. наз. плоскую диаграмму
плавкости тройной системы (рис. 9,
б) с тремя полями кристаллизации
компонентов AE1EE3,
ВE1EE2,
СE2EE3
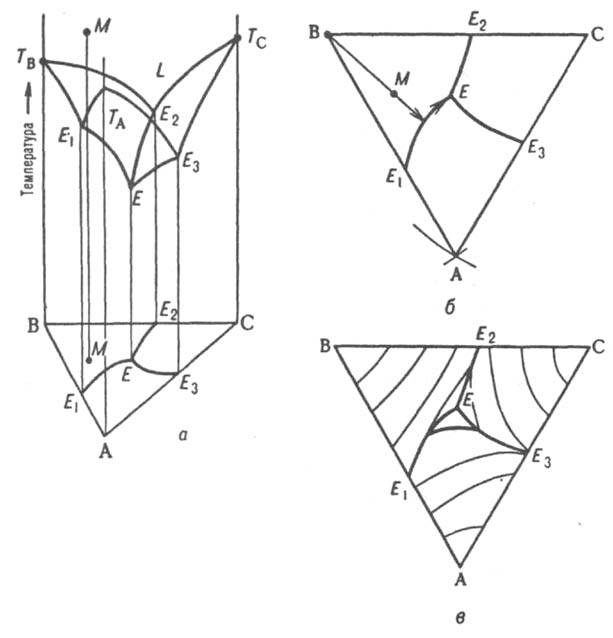
Рис. 9. Диаграмма плавкости тройной системы эвтектического типа: а - пространственная диаграмма, б плоская диаграмма, в плоская диаграмма с нанесенными на ней изотермами. ТА, ТB, ТC т-ры плавления компонентов А, В и С соотв., L область существования жидкой фазы; E1, E2, E3 эвтектич. точки двойных систем АВ, ВС и СА соотв., Е тройная эвтектич. точка; М фигуративная точка системы. Первоначально однофазная и четырехвариантная (условно трехвариантная) система становится двухфазной и трехвариантной (условно дивариантной). Соотношение кол-в А и С в расплаве при кристаллизации В не изменяется, поэтому состав жидкости в ходе кристаллизации В изменяется вдоль прямой (луча кристаллизации), проходящей через точки М и В в направлении удаления от вершины В. В точке пересечения луча кристаллизации с пограничной кривой Е1Е начинает кристаллизоваться еще и А, система становится трехфазной (условно моновариантной). При дальнейшем охлаждении фигуративная точка жидкой фазы смещается вдоль пограничной линии Е1Е по направлению к тройной эвтектич. точке Е, в к-рой происходит кристаллизация всех трех компонентов при постоянной т-ре, завершающаяся полным затвердеванием системы. Эвтектич. т-ра отвечает условно нонвариантному равновесию всех четырех фаз. Кристаллизация тройной жидкой смеси любого состава в системе такого типа всегда заканчивается образованием тройной эвтектики, т. е. пов-стью солидуса рассматриваемой системы является горизонтальная плоскость, проходящая через точку Е. Обычно рассматривают изотермич. сечение изобарной пространственной диаграммы, наз. изобарно-изотермической. Если при нек-рой т-ре все три компонента - жидкости, из к-рых две ограниченно смешиваются друг с другом, на диаграмме состояния, как и в случае двойных систем, имеется область сосуществования двух жидких фаз, ограниченная бинодалью ЕKF (рис. 10). |