
Расчёт констант равновесия (Ka, Кр, кn, Кс).
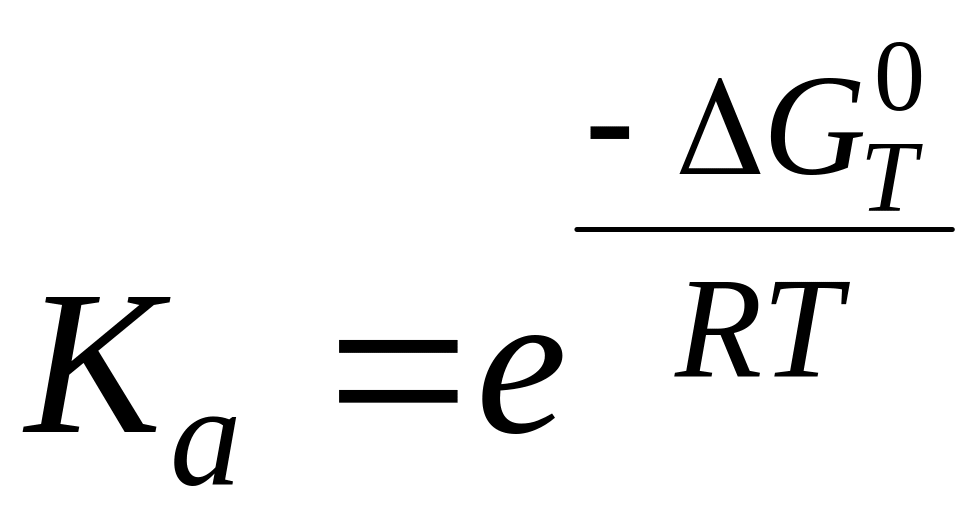 ,
где а
= γP,
Ka
= KγKp.
,
где а
= γP,
Ka
= KγKp.
Если Р ≤ 1атм., γ → 1, Kγ ≈ 1, тогда Ka = Kp.
Если Р = 1атм., то Kp = KN.
![]() .
.
Пример расчёта равновесного состава:
Ka = KγKp, где Kγ – константа равновесия, выраженная через коэффициенты активности. Рассчитывается для газовых реакций по справочным данным, если Р >> 1 атм. Если давление в системе не велико Kγ → 1 и Ka = Kp.
1. Область невысоких давлений (Р ≤ 1 атм.)
C2H6 ↔ C2H4 + H2 (реакционная смесь имеет стехиометрический состав). Обозначим через X конверсию исходных веществ в момент равновесия.
Компонент |
Состав, моль |
|
исходные |
равновесные |
|
C2H6 |
1 |
1 – X |
C2H4 |
− |
X |
H2 |
− |
X |
∑ni = 1 – X + X + X = 1 + X
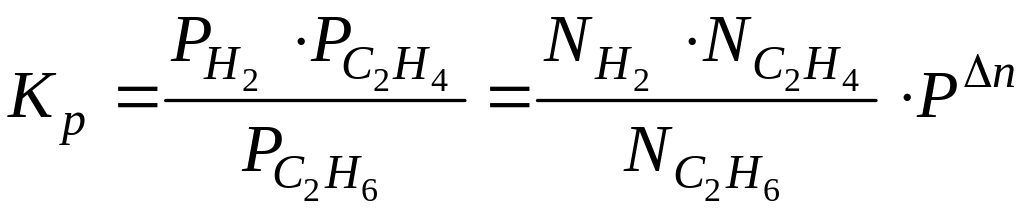 ,
где ∆n
= (1
+
1)
– 1 = 1.
,
где ∆n
= (1
+
1)
– 1 = 1.
Pi = NiP;
 ;
;
 ;
;
Зная численное значение константы, найдём X:
X
=
 ;
;
X может быть равен нулю, то есть константа очень мала и реакция не идёт в прямом направлении. Если константа слишком велика (т. е. равновесие сдвинуто вправо), X в пределе будет равен максимальной величине стехиометрического коэффициента (при условии, что расчёт ведут по стехиометрическому составу).
2. Равновесный состав в объёмных процентах.
%i = Ni∙100%;
![]() =
=
![]() =
=
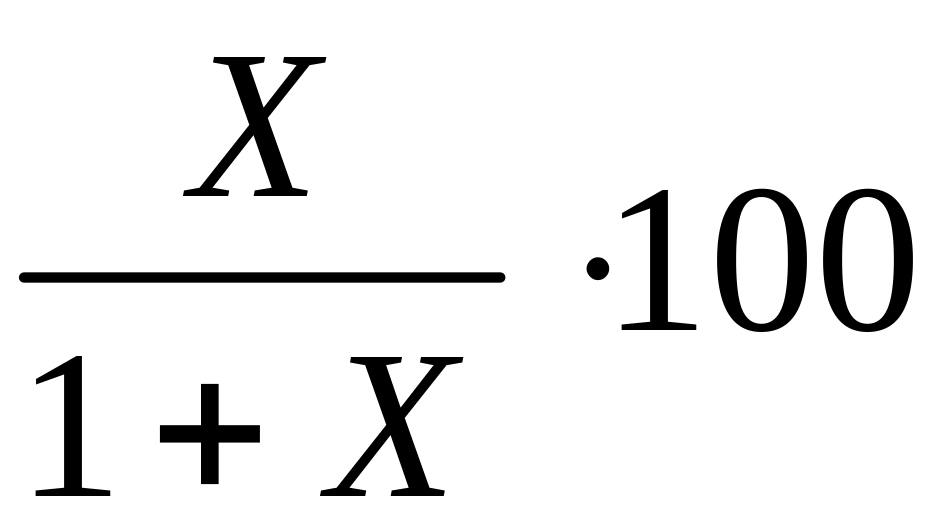 ;
;
![]() =
=
 ∙100;
∙100;
Пример заполнения таблиц и выражения констант для более сложных реакций (по стехиометрии):
3H2 + N2 ↔ 2NH3;
Компонент |
Состав, моль. |
|
исходные |
равновесные |
|
H2 |
3 |
|
N2 |
1 |
|
NH3 |
− |
X |
3 моль H2 2 моль NH3;
? моль H2 X моль NH3;
3X = 2∙?;
? =
![]() ;
;
1 моль N2 → 2 моль NH3;
? моль N2 → X моль NH3;
2∙? = X;
? =
![]() ;
;
![]()
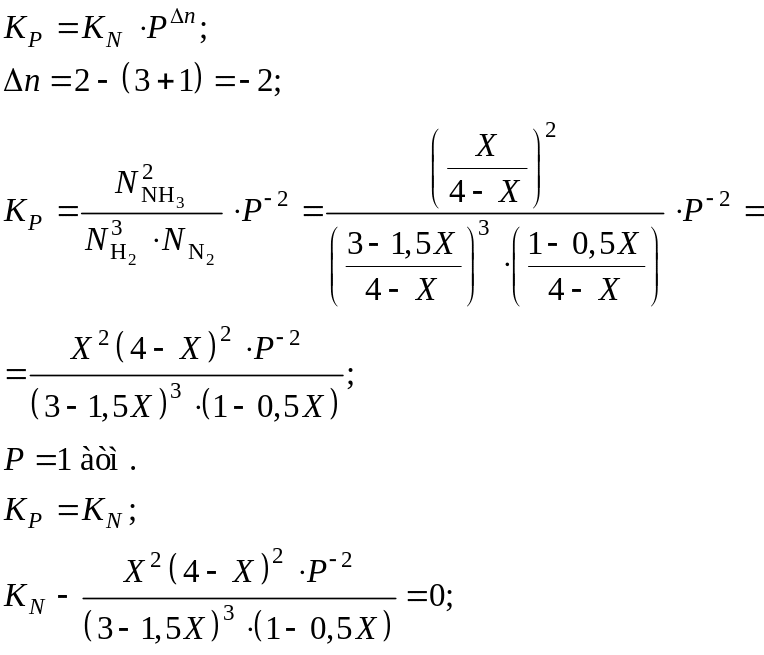
(∆ – отклонение).
Выражение константы Кс для данной реакции.

Состав не стехиометрический, а произвольный.
Например, вышеуказанная реакция имеет 1 моль H2, 2 моля N2, 0,5 моля NH3.
Сначала таблица заполняется по стехиометрии, потом – произвольно.
∆n – считается по стехиометрии.
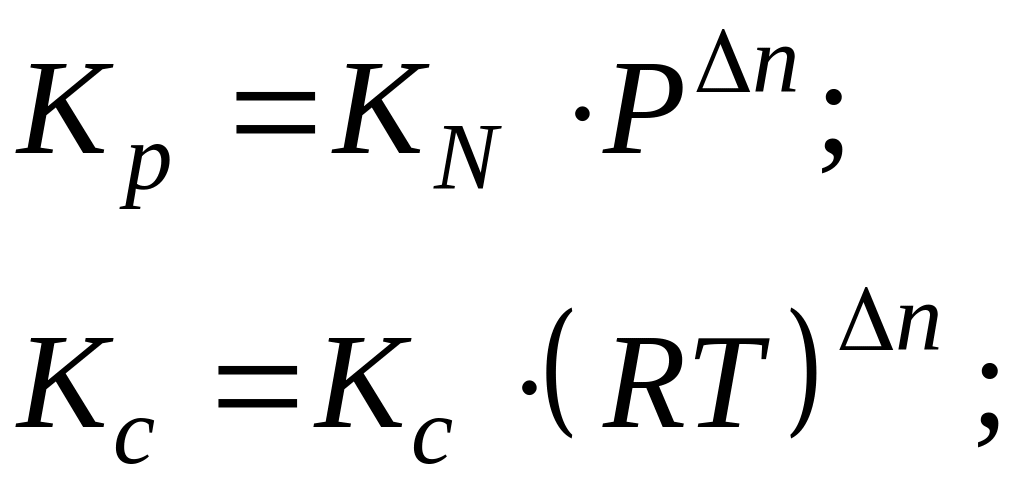
Но при расчёте суммы молей учитывается состав, который задан.
Выражение константы равновесия для гетерогенных реакций.
Активности (парциальные давления) твёрдых фаз, принимаются равными единице, в таблицу их не включают и при расчёте константы не учитывают.
Например:

Компонент |
Состав, моль. |
|
исходные |
равновесные |
|
CО |
1 |
1 – X |
CО2 |
− |
X |
Открытые системы, химический потенциал, условия равновесия.
В этих системах
наряду с энергообменом происходит
массообмен со средой. Для учёта изменения
или перераспределения числа молей
компонента в ходе массообмена вводится
новая функция – химический потенциал.
Для неизолированных систем энергия
Гиббса была функцией двух переменных
G = f(P,
T)
и выражалась dG
= VdP
– SdT;
в открытых системах помимо P
и T
энергия Гиббса будет ещё и функцией
компонентов системы
![]() ,
где
,
где
![]() – моли компонентов.
– моли компонентов.
С учётом этого выражаем полный дифференциал:
 где
ni
– постоянное число всех молей компонентов
системы; nf
– постоянное число всех молей компонентов
системы, кроме одного изменения, которое
рассматривается.
где
ni
– постоянное число всех молей компонентов
системы; nf
– постоянное число всех молей компонентов
системы, кроме одного изменения, которое
рассматривается.
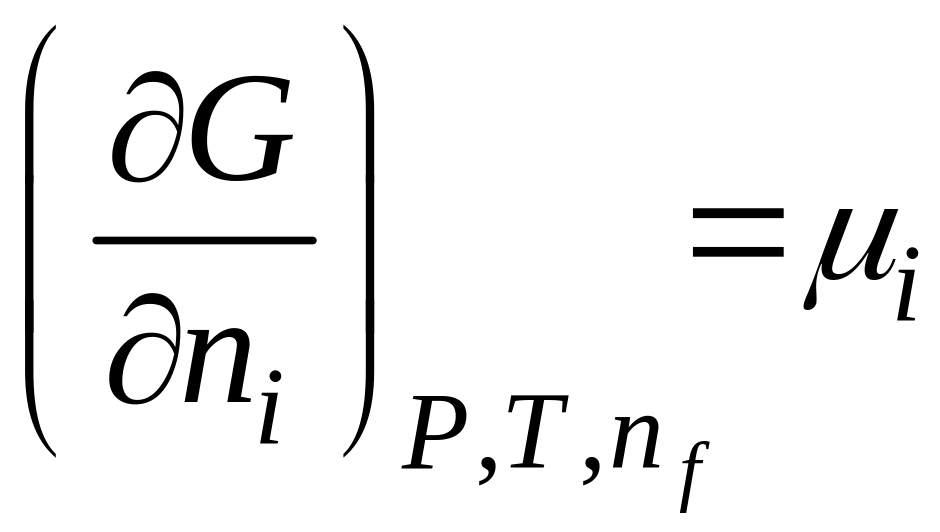 – химический
потенциал.
– химический
потенциал.
![]()
Примечание: потенциал выражают аналогично через F, H или U, поэтому химическим потенциалом компонента называется частная производная от любого другого потенциала по числу молей этого компонента при постоянстве соответствующих параметров состояния.
При P и T = const, dP, dT = 0;
![]()
Для состояния
равновесия dG
= 0, следовательно
![]() – условие равновесия для систем с
массообменом.
– условие равновесия для систем с
массообменом.
