
- •Основное уравнение мкт для идеального газа.
- •Изотермический, изобарный и изохорный процессы в идевльном газе.
- •Принцип действия тепловых машин.
- •Тепловые двигатели.
- •Кпд тепловых двигателей.
- •Закон сохранения электрического заряда.
- •Взаимодействие точечных зарядов.
- •Диэлектрики в электрическом поле.
- •Условия существования электрического тока:
- •Электрический ток и его основные характеристики.
- •Электрические цепи с последовательным и параллельным соединениями.
- •Работа электрического тока.
- •Сторонние силы. Эдс источника тока.
- •Падение напряжения на участке цепи.
- •Магнитные свойства вещества
- •50. Магнитный поток.
- •Сложение двух гармонических колебаний одинакового направления и частоты
- •Сложение двух гармонических колебаний с неодинаковыми частотами. (Биения и модуляции)
- •77. Пространство и время в специальной теории относительности (сто).
- •80. Химическое действие света
- •Законы внешнего фотоэффекта
- •86. Фотон, его энергия и иппульс.
- •88. Радиоактивность. Закон радиационного распада.
И
 деальный
газ — математическая
модель газа,
в которой предполагается, что потенциальной
энергией взаимодействия молекул можно
пренебречь по сравнению с их кинетической
энергией.
Между молекулами не действуют силы
притяжения или отталкивания, соударения
частиц между собой и со стенками
сосуда абсолютно
упруги,
а время взаимодействия между молекулами
пренебрежимо мало по сравнению со
средним временем между столкновениями.,
где р — давление идеального газа, m0 —
масса молекулы,
деальный
газ — математическая
модель газа,
в которой предполагается, что потенциальной
энергией взаимодействия молекул можно
пренебречь по сравнению с их кинетической
энергией.
Между молекулами не действуют силы
притяжения или отталкивания, соударения
частиц между собой и со стенками
сосуда абсолютно
упруги,
а время взаимодействия между молекулами
пренебрежимо мало по сравнению со
средним временем между столкновениями.,
где р — давление идеального газа, m0 —
масса молекулы,
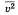 среднее
значение, n-
концентрация частиц.
среднее
значение, n-
концентрация частиц.
Основное уравнение мкт для идеального газа.
Молекулярно-кинетическая теория (сокращённо МКТ) — теория XIX века, рассматривавшая строение вещества, в основном газов, с точки зрения трёх основных приближенно верных положений:
все тела состоят из частиц: атомов, молекул и ионов;
частицы находятся в непрерывном хаотическом движении (тепловом);
частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.
Величина R/NА = k получила название постоянной Больцмана и представляет собой газовую постоянную, отнесенную к одной молекуле: k = 1,38·10-23 Дж/К-23. Основное уравнение МКТ: P=k*n*T, где T – температура, n- концентрация в-ва.
Температура как мера средней кинетической энергии хаотического движения молекул. Температу́ра (от лат. temperatura — надлежащее смешение, нормальное состояние) — скалярная физическая величина, характеризующая приходящуюся на одну степень свободы среднюю кинетическую энергию частиц макроскопической системы, находящейся в состоянии термодинамического равновесия.
T=2*h*Ek2/k.
Эта формула позволяет установить физический смысл абсолютной температуры Т. Этот макроскопический параметр характеризует среднее значение кинетической энергии хаотического теплового движения одной молекулы в состоянии термодинамического равновесия. Интересно отметить, что средняя энергия теплового движения молекул зависит только от температуры газа. При данной температуре средняя кинетическая энергия поступательного хаотического движения молекул не зависит ни от химического состава газа, ни от массы молекул, ни от давления газа, ни от объема, занимаемого газом.
Так как абсолютная температура не может равняться нулю, то и средняя энергия теплового движения молекул то же не может равняться нулю, т.е. молекулы находятся в постоянном движении.
Уравнение Менделеева-Клапейрона. Газы нередко бывают реагентами и продуктами в химических реакциях. Не всегда удается заставить их реагировать между собой при нормальных условиях. Поэтому нужно научиться определять число молей газов в условиях, отличных от нормальных.
Для этого используют уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева):
P · V = (m / M) · RT где m - масса газа, М - молекулярная масса, р - давление, V - объем, Т - абсолютная температура в градусах Кельвина, R - универсальная газовая постоянная. Для данной массы конкретного газа отношение m / M постоянно, поэтому из уравнения Клайперона-Менделеева получается объединенный газовый закон.
Изотермический, изобарный и изохорный процессы в идевльном газе.
Изопроцессы — термодинамические
процессы,
во время которых количество вещества
и ещё одна из физических величин —
параметров состояния: давление, объём или температура —
остаются неизменными.
Изохорный—
процесс изменения состояния
термодинамической системы при постоянном
объёме (![]() ).
Для идеальных газов изохорический
процесс описывается законом
Шарля:
для данной массы газа при постоянном
объёме, давление прямо пропорционально
температуре:
).
Для идеальных газов изохорический
процесс описывается законом
Шарля:
для данной массы газа при постоянном
объёме, давление прямо пропорционально
температуре:
![]()
Изобарный —
процесс изменения состояния
термодинамической системы при постоянном
давлении (![]() )
)
![]()
Изотермический
процесс —
процесс изменения состояния
термодинамической системы при постоянной
температуре (![]() )(
)(![]() ).
Изотермический процесс описывается законом
Бойля — Мариотта:
).
Изотермический процесс описывается законом
Бойля — Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
Жи́дкость — одно из агрегатных состояний вещества. Основным свойством жидкости, отличающим её от других агрегатных состояний, является способность неограниченно менять форму под действием касательных механических напряжений, даже сколь угодно малых, практически сохраняя при этом объём. Свойства: Текучесть – если приложить внешнюю силу, то жидкость потечёт в направлении. Сохранение объёма – при воздействии на жидкость силы, объём сохраняется. Вязкость – способность оказывать сопротивление перемещению.
Поверхностное натяжение. Молекулы жидкости испытывают силы взаимного притяжения — на самом деле, именно благодаря этому жидкость моментально не улетучивается. На молекулы внутри жидкости силы притяжения других молекул действуют со всех сторон и поэтому взаимно уравновешивают друг друга. Молекулы же на поверхности жидкости не имеют соседей снаружи, и результирующая сила притяжения направлена внутрь жидкости. В итоге вся поверхность воды стремится стянуться под воздействием этих сил. По совокупности этот эффект приводит к формированию так называемой силы поверхностного натяжения, которая действует вдоль поверхности жидкости и приводит к образованию на ней подобия невидимой, тонкой и упругой пленки.
Коли́чество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин. Q - энергия, которую тело теряет или приобретает при передаче тепла.[дж] Формула количества теплоты зависит от протекающего процесса. Формулы количества теплоты при некоторых процессах:
 Количество
теплоты при нагревании и
охлаждении.
Количество
теплоты при нагревании и
охлаждении.
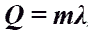 Количество
теплоты при плавлении или
кристаллизации.
Количество
теплоты при плавлении или
кристаллизации.
 Количество
теплоты при кипении, испарении жидкости
и конденсации пара.
Количество
теплоты при кипении, испарении жидкости
и конденсации пара.
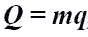 Количество
теплоты при сгорании топлива.
Количество
теплоты при сгорании топлива.
Полезные
формулы:
К![]() оличество
теплоты, переданное телу,
идет на
изменение его внутренней энергии
и
на совершение им работы (Первый закон
термодинамики).
Закон
Джоуля-Ленца: в
неподвижном металлическом проводнике
вся энергия электрического
тока
превращается в тепло:
оличество
теплоты, переданное телу,
идет на
изменение его внутренней энергии
и
на совершение им работы (Первый закон
термодинамики).
Закон
Джоуля-Ленца: в
неподвижном металлическом проводнике
вся энергия электрического
тока
превращается в тепло:
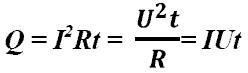 -
закон Джоуля
- Ленца.
-
закон Джоуля
- Ленца.
Уде́льная теплоёмкость - вещества определяется как количество тепловой энергии, необходимой для повышения температуры одного килограмма вещества на один градус. Формула расчёта удельной теплоёмкости:
 ,
где
,
где
 —
удельная теплоёмкость,
—
удельная теплоёмкость,
 —
количество
теплоты,
полученное веществом при нагреве (или
выделившееся при охлаждении),
—
количество
теплоты,
полученное веществом при нагреве (или
выделившееся при охлаждении),
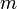 —
масса нагреваемого (охлаждающегося)
вещества,
—
масса нагреваемого (охлаждающегося)
вещества,
 —
разность конечной и начальной температур
вещества. Удельную
теплоёмкость можно найти в таблице.
—
разность конечной и начальной температур
вещества. Удельную
теплоёмкость можно найти в таблице.Уравнение теплового баланса.
Если тела образуют замкнутую систему и между ними происходит только теплообмен, то алгебраическая сумма полученных Qnи отданных Q0энергий равна нулю:
![]()
Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. ΔU = cVM (t2 – t1)
Изменение внутренней энергии.
Внутренняя энергия изменяется при помощи работы и теплопередачи. Необходимо отметить, что теплопередача может происходить тремя способами, это:
1) Процесс конвекции;
2)Процесс излучения;
3 )Процесс теплопроводности.
Вычисление работы в термодтнамике.
Формулы
для вычисления работы при постоянном
давлении:
![]() -
Работа газа при изобарном процессе (p
= const)
-
Работа газа при изобарном процессе (p
= const)
![]() -
Работа газа при изобарном процессе (p
= const) R = 8,31 - универсальная
газовая постоянная
-
Работа газа при изобарном процессе (p
= const) R = 8,31 - универсальная
газовая постоянная
Первый закон термодинамики.
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
|
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
|
