
- •Энергия и импульс фотона. Формула Планка для спектра излучения черного тела.
- •Квантовая теория фотоэффекта. Эффект Комптона.
- •Давление света. Опыты, подтверждающие давление света. Корпускулярно-волновой дуализм излучения.
- •Свойства волн де Бройля и их статистическая интерпретация. Опыты, подтверждающие волновые свойства микрочастиц.
- •Волновой пакет микрочастицы. Соотношение неопределенностей Гейзенберга.
- •Опыты Резерфорда по рассеянию -частиц. Формула Резерфорда. Модель атома Резерфорда-Бора.
- •З акономерности в спектрах атома водорода. Серии Лаймана, Бальмера, Пашена. Комбинационный принцип Ритца.
- •Дискретность квантовых состояний атома. Постулаты Бора. Опыты Франка-Герца.
- •Спонтанные и вынужденные переходы. Коэффициенты Эйнштейна. Спектральная плотность излучения.
- •Волновая функция микрочастицы и ее свойства. Стационарное и нестационарное уравнение Шредингера.
- •Частица в одномерной бесконечно глубокой потенциальной яме: уравнение Шредингера, его решение, уровни энергии частицы.
- •Прохождение микрочастицы через потенциальный барьер. Туннельный эффект.
- •14. Туннельный эффект. Коэффициент прозрачности барьера
- •Гармонический осциллятор. Квантовомеханическое описание атома водорода.
- •Уровни энергии и схема термов щелочных металлов. Дублетная структура спектров щелочных металлов.
- •Магнитный и механический моменты электронов. Спин. Опыты Штерна и Герлаха.
- •Результирующий механический момент многоэлектронного атома. J-j и l-s связь.
- •Нормальный и аномальный эффекты Зеемана. Фактор Ланде.
- •Нормальный эффект Зеемана
- •Аномальный эффект Зеемана
- •Электронные оболочки атома и их заполнение. Принцип Паули. Правила Хунда.
- •Количество электронов в каждой оболочке
- •Тормозное и характеристическое рентгеновское излучение. Закон Мозли.
- •Физические особенности в молекулярных спектрах. Энергия и спектр двухатомной молекулы. P-, q- и r-ветви.
- •Одномерный кристалл Кронига-Пенни. Понятие о зонной теории твердых тел. Фермионы и бозоны.
- •Расщепление энергетических уровней и образование зон. Различие между металлами, полупроводниками и диэлектриками в зонной теории.
- •Свойства и характеристика ядер. Нейтрон и протон, их свойства. Энергия связи ядра.
- •Свойства и модель ядерных сил. Капельная модель ядра. Формула Вейцзеккера для энергии связи. Оболочечная модель ядра.
- •Искусственная и естественная радиоактивность. Основной закон радиоактивного распада. Активность. Правила смещения.
- •Основные закономерности -распада. Туннельный эффект. Свойства -излучения.
- •Основные закономерности -распада и его свойства. Нейтрино. Электронный захват. (см 27)
- •Получение трансурановых элементов. Основные закономерности реакций деления ядер.
- •Цепная реакция деления. Управляемая цепная реакция. Ядерный реактор.
- •Термоядерный синтез. Энергия звезд. Управляемый термоядерный синтез.
- •Источники и методы регистрации элементарных частиц. Типы взаимодействий и классы элементарных частиц. Античастицы.
- •Законы сохранения при превращениях элементарных частиц. Понятие о кварках.
- •Физическое, химическое и биологическое воздействие ионизирующего излучения.
- •Физические свойства ионизирующих излучений
- •Биологическое действие ионизирующих излучений
- •Дозы ионизирующих излучений и единицы их измерений. Радиационная безопасность.
- •Основные принципы обеспечения радиационной безопасности
- •Закономерности излучения черного тела. Законы Кирхгофа, Стефана-Больцмана, Вина. Формула Рэлея-Джинса. Ультрафиолетовая катастрофа.
Волновая функция микрочастицы и ее свойства. Стационарное и нестационарное уравнение Шредингера.
Волновая функция имеет статистический смысл: квадрат модуля волновой функции определяет плотность вероятности нахождения частицы (электрона): dw/dV = |Ψ|2.
Здесь dw вероятность нахождения частицы в элементе объема от V до V+dV.
Свойства волновой функции:
1) Правило нормировки:
![]()
Правило выражает тот факт, что вероятность обнаружить частицу с данной волновой функцией во всем пространстве равна единице.
2) Импульс частицы в каждом из направлений x, y, z пропорционален первой производной волновой функции, делённой на саму волновую функцию, а именно:
![]()
![]()
![]()
где px , py , pz — проекции импульсов на соответствующие оси координат, i = √-1 - мнимая единица, ħ = h/2π - постоянная Планка.
3)
Кинетическая энергия частицы (p2x
+
p2y
+ p2z)
/ 2m
пропорциональна
второй производной, или кривизне волновой
функции, деленной на эту волновую
функцию
![]() .
.
Стационарное уравнение Шредингера для движения электрона в кулоновском поле ядра атома водорода и водородоподобных атомов имеет вид: ∆ψ + (8π2m/h2)(E-U)Ψ = 0,
где Ψ – волновая функция, ∆ - оператор Лапласа, Е – полная энергия электрона в атоме, U = -(Ze2/4πε0r) – потенциальная энергия.
Уравне́ние Шрёдингера — уравнение, описывающее изменение в пространстве и во времени чистого состояния, задаваемоговолновой функцией, в гамильтоновых квантовых системах. Играет в квантовой механике такую же важную роль, как уравнениевторого закона Ньютона в классической механике. Его можно назвать уравнением движения квантовой частицы. УстановленоЭрвином Шрёдингером в 1926 году.

Решение уравнения Шредингера для свободной микрочастицы и находящейся в потенциальной яме.
Уравнение Шредингера. Стационарное уравнение Шредингера. Решение уравнения Шредингера для свободной частицы.
Уравнение Шредингера.
![]() где:
h
=
1,05610
34
Дж·с
- постоянная
Планка, m
- масса
микрочастицы,
где:
h
=
1,05610
34
Дж·с
- постоянная
Планка, m
- масса
микрочастицы,
![]() -
оператор Лапласа,
U
- потенциальная
энергия микрочастицы,
-
оператор Лапласа,
U
- потенциальная
энергия микрочастицы,
i - мнимая единица.
Стационарное состояние - это состояние микрочастицы со строго определенной энергией Е. Для стационарного состояния волновая функция имеет вид
![]()
где![]() -
волновая функция, зависящая только от
координат.
-
волновая функция, зависящая только от
координат.
Стационарное уравнение Шредингера.
![]()
Стационарное уравнение Шредингера для электрона в водородопо-добном ионе
![]()
где: Z - зарядовое число
(Z = 1 для водорода, Z = 2 для He+ , Z = 2 для Li++), m = 9,11·10–31 кг - масса электрона, е = 1,6·10–19 Кл - заряд электрона, ε 0 = 8,85·10 12 Ф/м - электрическая постоянная, h = 1,056·10-34 Дж·с - постоянная Планка, r - расстояние от ядра до электрона, Е - энергия электрона,
![]() -
волновая функция, зависящая только от
координат.
-
волновая функция, зависящая только от
координат.
Т![]() ак
как поле, в котором движется электрон,
является центрально-симметричным,
то для решения данного уравнения обычно
используют сферическую
систему координат
ак
как поле, в котором движется электрон,
является центрально-симметричным,
то для решения данного уравнения обычно
используют сферическую
систему координат![]()
В теории дифференциальных уравнений показано, что уравнение
и![]() меет
решения, удовлетворяющиетребованиям
однозначности, конеч-ности
и непрерывности волновой функции ψ,
только при собственных
значениях
энергии
меет
решения, удовлетворяющиетребованиям
однозначности, конеч-ности
и непрерывности волновой функции ψ,
только при собственных
значениях
энергии
где n = 1, 2, 3, … - главноеквантовое число.
Таким образом, решение уравнения Шредингера для атома водоро-да (Z = 1) приводит к появлению дискретных энергетических уровней E1, E2, E3, … , показанных на рисунке в виде горизонтальных прямых.
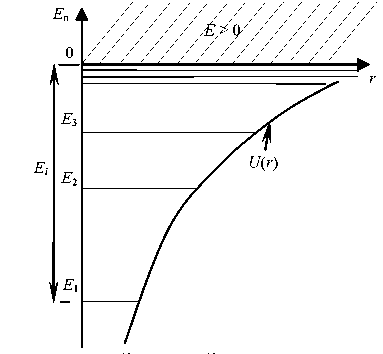
Состояниес наименьшей энергией является основным
![]()
все остальные состоянияназываются возбуждённые.
По мере роста главного квантового числа n энергетические уровни располагаются теснее и при n = ∞ энергия E∞ = 0. При E > 0 движение электрона является свободным.
Энергия ионизации атома водорода
![]()
![]()
И![]() з
решения уравнения Шредингера вытекает,
что момент
импульса электрона не
может быть произвольным, а принимает
дискретные значения
з
решения уравнения Шредингера вытекает,
что момент
импульса электрона не
может быть произвольным, а принимает
дискретные значения
где l - орбитальное квантовое число, которое при заданном n принимает значения l = 0, 1, 2, …, (n - 1), т.е. всего n значений.
Из решения уравнения Шредингера следует также, что вектор момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция на направление oz внешнего магнитного поля принимает квантованные значения, кратные h
г![]() де
ml
- магнитное орбитальноеквантовое число,
которое
при заданном l
может
принимать значения ml
=
0,±1,±2,...,± l.,
т.е. всего 2l
+
1
де
ml
- магнитное орбитальноеквантовое число,
которое
при заданном l
может
принимать значения ml
=
0,±1,±2,...,± l.,
т.е. всего 2l
+
1
значений.
Спин электрона - это собственный механический момент импульса электрона, не связанный с движением электрона в пространстве.
Спин электрона (и всех других микрочастиц) - квантовая величина, у неё нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Собственный механический момент импульса (спин) Ls согласно общим выводам квантовой механики квантуется по закону
![]() где
s
=1\2
спиновое квантовое число.
где
s
=1\2
спиновое квантовое число.
Проекция спина на направление внешнего магнитного поля принимает квантованные значения,кратные h
г![]() де
ms
- магнитное спиновое квантовое число,
которое
имеет только два
де
ms
- магнитное спиновое квантовое число,
которое
имеет только два
значения![]()
Хотя
энергия электрона и зависит только от
главного квантового числа n,
но
каждому собственному значению энергии
E
n
(кроме
E
1)
соответствует
несколько собственных функций![]() отличающихся
значениями квантовых чисел l,
ml
и
ms
Следовательно,
атом водорода
может иметь одно и тоже значение энергии,
находясь в нескольких
различных состояниях, соответствующих
данному n.
отличающихся
значениями квантовых чисел l,
ml
и
ms
Следовательно,
атом водорода
может иметь одно и тоже значение энергии,
находясь в нескольких
различных состояниях, соответствующих
данному n.
