
- •Энергия и импульс фотона. Формула Планка для спектра излучения черного тела.
- •Квантовая теория фотоэффекта. Эффект Комптона.
- •Давление света. Опыты, подтверждающие давление света. Корпускулярно-волновой дуализм излучения.
- •Свойства волн де Бройля и их статистическая интерпретация. Опыты, подтверждающие волновые свойства микрочастиц.
- •Волновой пакет микрочастицы. Соотношение неопределенностей Гейзенберга.
- •Опыты Резерфорда по рассеянию -частиц. Формула Резерфорда. Модель атома Резерфорда-Бора.
- •З акономерности в спектрах атома водорода. Серии Лаймана, Бальмера, Пашена. Комбинационный принцип Ритца.
- •Дискретность квантовых состояний атома. Постулаты Бора. Опыты Франка-Герца.
- •Спонтанные и вынужденные переходы. Коэффициенты Эйнштейна. Спектральная плотность излучения.
- •Волновая функция микрочастицы и ее свойства. Стационарное и нестационарное уравнение Шредингера.
- •Частица в одномерной бесконечно глубокой потенциальной яме: уравнение Шредингера, его решение, уровни энергии частицы.
- •Прохождение микрочастицы через потенциальный барьер. Туннельный эффект.
- •14. Туннельный эффект. Коэффициент прозрачности барьера
- •Гармонический осциллятор. Квантовомеханическое описание атома водорода.
- •Уровни энергии и схема термов щелочных металлов. Дублетная структура спектров щелочных металлов.
- •Магнитный и механический моменты электронов. Спин. Опыты Штерна и Герлаха.
- •Результирующий механический момент многоэлектронного атома. J-j и l-s связь.
- •Нормальный и аномальный эффекты Зеемана. Фактор Ланде.
- •Нормальный эффект Зеемана
- •Аномальный эффект Зеемана
- •Электронные оболочки атома и их заполнение. Принцип Паули. Правила Хунда.
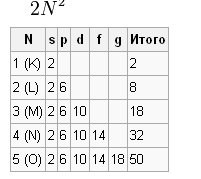
- •Количество электронов в каждой оболочке
- •Тормозное и характеристическое рентгеновское излучение. Закон Мозли.
- •Физические особенности в молекулярных спектрах. Энергия и спектр двухатомной молекулы. P-, q- и r-ветви.
- •Одномерный кристалл Кронига-Пенни. Понятие о зонной теории твердых тел. Фермионы и бозоны.
- •Расщепление энергетических уровней и образование зон. Различие между металлами, полупроводниками и диэлектриками в зонной теории.
- •Свойства и характеристика ядер. Нейтрон и протон, их свойства. Энергия связи ядра.
- •Свойства и модель ядерных сил. Капельная модель ядра. Формула Вейцзеккера для энергии связи. Оболочечная модель ядра.
- •Искусственная и естественная радиоактивность. Основной закон радиоактивного распада. Активность. Правила смещения.
- •Основные закономерности -распада. Туннельный эффект. Свойства -излучения.
- •Основные закономерности -распада и его свойства. Нейтрино. Электронный захват. (см 27)
- •Получение трансурановых элементов. Основные закономерности реакций деления ядер.
- •Цепная реакция деления. Управляемая цепная реакция. Ядерный реактор.
- •Термоядерный синтез. Энергия звезд. Управляемый термоядерный синтез.
- •Источники и методы регистрации элементарных частиц. Типы взаимодействий и классы элементарных частиц. Античастицы.
- •Законы сохранения при превращениях элементарных частиц. Понятие о кварках.
- •Физическое, химическое и биологическое воздействие ионизирующего излучения.
- •Физические свойства ионизирующих излучений
- •Биологическое действие ионизирующих излучений
- •Дозы ионизирующих излучений и единицы их измерений. Радиационная безопасность.
- •Основные принципы обеспечения радиационной безопасности
- •Закономерности излучения черного тела. Законы Кирхгофа, Стефана-Больцмана, Вина. Формула Рэлея-Джинса. Ультрафиолетовая катастрофа.
Количество электронов в каждой оболочке
Данное количество вычисляется по формуле:
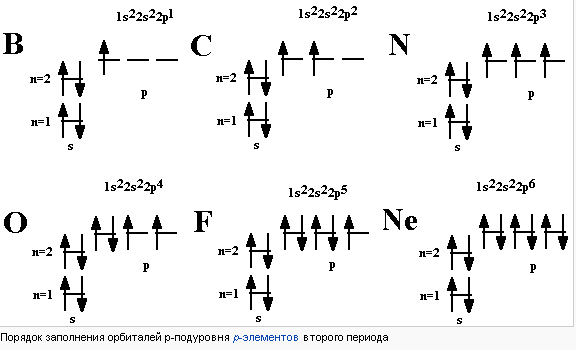
Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Другая формулировка: Ниже по энергии лежит тот атомный терм, для которого выполняются два условия. -Мультиплетность максимальна -При совпадении мультиплетностей суммарный орбитальный момент L максимален.
Разберём это правило на примере заполнения орбиталей p-подуровня p-элементов второго периода (то есть от бора до неона (в приведённой ниже схеме горизонтальными чёрточками обозначены орбитали, вертикальными стрелками — электроны, причём направление стрелки обозначает ориентацию спина):
Как видно, сначала появляется один электрон на 2px-орбитали, затем один электрон на 2py-орбитали, после этого один электрон на 2pz-орбитали, затем появляются парные электроны на 2px-, 2py- и 2pz-орбиталях.
Тормозное и характеристическое рентгеновское излучение. Закон Мозли.
Когда энергия бомбардирующих анод электронов становится достаточной для вырывания электронов из внутренних оболочек атома, на фоне тормозного излучения появляются резкие линии характеристического излучения. Частоты этих линий зависят от природы вещества анода, поэтому их и назвали характеристическими.
Состояние
атома с вакансией во внутренней оболочке
неустойчиво. Электрон одной из внешних
оболочек может заполнить эту вакансию,
и атом при этом испускает избыток энергии
в виде фотона характеристического
излучения:
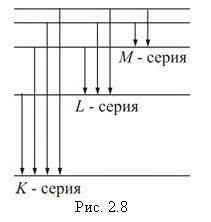
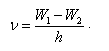 Все переходы на k-оболочку
образуют K-серию,
соответственно, на l- и m-оболочки
– L- и M-серии
(рис. 2.8).
Все переходы на k-оболочку
образуют K-серию,
соответственно, на l- и m-оболочки
– L- и M-серии
(рис. 2.8).
Английский физик Генри Мозли в 1913 году установил закон, названный его именем, связывающий частоты линий рентгеновского спектра с атомным номером испускающего их элемента Z:
![]()
Здесь ![]() ,
постоянная Ридберга; σ – постоянная,
учитывающая экранирующую роль окружающих
ядро электронов. Чем дальше электрон
от ядра, тем σ больше.
,
постоянная Ридберга; σ – постоянная,
учитывающая экранирующую роль окружающих
ядро электронов. Чем дальше электрон
от ядра, тем σ больше.
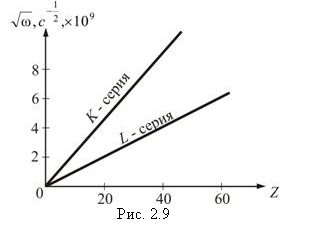
На рис. 2.9 показана графическая зависимость закона.
Закон Мозли позволил по измерению длин волн λ рентгеновских лучей точно установить атомный номер элемента. Он сыграл большую роль при размещение элементов в таблице Менделеева.
Физические особенности в молекулярных спектрах. Энергия и спектр двухатомной молекулы. P-, q- и r-ветви.
Молекула — частица, образованная двумя или большим количеством атомов, характеризующаяся определённым количеством входящих в неё атомных ядер и электронов, а также определённой структурой.
Энергия свободной молекулы состоит из энергии поступательного движения молекулы как единого целого, энергии колебания атомов внутри молекулы, энергии вращения целой молекулы и ее частей относительно друг друга, энергии электронного возбуждения молекулы (энергия движения электронов в молекуле) и внутриядерной энергии:
Е=Епост +Евр+Екол +Еэл +Еяд.
Молекулярные
спектры - спектры испускания и поглощения
электромагнитного излучения и комбинацию
рассеяния света, принадлежащие свободным
или слабо связанным молекулам. Имеют
вид совокупности полос (линий) в
рентгеновской, УФ - видимой, ИК и
радиоволновой областях спектра. Положение
полос (линий) в спектрах испускания и
поглощения характеризуется частотами
v и волновыми числами υ; оно определяется
разностью энергий Е' и Е: тех состояний
молекулы, между которыми происходит
квантовый переход:
![]()
