
- •Энергия и импульс фотона. Формула Планка для спектра излучения черного тела.
- •Квантовая теория фотоэффекта. Эффект Комптона.
- •Давление света. Опыты, подтверждающие давление света. Корпускулярно-волновой дуализм излучения.
- •Свойства волн де Бройля и их статистическая интерпретация. Опыты, подтверждающие волновые свойства микрочастиц.
- •Волновой пакет микрочастицы. Соотношение неопределенностей Гейзенберга.
- •Опыты Резерфорда по рассеянию -частиц. Формула Резерфорда. Модель атома Резерфорда-Бора.
- •З акономерности в спектрах атома водорода. Серии Лаймана, Бальмера, Пашена. Комбинационный принцип Ритца.
- •Дискретность квантовых состояний атома. Постулаты Бора. Опыты Франка-Герца.
- •Спонтанные и вынужденные переходы. Коэффициенты Эйнштейна. Спектральная плотность излучения.
- •Волновая функция микрочастицы и ее свойства. Стационарное и нестационарное уравнение Шредингера.
- •Частица в одномерной бесконечно глубокой потенциальной яме: уравнение Шредингера, его решение, уровни энергии частицы.
- •Прохождение микрочастицы через потенциальный барьер. Туннельный эффект.
- •14. Туннельный эффект. Коэффициент прозрачности барьера
- •Гармонический осциллятор. Квантовомеханическое описание атома водорода.
- •Уровни энергии и схема термов щелочных металлов. Дублетная структура спектров щелочных металлов.
- •Магнитный и механический моменты электронов. Спин. Опыты Штерна и Герлаха.
- •Результирующий механический момент многоэлектронного атома. J-j и l-s связь.
- •Нормальный и аномальный эффекты Зеемана. Фактор Ланде.
- •Нормальный эффект Зеемана
- •Аномальный эффект Зеемана
- •Электронные оболочки атома и их заполнение. Принцип Паули. Правила Хунда.
- •Количество электронов в каждой оболочке
- •Тормозное и характеристическое рентгеновское излучение. Закон Мозли.
- •Физические особенности в молекулярных спектрах. Энергия и спектр двухатомной молекулы. P-, q- и r-ветви.
- •Одномерный кристалл Кронига-Пенни. Понятие о зонной теории твердых тел. Фермионы и бозоны.
- •Расщепление энергетических уровней и образование зон. Различие между металлами, полупроводниками и диэлектриками в зонной теории.
- •Свойства и характеристика ядер. Нейтрон и протон, их свойства. Энергия связи ядра.
- •Свойства и модель ядерных сил. Капельная модель ядра. Формула Вейцзеккера для энергии связи. Оболочечная модель ядра.
- •Искусственная и естественная радиоактивность. Основной закон радиоактивного распада. Активность. Правила смещения.
- •Основные закономерности -распада. Туннельный эффект. Свойства -излучения.
- •Основные закономерности -распада и его свойства. Нейтрино. Электронный захват. (см 27)
- •Получение трансурановых элементов. Основные закономерности реакций деления ядер.
- •Цепная реакция деления. Управляемая цепная реакция. Ядерный реактор.
- •Термоядерный синтез. Энергия звезд. Управляемый термоядерный синтез.
- •Источники и методы регистрации элементарных частиц. Типы взаимодействий и классы элементарных частиц. Античастицы.
- •Законы сохранения при превращениях элементарных частиц. Понятие о кварках.
- •Физическое, химическое и биологическое воздействие ионизирующего излучения.
- •Физические свойства ионизирующих излучений
- •Биологическое действие ионизирующих излучений
- •Дозы ионизирующих излучений и единицы их измерений. Радиационная безопасность.
- •Основные принципы обеспечения радиационной безопасности
- •Закономерности излучения черного тела. Законы Кирхгофа, Стефана-Больцмана, Вина. Формула Рэлея-Джинса. Ультрафиолетовая катастрофа.
Нормальный и аномальный эффекты Зеемана. Фактор Ланде.
Эффе́кт Зе́емана — расщепление линий атомных спектров в магнитном поле.
Обнаружен
в 1896
г. Зееманом
для эмиссионных линий натрия.
Эффект обусловлен тем, что в присутствии
магнитного поля квантовая частица,
обладающая спиновым магнитным моментом,
приобретает дополнительную энергию
![]() пропорциональную
его магнитному моменту
пропорциональную
его магнитному моменту
![]() Приобретённая
энергия приводит к снятию вырождения
атомных состояний по магнитному
квантовому числу
Приобретённая
энергия приводит к снятию вырождения
атомных состояний по магнитному
квантовому числу
![]() и
расщеплению атомных линий.
и
расщеплению атомных линий.
Нормальный эффект Зеемана
Если
член взаимодействия
![]() мал
(меньше тонкой
структуры
то есть
мал
(меньше тонкой
структуры
то есть
![]() ),
его можно рассматривать как возмущение
и этот случай называют нормальным
эффектом Зеемана. Нормальный эффект
Зеемана наблюдается:
),
его можно рассматривать как возмущение
и этот случай называют нормальным
эффектом Зеемана. Нормальный эффект
Зеемана наблюдается:
при переходах между синглетными термами (
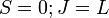 );
);при переходах между уровнями
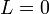 и
и
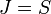 ;
;при переходах между уровнями
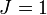 и
и
 ,
поскольку
не
расщепляется, а
расщепляется
на три подуровня.
,
поскольку
не
расщепляется, а
расщепляется
на три подуровня.
Расщепление связано с чисто орбитальным или чисто спиновым магнитным моментами. Это наблюдается в синглетах He и в группе щелочноземельных элементов, а также в спектрах Zn, Cd, Hg.
![]() и
и
![]() поляризация
наблюдаются при изменении проекции
магнитного момента на
поляризация
наблюдаются при изменении проекции
магнитного момента на
![]() и
и
![]() ,
соответственно.
,
соответственно.
Аномальный эффект Зеемана
Для
всех несинглетных линий спектральные
линии атома расщепляются на значительно
большее чем три количество компонент,
а величина расщепления кратна нормальному
расщеплению
![]() .
В случае аномального эффекта величина
расщепления сложным образом зависит
от квантовых чисел
.
В случае аномального эффекта величина
расщепления сложным образом зависит
от квантовых чисел
![]() .
Как указано ранее, приобретенная
электроном в магнитном поле дополнительная
энергия
пропорциональна
.
Как указано ранее, приобретенная
электроном в магнитном поле дополнительная
энергия
пропорциональна
![]() —
фактору,
который называют множителем
Ланде
(гиромагнитный
множитель)
и который дается формулой
—
фактору,
который называют множителем
Ланде
(гиромагнитный
множитель)
и который дается формулой
![]()
где L — значение орбитального момента атома, S — значение спинового момента атома, J — значение полного момента.
Впервые
этот множитель ввел Ланде.
Работы Ланде являлись продолжением
работ Зеемана, поэтому спектры, полученные
Ланде в магнитном поле, называют
аномальным
эффектом Зеемана.
Заметим, что эксперимент Зеемана сделан
при
![]() ,
то есть
,
то есть
![]() ,
поэтому никакой надобности в множителях
не возникало.
,
поэтому никакой надобности в множителях
не возникало.
Таким
образом, вырожденный энергетический
уровень расщепляется на
![]() равноотстояших
зеемановских подуровня (где
равноотстояших
зеемановских подуровня (где
![]() —
максимальное значение модуля магнитного
квантового числа
—
максимальное значение модуля магнитного
квантового числа
![]() .
.
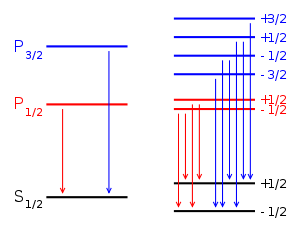
Спектр для нормального (слева) и аномального (справа) случаев.
Множитель Ланде — множитель в формуле для расщепления уровней энергии в магнитном поле, определяющий масштаб расщепления в относительных единицах.
Электронные оболочки атома и их заполнение. Принцип Паули. Правила Хунда.
Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числаn и, как следствие, располагающихся на близких энергетических уровнях. Число электронов в каждой электронной оболочке не превышает определенного максимального значения.
Порядок заполнения электронных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда.
Электронные оболочки обозначаются буквами K, L, M, N, O, P, Q или цифрами от 1 до 7. Подуровни оболочек обозначаются буквами s, p, d, f, g, h, i или цифрами от 0 до 6. Электроны внешних оболочек обладают большей энергией, и, по сравнению с электронами внутренних оболочек, находятся дальше от ядра, что делает их более важными в анализе поведения атома в химических реакциях и в роли проводника, так как их связь с ядром слабее и легче разрывается.
