
- •Вопрос 1.
- •2) Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных;
- •3) Строение молекул может быть установлено на основе изучения их химических свойств.
- •Вопрос 2.
- •Вопрос 3.
- •Пространственная изомерия (стереоизомерия)
- •Вопрос 4.
- •Вопрос 5. Энантиомерия (оптическая изомерия)
- •Вопрос 7.
- •Реакции радикального замещения
- •Реакции электрофильного замещения
- •Вопрос 8.
- •Вопрос 9
- •Вопрос 10
Реакции электрофильного замещения
Изомеризация: Под действием катализатора (например, AlCl3) происходит изомеризация алкана: например, бутан (C4H10), взаимодействуя с хлоридом алюминия (AlCl3), превращается из н-бутана в 2-метилпропан.
С марганцовокислым калием (KMnO4) и бромной водой (Br2) алканы не взаимодействуют.
Вопрос 8.
Механизм радикального замещения (символ SR) на примере монохлорирования метана - анимация I (34 Кб) - анимация II со звуковым комментарием (472 Кб)
Стадия 1 – зарождение цепи - появление в зоне реакции свободных радикалов. Под действием световой энергии гомолитически разрушается связь в молекуле Cl:Cl на два атома хлора с неспаренными электронами (свободные радикалы) Cl:
![]()
Стадия 2 – рост (развитие) цепи. Свободные радикалы, взаимодействуя с молекулами, порождают новые радикалы и развивают цепь превращений:
![]()
(Реакция
Cl +
CH4 ![]() CH3Cl
+ H не
идет, т.к. энергия атомарного
водорода
H значительно
выше, чем метильного радикала СН3).
CH3Cl
+ H не
идет, т.к. энергия атомарного
водорода
H значительно
выше, чем метильного радикала СН3).
![]()
Стадия 3 – обрыв цепи. Радикалы, соединяясь друг с другом, образуют молекулы и обрывают цепь превращений:
![]()
При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. Это объясняется большей устойчивостью третичных и вторичных углеводородных радикалов по сравнению с первичными вследствие делокализации неспаренного электрона. Поэтому, например, при бромировании пропана основным продуктом реакции является 2-бромпропан:
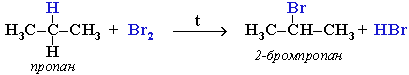
Алканы обесцвечивают раствор брома при нагревании, вступая в реакцию радикального замещения.
Вопрос 9
Этиленовые УВ(алкены)
CnH2n (двойная связь)
Суффиксы –ен;-илен
Валентный угол = 120°
Межъядерное расстояние Rc=c =0.134HM
Плоское строение.
Не возможно свободное вращение между атомами углерода с двойной связью.
П-связь менее прочная
1)углеродной цепи
2)положение двойной связи
3) геометрическая
4)межклассная (с циклоалканами)
Вопрос 10
Химические свойства алкенов.
Характерны реакции присоединения разрывом двойной связи.
Гидрирование (+Н2)
СН2=СН2+Н2→СН3-СН3
Этен Этан
Галогенирование
CH2=CH2+Br2→CH2Br-CH2Br
Присоединение галогеноводородов ( по правила Морковникова)
CH3-CH=CH2+HCl→CH3-CHCl-CH3
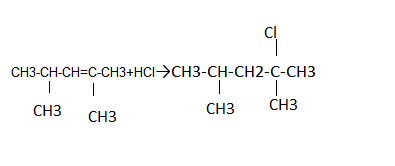
Водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи, галоген к наименее. Где больше водород, туда водород.
Гидратация(+H2O)
CH2=CH2+HOH→CH3-CH2-OH этанол
CH3-CH=CH2+HOH→CH3-CHOH-CH3 пропанол-2
