
АЛКОГОЛЬНЫЕ ЗАБОЛЕВАНИЯ ПЕЧЕНИ
Под алкогольными заболеваниями печени понимают болезни этого органа, связанные с хроническим чрезмерным употреблением спиртных напитков; при этом другие этиологические факторы должны быть исключены. Алкоголь может индуцировать в печени стеатоз, гепатит, цирроз и рак. Нередко эти 4 основных варианта алкогольной печени являются стадиями прогрессиро-вания болезни. При установлении этиологии и стадии заболевания следует учитывать данные анамнеза, клинического и морфологического исследования, причем морфологическим методам (лапароскопии и пункционной биопсии) принадлежит решающее значение в диагностике алкогольной болезни печени.
5.1. АЛКОГОЛЬНЫЙ СТЕАТОЗ ПЕЧЕНИ
Алкогольный стеатоз развивается обычно в раннюю стадию хронического алкоголизма и характеризуется накоплением в ге-патоцитах нейтрального жира. В биоптатах печени больных алкоголизмом это наиболее частая морфологическая находка (у 60—75% больных). Среди причин развития жировой печени этанолу отводится 30—50% [Rubin E., Lieber С, 1974]. Клиническое течение алкогольной жировой печени обычно бессимптомное, единственным проявлением болезни обычно является увеличение печени, хотя возможен холестаз, развитие печеночной недостаточности, синдрома Циве (сочетание острой желтухи с гемолитической анемией и гиперхолестеринемией).
При лапароскопическом исследовании жировая печень, как правило, увеличена, нередко неравномерно и преимущественно за счет одной из долей (чаще правой); консистенция ее плотноватая, нижний край закруглен и свисает. Более плотная консистенция и торчащий нижний край обнаруживаются при сочетании стеатоза с фиброзом. Окраска печени варьирует от темно-коричневой до светло-коричневой и даже желтой [Мухин А. С, 1980]. С помощью гистологического исследования удается установить, что липиды накапливаются обычно в центральных и промежуточных отделах долек (3-я и 2-я зоны аци-нуса, по Rappoport). При выраженном стеатозе распределение липидов диффузное (рис. 44,а). Выделяют 2 морфологические формы ожирения гепатоцитов: 1) крупнокапельное (клетка со-
Алкогольные заболевания печени
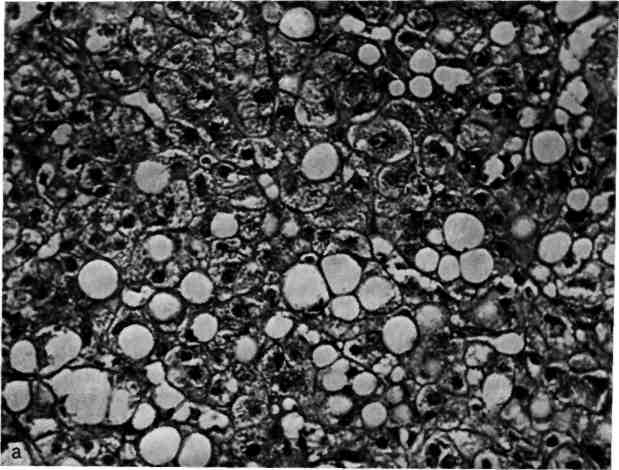
44. Печень при алкогольном стеатозе.
а — гепатоциты содержат крупные жировые вакуоли; окраска гематоксилином и эозином. Х200; б — гигантская митохондрия с паракристаллическими включениями, Х20 000.
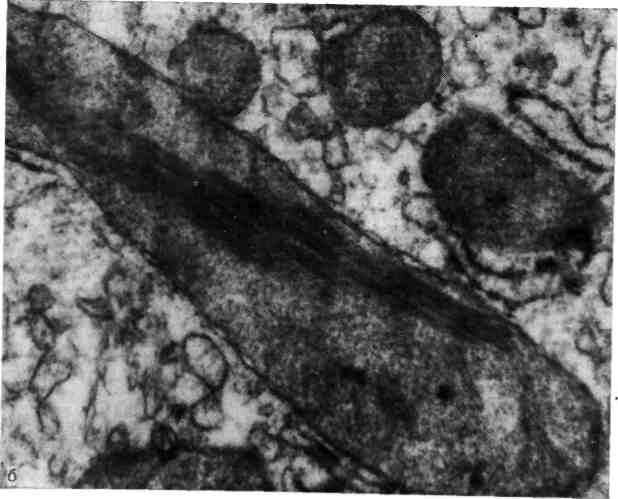
держит одну большую жировую каплю, ядро оттесняется к плаз-молемме) и 2) мелкокапельное (в гепатоците множество мелких жировых включений, ядро может быть в центре печеночной клетки или оттесняться к периферии). В ободке цитоплазмы, свободной от жировых включений, определяются большое содержание гликогена и РНК, высокая активность ферментов гликолиза, пентозного шунта, дезаминирования глютаминовой кислоты, НАД- и НАДФ-диафораз. Активность сукцинатдегидроге-назы умеренная [Лебедев С. П., 1980J. При электронно-микроскопическом исследовании органеллы гепатоцита, оттесненные жиром, мало изменены. Иногда обнаруживаются гигантские или деформированные митохондрии (рис. 44,6), умеренное расширение канальцев ГЦС и ЗЦС, что связано не с накоплением липидов в клетке, а с воздействием этанола. Ультраструктурные изменения гепатоцитов при алкогольном стеатозе различны в разных отделах дольки. В гепатоцитах перипортальной зоны отмечается увеличение митохондрий с большим числом крист, в которых обнаруживаются паракристаллические включения (рис. 44, б) и гранулы; пероксисомы встречаются редко, пластинчатый комплекс и цитоплазматическая сеть не отличаются от нормальных. В центролобулярных гепатоцитах митохондрии обычного вида, число пероксисом значительно возрастает [David Н., 1978].
При выраженном стеатозе 2—3 заполненных жиром гепатоцита могут сливаться, образуя так называемые жировые кисты. Последние иногда окружены макрофагами и лимфоцитами, реже плазматическими клетками, эозинофильными и нейтрофильными лейкоцитами, эпителиоидными и гигантскими клетками. Такие очаговые скопления эффекторных клеток вокруг отложений жира называют липогранулемами.
Алкогольный стеатоз сопровождается накоплением липидов в макрофагах портальных трактов, значительным увеличением числа клеток Ito (липофибробластов), которым придают важное значение в развитии фиброза печени. Перивенулярный фиброз отмечается уже на ранней стадии алкогольного стеатоза и обнаруживается при этой патологии в 40% биоптатов печени [Van Wals L., Lieber C. S., 1977].
Развитие жировой печени связано с токсическим и метаболическим воздействием этанола на гепатоциты. Данные экспериментальных и клинических исследований показали, что этанол усиливает мобилизацию жира из депо, увеличивает синтез жирных кислот в гепатоцитах, повышает эстерификацию жирных кислот до триглицеридов, снижает окисление жирных кислот, уменьшает синтез липопротеинов и их освобождение, а также проницаемость клеточной мембраны гепатоцита в связи с усилением синтеза и накоплением холестерина [Мансуров X. X., 1978; Блюгер А. Ф. и др., 1978; Лебедев С. П., 1980; Lieber С,
8 Морфологическая диагностика
976; Thaler H., 1982]. Прием этанола, даже однократный, по-ышает содержание липидов в крови в связи с мобилизацией х из депо. Этот эффект связан со стимуляцией гипофизарно-адпочечниковой системы и тканевых липаз. Гиперлипидемия вязана также с подавлением активности липазы поджелудочной селезы.
Увеличение синтеза жирных кислот при хроническом алко-элизме обусловлено метаболическим эффектом этанола на пе-ень. Этанол окисляется в цитоплазме печеночной клетки с по-ющью алкогольдегидрогеназы до ацетил-КоА, что сопровож-ается накоплением в цитозоле НАД-Н. Соотношение НАД: 1АД-Н становится равным 2:1 вместо 3:1. Для восстановле-ия реактивной способности акцептора водорода в печеночной летке усиливается синтез жирных кислот, что приводит к пре-ращению НАД-Н в НАД.
Усиление эстерификации жирных кислот ведет к накоплению риглицеридов. Этому способствует активация микросомальной истемы окисления, адаптивная гиперплазия которой связана поступлением в гепатоцит больших количеств этанола. Считает, что именно подключение микросомальной системы позволяет [ечени расщеплять большие количества этанола, так как воз-южности усиления активности алкогольдегидрогеназы невелики. 1олагают, что образование триглицеридов из жирных кислот t условиях повышенного поступления этанола является целесообразным, так как триглицериды являются инертными соеди-[ениями и мало влияют на синтетические процессы в печеноч-[ых клетках.
Уменьшение синтеза фосфолипидов и р-липопротеидов, способных проникать через наружную мембрану гепатоцита, связы-!ают с дефицитом некоторых аминокислот, например, холина 1ли метионина. Важную роль может также играть нарушенный ;интез апопротеинов. В эксперименте in vitro показано, что гганол снижает синтез белка гепатоцитом, причем при введении i перфузат аминокислот нормализуется синтез альбумина [Lie-эег С, 1980]. Поэтому есть все основания полагать, что сек-)еция липопротеинов зависит от интенсивности биосинтеза Зелка.
Существует мнение, что этанол вызывает развитие жировой печени только в сочетании с белково-дефицитной диетой. Однако показано, что у крыс, получавших большие дозы этанола (36% эбщего калоража), аккумуляция жира в печени не предотвращается диетой, богатой белками и холином. Наблюдения за больными хроническим алкоголизмом и добровольцами, получавшими этанол, также показали, что при строгом учете диеты и изокалорийной замене углеводов этанолом увеличение липидов печени не зависит от фактора питания. Причем увеличение в диете содержания белка или уменьшение в ней жира не пре-
дупреждает у человека развитие алкогольного стеатоза [Lie-ber С, 1976].
Биохимические исследования установили, что в жировой печени человека при хроническом алкоголизме содержание валина, аргинина, гистидина, лизина, метионина уменьшается, а лейцина, триптофана, цистина, пролина увеличивается [Мансурова И. Д. и др., 1978]. Причину такого дисбаланса аминокислот в ткани печени связывают с токсическим воздействием этанола на кишечник. Таким образом, самому этанолу, а не недостаточному питанию отводится основная роль в дефиците некоторых аминокислот при алкоголизме.
Накопление в гепатоцитах триглицеридов сочетается с увеличением количества холестерина в связи с повышенным его синтезом. Предпосылкой для этого является избыток ацетил-КоА и индукция ферментов ГЦС, которые обеспечивают процессы синтеза холестерина. Стимуляция этанолом синтеза холестерина подтверждена в эксперименте in vitro. Увеличение содержания холестерина может оказывать стабилизирующее действие на плазматические мембраны и влиять на их вязкость и проницаемость, что затрудняет выход липидов из гепатоцита [Lieber С, 1976].
Итак, развитие алкогольного стеатоза связано с поступлением этанола в печень. Становится понятным, что накопление жира в гепатоцитах характерно для любой стадии алкогольной печени, так как больные продолжают прием спиртных напитков.
Жировая дистрофия печени обычно сочетается с белковой: зернистой, гидропической, баллонной, которые отражают стадии нарушения обмена белка и нарастания гидратации клетки. Развитие гидропической и баллонной дистрофии связывают с тем, что ацетальдегид — промежуточный продукт метаболизма этанола— блокирует секрецию белка клеткой печени. Задержку белка в клетке связывали с повреждением ацетальдегидом мик-кротрубочек [Lieber С, 1980]. Однако исследования последних лет не выявили влияние этанола и продуктов его метаболизма на микротрубочки [Berman W. et al., 1983].
Накопление белка в цитозоле сопровождается поступлением в клетку воды. При гидропической и баллонной дистрофии в гепатоцитах уменьшается содержание гликогена и РНК, снижается активность окислительно-восстановительных ферментов, отмечаются признаки деструкции органелл [Лебедев С. П., 1980].
5.1.1. Эволюция алкогольного стеатоза
Алкогольный стеатоз является обратимой стадией алкогольного поражения печени, но обратимость возможна лишь при прекращении приема алкоголя. С помощью повторных биопсий
ючени показано, что жир исчезает из печени в течение 2—4 нед ти условии прекращения употребления спиртных напитков [Ле->едев С. П., 1980; Мухин А. С, 1980; Thaler H., 1982]. Исчезно-(ение жира обычно начинается с центров долек. Улучшение штания не приводит к обратному развитию стеатоза до тех пор, юка больной не откажется от приема алкоголя. При продол-кающемся алкоголизме возможно прогрессирование заболева-шя, что связано не с накоплением жира в гепатоцитах, а с алкогольной интоксикацией. Данные гистохимического и электрон-ю-микроскопического исследования свидетельствуют об измене-ши метаболизма в гепатоцитах, содержащих жир, преобладании гути прямого окисления. Пентозофосфатный цикл обеспечивает юсстановление энергетических ресурсов, процессы синтеза и ре--енерации клетки. Данные радиоавтографии подтверждают сохранность процессов синтеза в содержащих жир печеночных (летках, так как они активно включают радиоактивную метку Харкисов Д. С, 1977]. В зонах липогранулем вокруг жировых шст могут образовываться ретикулиновые волокна, редко фиб-юзная ткань, однако значение этих изменений для прогресси-ювания фиброза не установлено. Важное прогностическое зна-1ение при алкогольном стеатозе придают перивенулярному риброзу. В экспериментах на павианах показано, что цирроз зечени развивается только у тех животных, у которых в раннюю угадию выявлялся перивенулярный склероз [Lieber С, 1979]. Эднако большинство авторов считает, что прогрессирование алкогольного стеатоза в цирроз связано с повторными атаками эстрого алкогольного гепатита.
5.1.2. Дифференциальный диагноз
Алкогольный стеатоз следует дифференцировать с жировой теченью при сахарном диабете и тучности. При этом учитывают зыраженность перивенулярного фиброза при алкогольном стеа-гозе. Другой особенностью алкогольной жировой печени является сочетание стеатоза с сидерозом. В отличие от этого у больных сахарным диабетом при развитии жировой печени склероз вокруг центральных вен, как правило, отсутствует, часто обнаруживаются так называемые дырчатые, или гликогенные, ядра. При ШИК-реакции в этих вакуолях выявляется гликоген. Сочетание стеатоза и «дырчатых» ядер весьма характерно для :ахарного диабета; при обнаружении этих признаков в пунктате печени проводят обследование больных для исключения скрытой формы заболевания [Thaler H., 1982]. Стеатоз при тучности не имеет характерных черт. У больных с общим ожирением после наложения обходного кишечного анастомоза с лечебной целью в гепатоцитах могут выявляться гиалиноподобные включения.
5.2. АЛКОГОЛЬНЫЙ ГЕПАТИТ
Алкогольный гепатит делят на острый и хронический, при этом учитываются не только течение, но и особенности клинико-морфологических проявлений.
5.2.1. Острый алкогольный гепатит
Острый алкогольный гепатит (ОАГ) выделен в самостоятельную нозологическую форму A. Beckett и соавт. (1961) и включен в Международную классификацию болезней (IX пересмотр, 1980), хотя F. Mallory еще в 1911 г. описал его морфологические признаки. Нозологическая самостоятельность ОАГ подтверждается четкими причинно-следственными отношениями между приемом спиртных напитков и развитием заболевания, наличием характерных клинико-морфологических проявлений болезни.
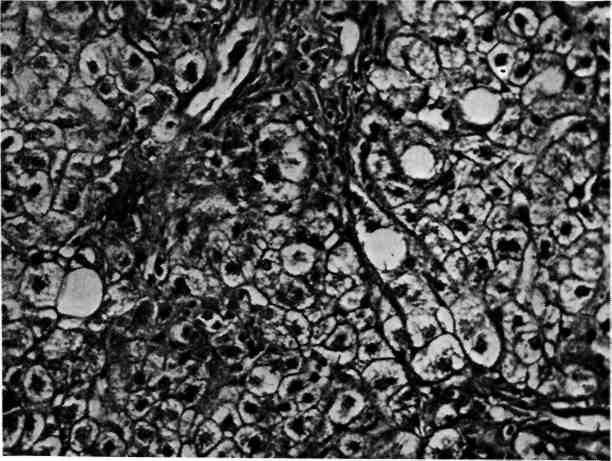
Клинически возможны латентный, желтушный, холестатиче-ский и фульминантный варианты ОАГ. При лапароскопии находят увеличенную в размерах печень, бледную с красноватыми участками, плотной консистенции. Ведущее значение в диагностике ОАГ принадлежит гистологическому исследованию био-птата, при этом учитывают как основные, так и возможные гистологические его признаки. К основным признакам мы относим некроз гепатоцитов с мезенхимальной клеточной реакцией, алкогольный гиалин (тельца Мэллори), преобладание в воспалительном инфильтрате полиморфно-ядерных лейкоцитов (рис. 45, а—в). Возможные признаки ОАГ обнаруживаются не всегда. Это жировая дистрофия и липофусциноз гепатоцитов, сидероз звездчатых эндотелиоцитов, холестаз. При сочетании основных и возможных морфологических критериев ОАГ вероятность этиологической верификации заболевания увеличивается.
Некрозы гепатоцитов чаще колликвационные, очаговые и имеют преимущественно центролобулярную локализацию.' Их связывают с тем, что этанол вызывает пероксидацию липйдов, продукты которой повреждают мембраны клетки. Кроме того, ацетальдегид нарушает синтез белка, блокирует ферменты клетки, вступая в реакцию с SH-группами [Lieber С, 1980]. Видимо, меньшее значение для некроза гепатоцитов имеет накопление в них желчи (желчный некроз) или алкогольного гиалина; не исключают и возможность развития гипоксических некрозов [Мироджов Г. К., 1980].
Алкогольный гиалин представляет собой эозинофильные включения в цитоплазме гепатоцитов в виде сетчатых масс или глыбок неправильной формы с нечеткими контурами. При разрушении гепатоцитов он может располагаться внеклеточно. Алкогольный гиалин впервые описан F. Mallory в 1911 г. и получил
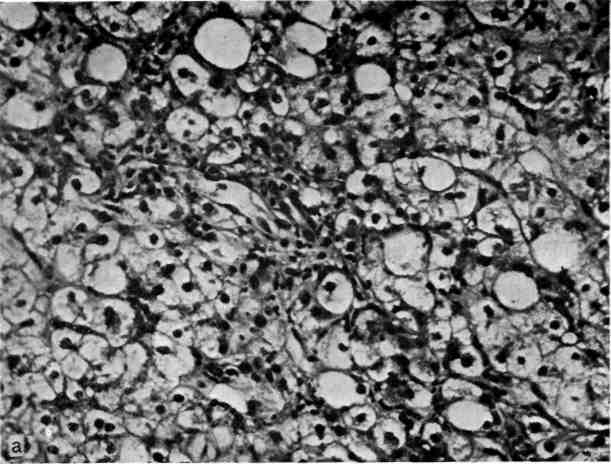
45. Острый алкогольный гепатит, стадия разгара.
а — некрозы групп гепатоцитов с реакцией полиморфно-ядерных лейкоцитов, Х200; б — алкогольный гиалин в цитоплазме гепатоцита, окруженного полиморфно-ядерными лейкоцитами, Х400; в — большое количество алкогольного гиалина в цитоплазме гидропически измененных печеночных клеток. Окраска гематоксилином и эозином, Х200.
Алкогольный гепатит
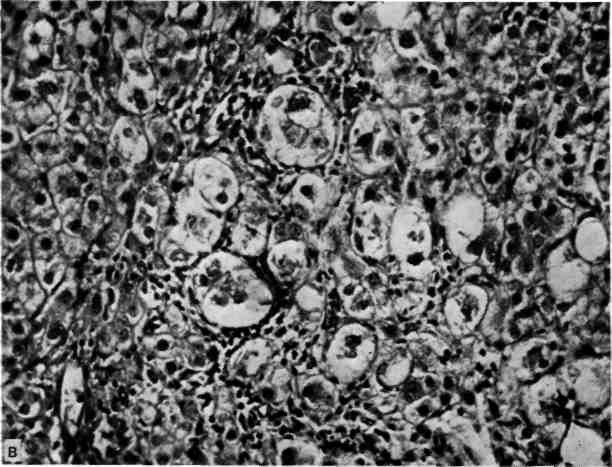
название телец Мэллори. Он окрашивается анилиновым синим в голубой цвет, основным фуксином — в коричневый. При окраске по Мэллори выявляются различия тинкториальных свойств алкогольного гиалина в зависимости от стадий его «старения»: окрашивание варьирует от розово-красного до фиолетового. Для острого алкогольного гепатита характерна центролобулярная локализация алкогольного гиалина. Гепатоциты, содержащие алкогольный гиалин, как правило, окружены полиморфно-ядерными лейкоцитами (см. рис. 45,6).
Ультраструктура телец Мэллори характерна. Они состоят из скоплений фибрилл или гранулярного, иногда гомогенного, вещества без ограничивающей мембраны [Мироджов Г. К., 1980; Серов В. В. и др., 1980; Yokoo H. et al, 1972]. Фибриллы имеют диаметр от 10 до 20 нм, средняя их толщина 14 нм, т. е. соответствует так называемым промежуточным филаментам клеток. Фибриллы могут иметь параллельную ориентацию (тип I, по Yokoo H.), тогда они менее электронно-плотные по сравнению с беспорядочными фибриллами и имеют вид четок. Причудливые изгибы этих фибрилл напоминают отпечатки пальцев, на поперечных срезах параллельные фибриллы имеют вид темных точек (рис. 46, а). Беспорядочно ориентированные фибриллы равномерно электронно-плотные (тип II, по Yokoo H.), они ветвятся и имеют трубчатый вид. Параллельно расположенные нити обычно чередуются с беспорядочными. Гранулярный гиалин
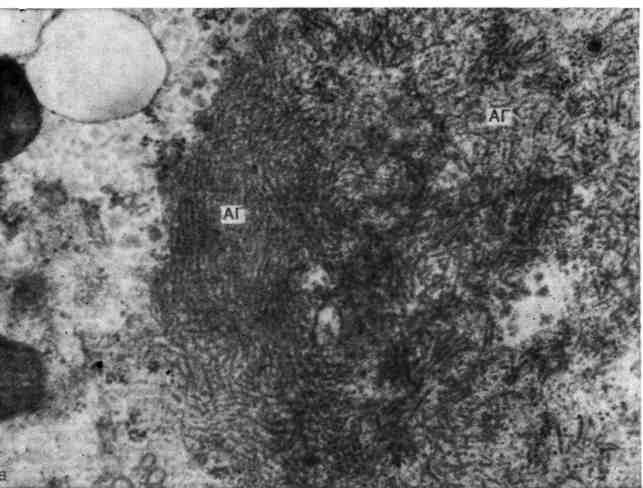
i. Печень при остром алкогольном гепатите, стадия разгара.
— фибриллярный алкогольный гиалин (АГ), параллельно ориентированные фибриллы. 20 000; б — мелкогранулярный алкогольный гиалин (АГ). Х8500.
Алкогольный гепатит
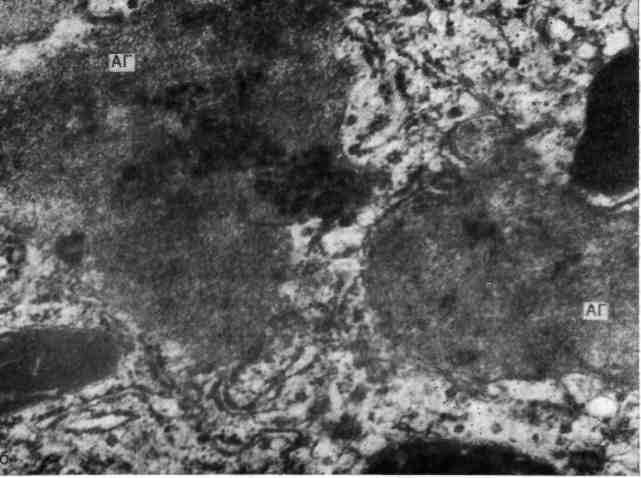
(тип III, no Yokoo H.) выглядит как массивное скопление мелких (мелкогранулярный — рис. 46,6) или крупных (крупногранулярный или кляксоподобный) зерен. Иногда массы гиалина гомогенные, вокруг них может располагаться фибриллярный материал. Фибриллярный алкогольный гиалин является более молодым, при «старении» он превращается в гранулярный [Серов В. В. и др., 1980].
Изучению свойств алкогольного гиалина способствовала разработка методики его выделения из трупной печени [French S. et al., 1972]. Очищенная фракция алкогольного гиалина содержит белок, фосфолипиды и полисахариды. Среди полисахаридов идентифицированы ацетилглюкозамин, гексозамин и рамноза [Luisada-Opper A. et al., 1977]. Данные об аминокислотном составе алкогольного гиалина свидетельствуют о значительном содержании неполярных аминокислот — лейцина, изолейцина, аланина, валина, фенилаланина [Виноградова Л. Г., 1979; Галкин А. В., 1986].
Получены доказательства антигенных свойств алкогольного гиалина. Очищенная фракция телец Мэллори оказывает сенсибилизирующее влияние на лимфоциты, ускоряет реакцию бласт-трансформации и коллагеногенез. Преобладание в воспалительном инфильтрате полиморфно-ядерных лейкоцитов при ОАГ связывают с лейкотаксическим эффектом алкогольного гиалина [Kakumu S. и Leevy С, 1977; Luisada-Opper A. et al., 1977]. Антиген алкогольного гиалина и антитела к нему циркулируют в крови, вызывая иммунокомплексное повреждение [Kanagasun-daram N. et al., 1977]. Полагают, что развитие иммунопатологических реакций на алкогольный гиалин способствует прогрес-сированию алкогольного поражения печени [Серов В. В. и со-авт., 1978; Мироджов Г. К., 1980; Kakumu S., Leevy С, 1977]. Происхождение телец Мэллори остается неясным. Большинство авторов считают, что фибриллярный алкогольный гиалин синтезируется печеночной клеткой, а не является продуктом деградации органелл. Это подтверждается тем, что фибриллы гиалина обнаруживаются в гепатоцитах без признаков деструкции органелл, часто в непосредственной близости от свободных рибосом и ГЦС [Серов В. В. и др., 1978; Виноградова Л. Г., 1979; Мансуров X. X., Мироджов Г. К., 1979].
Тельца Мэллори могут обнаруживаться не только при алкогольном гепатите, но и при болезни Вильсона — Коновалова, первичном билиарном циррозе, раке печени, индийском детском циррозе и др. [Hall P. et al., 1979]. Однако нельзя считать доказанным биохимическое и антигенное сходство выявляемых телец с алкогольным гиалином. Можно считать, что тельца Мэллори не строго специфичны для алкогольного гепатита и могут быть нормальным компонентом печеночной клетки, возможно, промежуточными филаментами [French S., Davies P.,
1975]. В связи с этим полагают, что образование алкогольного гиалина связано с нарушением рассеивания промежуточных фи-ламентов из цистерн ЗЦС [Мансуров X. X., Мироджов Г. К-, 1979J. Однако этому противоречит тот факт, что фибриллы алкогольного гиалина, как правило, не окружены мем-браной. Тельца Мэллори в отличие от промежуточных филаментов имеют иное распределение в клетке, нерегулярную структуру, иногда больший диаметр фибрилл, содержат полипептиды более высокой молекулярной массы [Denk H. et al., 1980].
Иммуногистохимически установлено, что тельца Мэллори содержат прекератиноподобные полипептиды и не являются промежуточными филаментами клетки [Denk H., 1980]. По данным Morton J. А. и соавт. (1980), антитела к белку алкогольного гиалина молекулярной массой 50 000 не реагируют с нормальными гепатоцитами, кожей и прекератином. Эти данные показали, с одной стороны, наличие у алкогольного гиалина антигенных детерминант, отсутствующих в прекератине, и, с другой, подтвердили мнение о том, что тельца Мэллори и промежуточные филаменты гепатоцита неидентичны.
Представляют интерес исследования телец Мэллори, полученных у мышей с помощью гризеофульвиновой диеты. Однако «мышиные» тельца Мэллори хотя и не отличаются по ультраструктурным свойствам от телец у человека, но биохимически в них не определяются полипептиды высокой молекулярной массы [Denk H., 1980].
5.2.1.1. Клинико-морфологические стадии
С помощью повторных биопсий печени можно выделить клинико-морфологические стадии ОАГ: начальную, разгара, стихания признаков активности, резидуальную [Серов В. В. и др., 1980]. В начальной стадии обнаруживаются некрозы групп гепатоцитов обычно в центре долек, вокруг погибающих печеночных клеток выражена реакция клеток синусоидов и полиморфно-ядерных лейкоцитов. Вне участков некроза печеночные клетки в состоянии гидропической или жировой дистрофии. Алкогольный гиалин обычно отсутствует. Нередко выявляются зерна липофусцина в цитоплазме гепатоцитов, сидероз звездчатых эндотелиоцитов, в портальной строме встречаются лишь единичные гистиолимфоцитарные элементы и полиморфно-ядерные лейкоциты. Выделение начальной стадии ОАГ важно потому, что больные в этой стадии составляют группу «риска», именно у них при продолжающемся алкоголизме в повторных био-птатах печени чаще обнаруживается картина ОАГ в стадии разгара заболевания. Клиническая диагностика начальной стадии ОАГ особенно трудна, ведущая роль в ее выявлении принадлежит биопсии печени. Пункцию печени следует производить
как можно раньше после обращения больного к врачу, так как характерные морфологические проявления ОАГ быстро исчезают после прекращения приема алкоголя. Своевременная диагностика ОАГ в начальной стадии позволяет в ряде случаев предотвратить прогрессирование заболевания.
В стадии разгара ОАГ обнаруживаются все основные морфологические признаки заболевания: центролобулярные некрозы гепатоцитов, обычно колликвационного типа; алкогольный гиалин, который при гистологическом исследовании имеет вид нежно-сетчатых масс; в инфильтрате стромы и зонах некроза преобладают полиморфно-ядерные лейкоциты. В некоторых наблюдениях ОАГ имеются морфологические особенности: образование массивных полей алкогольного гиалина, выраженный внутрипеченочный холестаз или развитие обширных зон некроза.
Ультраструктурно алкогольный гиалин в эту стадию имеет фибриллярное строение. В гепатоцитах выражен также полиморфизм митохондрий, которые нередко принимают причудливую, уродливую форму, часто выявляются их гигантские формы, кристы митохондрий укорочены, дезориентированы, в матриксе иногда определяются паракристаллические включения. Характерна гиперплазия ГЦС с очаговой вакуолизацией и фрагментацией, что рассматривается как адаптивный феномен при алкоголизме. ЗЦС и пластинчатый комплекс мало изменены. Ядра гепатоцитов мономорфны с равномерным распределением хроматина [Фрейнд Г. Г., 1979].
Анализ клинических и морфологических проявлений ОАГ в стадии разгара показывает, что многие применяемые синонимы алкогольного гепатита отражают различные варианты его течения, которые хорошо известны клиницистам. Так, ОАГ с полями алкогольного гиалина («острый склерозирующий гиалиновый некроз»), как правило, протекает с выраженной портальной гипертензией, которая может персистировать и в стадии стихания признаков активности, что связано с прогрессированием фиброза по ходу центральных вен. Некоторые авторы полагают, что такой вариант течения ОАГ является обязательным этапом при развитии цирроза печени алкогольной природы [Karasa-wa Т., Chedid A., 1976]. Острый алкогольный гепатит с обширными некрозами может иметь фульминантное течение, для которого характерно отсутствие тенденции к уменьшению уровня билирубина крови в течение 5—7 сут, лейкоцитоз более 16 000, нарастание концентрации азотистых шлаков в крови. Смерть больных обычно наступает от печеночно-почечной недостаточности. Следует помнить и о возможности протекания ОАГ с длительным холестазом, при этом нередко возникают трудности в дифференциальной диагностике заболеваний [Bertram P., 1978]. Многообразие синонимов ОАГ отражает, как видно, различные варианты его течения или этапы эволюции.
Стадия стихания признаков активности ОАГ патологами диагностируется наиболее часто. Связано это с тем, что биопсию печени проводят на первой — второй неделе пребывания больного в стационаре, когда после последнего приема алкоголя проходит 2—3 нед. При гистологическом исследовании в этой стадии на месте бывших некрозов обнаруживают так называемые узелки резорбции из макрофагов и лимфоцитов. Алкогольный гиалин приобретает вид грубых глыбчатых масс, иногда располагается в перисинусоидальных пространствах, причем реакция полиморфно-ядерных лейкоцитов на внеклеточные скопления гиалина отсутствует. Это, видимо, связано с тем, что лейкотаксические свойства гиалина утрачиваются. Вокруг полей алкогольного гиалина, обычно окружая центральные вены, нарастает фиброз — «склерозирующий гиалиновый некроз» (рис. 47, а). Степень жировой дистрофии гепатоцитов и инфильтрация портальной стромы полиморфно-ядерными лейкоцитами снижается (рис. 47,6). Для этой стадии характерно изменение ультраструктуры алкогольного гиалина: из фибриллярного он становится гранулярным (см. рис. 46,6). В стадии стихания признаков активности в центральных отделах долек выявляется большое число активных липоцитов [Фрейнд Г. Г., 1979]. Уменьшение числа полинуклеарных лейкоцитов в инфильтрате портальной стромы приводит к относительному преобладанию гис-тиолимфоцитарных элементов. Формально морфологические изменения печени подобны хроническому персистирующему гепатиту, в отличие от которого фиброз стромы в этой стадии ОАГ минимален. Большие затруднения возникают в диагностике стадии стихания признаков активности ОАГ при наличии фиброза стромы. Поэтому уточнение природы патологического процесса в таких случаях возможно только путем динамического наблюдения за больным с проведением повторных пункций печени.
Резидуальная стадия является исходом острого алкогольного гепатита. При гистологическом исследовании обнаруживаются очаговая гидропическая дистрофия гепатоцитов, единичные жировые кисты. Характерен лапчатый фиброз стромы: от портальных трактов тяжи соединительной ткани в виде лучей проникают вглубь паренхимы (рис. 48). Мелкие звездчатые рубцы обнаруживаются и внутри дольки, в строме выявляются единичные гистиолимфоцитарные элементы.
Анализ стадий течения острого алкогольного гепатита показывает, что наиболее характерные морфологические признаки заболевания выявляются в стадии разгара болезни, поэтому именно в эту стадию следует проводить диагностическую биопсию печени. Необходимо учитывать, что острый алкогольный гепатит может развиться при различных вариантах алкогольной болезни печени: стеатоза, хронического гепатита, цирроза. Однако эти фоновые изменения печени в условиях прекращения при-
125

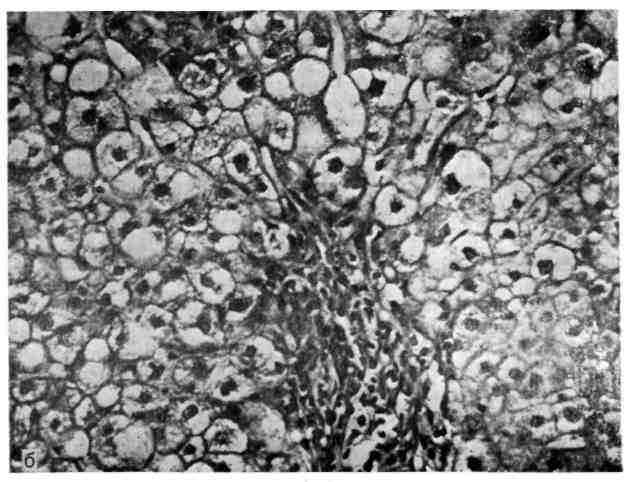
47. Острый алкогольный гепатит в стадии стихания признаков активности.
а — поля алкогольного гиалина, разрастание рыхлой соединительной ткани; б — гистиолимфоцитарный инфильтрат в портальной строме. Окраска гематоксилином и эозином. Х200.
Алкогольные заболевания печени
18. Печень в исходе острого алкогольного гепатита (резидуальная стадия). лапчатый фиброз стромы, единичные жировые кисты. Окраска гематоксилином и эози-:ом. Х200.
:ма алкоголя протекают клинически латентно и проявляют себя, сак правило, при очередных атаках острого алкогольного гепа-ита.
Анализ течения острого алкогольного гепатита показал, что [рогностически неблагоприятными морфологическими признака-ли, свидетельствующими о прогрессировании в цирроз, являются шраженный фиброз с образованием фиброзных септ и большое соличество алкогольного гиалина [Серов В. В. и др., 1980]. При шачительном некротическом компоненте заболевания имеет ме-:то фульминантное течение с быстрым летальным исходом. Осо-5енно неблагоприятными признаками являются центролобуляр-1ый и перивенулярный фиброз с облитерацией ветвей печеноч-юй вены [Bianchi L. et al., 1981].
5.2.1.2. Системные проявления
Острый алкогольный гепатит часто протекает с системными троявлениями, так как злоупотребление алкоголем приводит к [ювреждению не только печени, но и других органов и систем зрганизма. Важно учитывать, что системные проявления острого алкогольного гепатита помогают в установлении этиологии за-
болевания. Наиболее часто такими органами, которые поражаются наряду с печенью, при хроническом алкоголизме, являются слюнные железы, желудок, поджелудочная железа, сердце, почки, легкие [Лебедев С. П., 1982]. Алкогольное повреждение слюнных желез характеризуется развитием так называемого гигантского паротита. При этом выявляется гипертрофия желез, эпителий содержит большое количество слизи, воспалительная инфильтрация стромы отсутствует. Изменения в больших и малых слюнных железах идентичны. Доступность биопсии малых желез и морфологические отличия их изменений от тех, которые встречаются при синдроме Шегрена, развивающемся при вирусном гепатите, делает гистологическое исследование слюнных желез весьма информативным для установления алкогольной природы болезни.
В желудке у больных хроническим алкоголизмом развиваются различные морфологические типы хронического гастрита. Характерными морфологическими признаками являются выраженные микроциркуляторные расстройства и значительное число полиморфно-ядерных лейкоцитов после приема этанола. При электронно-микроскопическом исследовании в главных, париетальных и добавочных клетках желез выявляется аккумуляция филаментов промежуточного типа.
Повреждение поджелудочной железы нередко встречается при алкоголизме, наиболее типичен хронический кальцифици-рующий панкреатит [Мухин А. С. и соавт., 1977; Sarles H., 1979], в инициальную стадию которого поджелудочная железа может быть не изменена; иногда определяются набухание органа, жировые и геморрагические некрозы. При дальнейшем течении заболевания нарастает липоматоз, перидуктальный склероз, протоки расширяются. В финальной стадии железа уплотнена, с полями фиброзной ткани, иногда на поверхности ее видны единичные или множественные кисты, в протоках обнаруживают кальцификаты [Sarles H., 1979].
Выявляемые светооптически и электронно-микроскопически изменения поджелудочной железы более характерны. Одна из главных особенностей — неравномерность поражения, наряду с деструкцией встречаются интактные дольки. Ранние изменения в ацинарных клетках представлены гипертрофией ядер и ядрышек, уменьшением количества зимогенных гранул, расширением ЗЦС, гипертрофией пластинчатого комплекса и увеличением числа лизосом, что отражает секреторную гиперфункцию клеток. В финальной стадии развивается атрофия ацинарных клеток. В ацинарных клетках обнаруживают включения, сходные с алкогольным гиалином печеночных клеток [Kojima К., 1975]. Внутридольковые протоки расширены, в их просвете белковые пробки, которые могут содержать кальций. В области белковых преципитатов нередко находят уплощение, сосочковые разрас-
тания, метаплазию протокового эпителия. Часто встречаются, кисты и псевдокисты.
При алкогольной кардиомиопатии обнаруживается чередование полей гипертрофированных и атрофированных кардио-миоцитов. Характерно кистозное расширение цистерн саркоплаз-матического ретикулума мышечных клеток сердца, внутрикрист-ные включения в митохондриях, наличие липидов и липофусцина в саркоплазме.
В биоптатах почек, которые часто вовлекаются в патологический процесс при хроническом алкоголизме, находят картину иммунокомплексного нефрита, некронефроза, пиелонефрита. Частота выявления иммунокомплексного гломерулонефрита, в генезе которого может играть роль антиген алкогольного гиа-яина, у больных алкоголизмом выше по сравнению с группой зольных вирусными заболеваниями печени [Николаев А. Ю., 1978J.
Заболевания легких у больных алкоголизмом имеют тенденцию к затяжному клиническому течению. Выявляются деструктивный панбронхит, поля абсцедирования и карнификации. Весьма характерны макрофаги, цитоплазма которых загружена филаментами промежуточного типа (рис. 49) [Серов В. В. и др., 1982].
