
- •Содержание
- •1. Теоретические основы
- •1.1 Понятие о теплоемкости
- •1.2 Теплоемкость идеального газа
- •1.3 Зависимость теплоемкости от температуры
- •1.5 Отношение теплоемкостей
- •2. Описание лабораторного стенда
- •2.1 Установка
- •2.2 Блок сопряжения
- •2.3 Программная часть
- •2.3.1 Файлы программы
- •2.3.2 Работа с программой
- •3. Порядок выполнения работы
- •4. Расчетные формулы
- •5. Расчёт лабораторной работы
- •6. Вывод
РЫБИНСКАЯ ГОСУДАРСТВЕННАЯ АВИАЦИОННАЯ ТЕХНОЛОГИЧЕСКАЯ АКАДЕМИЯ
Имени П.А. Соловьёва
Кафедра «АВИАЦИОННЫЕ ДВИГАТЕЛИ»
Лаборатория «ТЕРМОДИНАМИКА И ТЕПЛОПЕРЕДАЧА»
ЛАБОРАТОРНАЯ РАБОТА
«ОПРЕДЕЛЕНИЕ ТЕПЛОЕМКОСТИ ВОЗДУХА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ»
РЫБИНСК, 2009 г.
Содержание
ВВЕДЕНИЕ 3
Газ 13
2.1 Установка 16
2.2 Блок сопряжения 17
2.3 Программная часть 18
2.3.1 Файлы программы 18
2.3.2 Работа с программой 18
ВВЕДЕНИЕ
Цель работы – определение методом калориметрирования теплоемкости воздуха при постоянном давлении.
Прежде чем приступить к работе, необходимо усвоить элементарные вопросы теории теплоемкости.
В процессе выполнения работы требуется определить из эксперимента изобарную теплоемкость воздуха и составить по проделанной работе отчет.
1. Теоретические основы
1.1 Понятие о теплоемкости
Теплоемкостью тела (системы тел) называется отношение количества теплоты, поглощенной телом в определенном термодинамическом процессе, к изменению его температуры
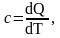 (1)
(1)
где dQ – элементарное количество теплоты;
dT – элементарное изменение температуры.
В зависимости от количественной единицы тела, к которому подводится теплота, различают:
- массовую теплоемкость – с, [Дж/кг К];
-
мольную теплоемкость –
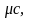 [Дж/ моль К];
[Дж/ моль К];
- объемную теплоемкость – С, [Дж/м3 К].
Соотношение
между этими теплоемкостями можно
получить следующим образом. Один моль
газа имеет массу
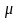 кг, следовательно, массовая теплоемкость
определяется из мольной теплоёмкости
делением ее на молекулярную массу
кг, следовательно, массовая теплоемкость
определяется из мольной теплоёмкости
делением ее на молекулярную массу
 .
(2)
.
(2)
Один
моль любого газа при нормальных условиях
имеет объем 22,4
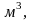 поэтому объемная теплоемкость равна
поэтому объемная теплоемкость равна
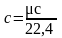 (3)
(3)
Используя (3) и связь плотности, молекулярной массы и объем 1 моля газа при нормальных условиях получим
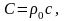 (4)
(4)
отсюда
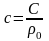 ,
(5)
,
(5)
где
 .
.
Так как теплота, подводимая в процессе к телу (системе), зависит от вида процесса, то теплоемкость будет свойством системы только тогда, когда процесс будет фиксированным, т.е. будет происходить при постоянном значении каких – либо параметров системы
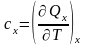 ,
(6)
,
(6)
(индекс
«x»
при частной производной означает, что
процесс идет при одном постоянном
значении величины
 ).
).
Следует
отметить, что рассматриваемые процессы
теплообмена являются квазистатическими,
потому теплоемкость будет величиной,
относящейся к телу в состоянии
термодинамического равновесия, и
теплоемкости являются функциями
параметров тела (системы),
т.е.

Уравнение (6) определяет так называемые истинные теплоемкости, которые в термомеханической системе будут функциями термических параметров.
Так,
теплоемкость в процессе при постоянном
объеме
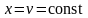 согласно уравнению (6) равна
согласно уравнению (6) равна
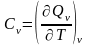 ,
(7)
,
(7)
а теплоемкость в процессе, идущем при постоянном давлении x=p=const, равна
 .
(8)
.
(8)
Разность
между теплоемкостями
 и
и
 идеального газа устанавливается формулой
Майера, известной из физики и имеющей
вид
идеального газа устанавливается формулой
Майера, известной из физики и имеющей
вид
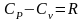 .
(9)
.
(9)
Эта формула является следствием первого закона термодинамики.
Кроме
истинных теплоемкостей в расчетах
употребляют средние
теплоёмкости
 ,
равные отношению количества теплоты,
выделившейся или поглощенной в процессе
,
равные отношению количества теплоты,
выделившейся или поглощенной в процессе
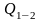 ,
к изменению температуры
,
к изменению температуры
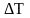 при условии, что разность температур –
величина конечная
при условии, что разность температур –
величина конечная
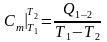 .
(10)
.
(10)
Естественно, что истинная теплоемкость
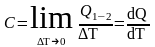 .
(11)
.
(11)
