
- •4 Физико-химические основыпроцессов переработки сырьевых материалов
- •2.1. Характеристика чистоты вещества
- •6. Общая характеристика процессов разделения и очистки
- •7. Сорбционные процессы
- •7. Экстракционные процессы
- •8. Процессы перегонки через газовую фазу
- •9. Ректификация.
- •11 Кристаллизационная очистка
- •2.6.1. Принцип очистки
- •12. Эффективный и равновесный коэффициенты распределения
- •13 Распределение примеси по длине кристалла, полученного нормальной направленной кристаллизацией
- •14. Распределение примеси по длине кристалла, полученного зонной плавкой
- •15. Многократная зонная плавка
11 Кристаллизационная очистка
2.6.1. Принцип очистки
Кристаллизационные методы очистки основаны на различии в растворимости примеси в твердой и жидкой фазах. Они используются на конечной стадии очистки вещества. Одновременно с высокой степенью чистоты может быть достигнуто совершенство кристаллической структуры (физическая чистота), когда материал может быть получен в виде монокристалла. Так как кристаллизационные методы используются на конечной стадии очистки, то содержание остаточных примесей мало, поэтому многокомпонентную систему можно заменить бинарной системой: основной компонент – примесь. В области малых концентраций примеси, примыкающей к точке плавления чистого компонента, различие между разными типами диаграмм исчезает, поэтому диаграмму можно свести к двум отрезкам, касательным к линиям ликвидуса и солидуса в точке плавления основного компонента (рис. 2.7). Эти отрезки направлены вниз, если примесь понижает температуру плавления твердого раствора, и вверх, если она ее повышает.
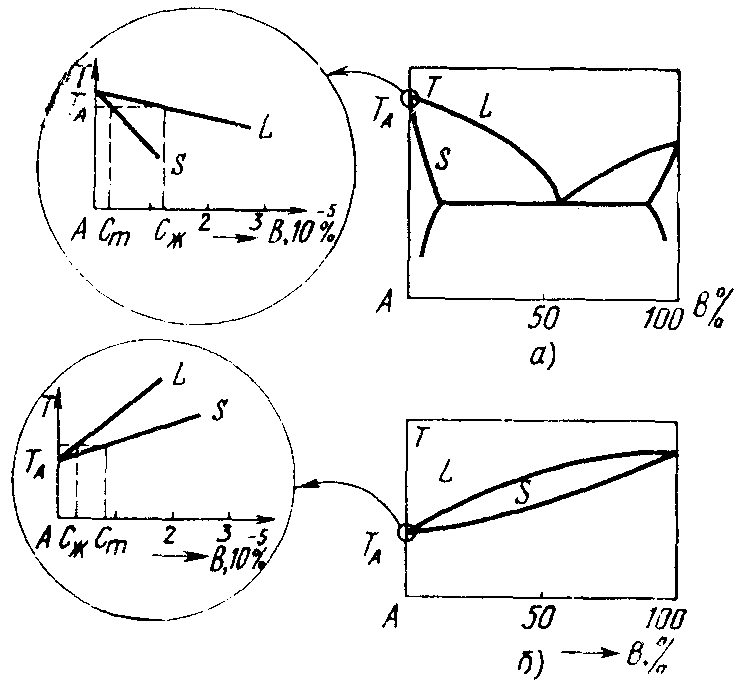
Рис. 2.7. Влияние примеси на температуру плавления
Рассмотрим расплав компонента А с примесью В с концентрацией С0 при температуре Т0 (рис. 2.8). Состояние расплава характеризуется фигуративной точкой 1.
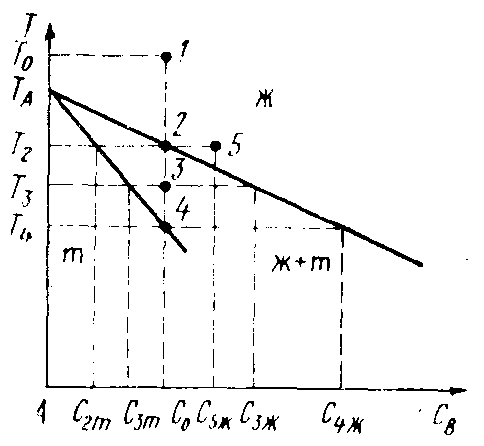
Рис. 2.8. Распределение примеси между жидкой и твердой
фазами при кристаллизации раствора В компонента в А
При снижении температуры начинается кристаллизация (точка 2), образуется твердый раствор состава СТ2. При понижении температуры состав твердого раствора изменяется по линии солидуса, жидкого раствора – по линии ликвидуса. При достижении температуры, соответствующей точке 4, жидкая фаза исчезает, кристаллизация заканчивается, а состав твердого раствора должен совпадать с исходным составом жидкого расплава С0. Таким образом, закристаллизовавшийся слиток должен иметь исходный состав С0. Однако в реальных условиях наблюдается неоднородность состава выращенного кристалла. Все предыдущие рассуждения справедливы в условиях фазового равновесия в системе. То есть кристаллизация должна проводиться бесконечно медленно. В реальных процессах температура непрерывно изменяется. Равновесие в системе устанавливается путем диффузии компонентов в твердой и жидкой фазах. Коэффициент диффузии в жидкой фазе на много порядков больше, чем в твердой (для Zn в Ge при 800 єС коэффициент диффузии 2·10–17 м2/с, в жидком Ge коэффициенты диффузии примесей 10–9 м2/с). Поэтому скорость установления равновесия в расплаве намного больше, чем в кристалле. Если пренебречь диффузией в твердой фазе, то состав кристаллизующихся слоев будет изменяться по солидусу, обогащаясь компонентом В. Выращенный кристалл представляет гамму твердых растворов с меняющимися концентрациями. Это явление называется сегрегацией, а нарушения постоянства состава называются сегрегационными. Причинами их возникновения являются: разница составов твердой и жидкой фаз, находящихся в равновесии, и замедленность диффузии в твердой фазе.
Если затруднена диффузия в жидкой фазе, то на фронте кристаллизации будет избыток компонента В (примеси). Кристаллизация будет идти из прилегающего к фронту кристаллизации слоя, обогащенного примесью, это приведет к снижению эффекта очистки (на рис. 2.8 состав жидкой фазы будет соответствовать точке 5 вместо точки 2).
Степень очистки можно повысить в несколько раз, если выращивать монокристалл (в поликристалле на межзеренных границах при росте концентрируется примесь).
