
- •1 Основные положения молекулярно-кинетической теории газов.
- •2 Основные типы кристаллических решеток. Изоморфизм, полиморфизм
- •4 Особенности металлической кристаллической решетки.
- •5 Особенности строение твёрдого тела
- •6 Кристаллизация металлов и сплавов
- •7 Поверхностная энергия
- •8 Особенности жидких металлов. Особенности жидких сплавов
- •9 Изотермы реальных газов
- •10 Особенности реальных газов. Уравнение Ван-дер-Ваальса
- •11 Способы выражения состава газовых смесей. Закон Дальтона. Плотность и средняя малярная масса смеси.
- •12 Уравнение состояния идеального газа.
- •13 Основное уравнение мкт и следствие из него
σ = w/s = Дж/м2 = Н . м/м2 = Н/м (1.28)
Выражение (1.28) показывает, что коэффициент поверхностного натяжения равен силе, необходимой и достаточной для предотвращения сокращения длины полосы поверхности жидкости шириной в 1 м.
σ = F/l (1.28а)
где F - приложенная сила; l - ширина полосы поверхности испытуемой жидкости.
По-видимому, именно по этой причине рассматриваемое свойство жидкости назвали поверхностным натяжением, что подчеркивает стремление жидкости к сокращению площади поверхности. Это свойство жидкости объясняется особенностью поверхностной энергии, о которой будет подробнее сказано во П разделе. Благодаря этому свойству капли жидкости имеют сферическую форму, мыльная пленка обтягивает проволочный каркас самым экономичным образом и т.п.
Силы взаимодействия между молекулами различных жидкостей близки, поэтому поверхностное натяжение на границе их соприкосновения невелико.
В соответствии с правилом Антонова оно равно:
разности поверхностных натяжений их взаимно насыщенных растворов на границе со своим паром –
σА/В = σА – σВ
Межмолекулярное взаимодействие играет определенную роль и в явлении смачивания. Прежде чем обсудить этот вопрос, остановимся на понятиях когезии и адгезии. Когезия характеризует взаимное притяжение частиц тела, обусловленное силами межмолекулярного взаимодействия, действующими внутри него. Наиболее сильна когезия в твердых телах и жидкостях и очень незначительна в газах. Она определяет прочность тел и другие подобные физико- механические свойства.
Адгезия характеризует взаимное притяжение частиц различных тел в области их соприкосновения (на поверхности раздела), обусловленное силами межмолекулярного взаимодействия между этими телами. Адгезией объясняется слипание различных тел , а также и смачивание.
Когда силы адгезии велики и приближаются к силам когезии, тела слипаются: жидкость растекается по поверхности твердого тела или другой жидкости тонким слоем - происходит полное смачивание.
Угол θ (рис.1.8), образуемый поверхностью смачиваемого тела и плоскостью, касательной к поверхности капли в точке, расположенной на линии их соприкосновения, называется краевым углом смачивания.
При полном смачивании он острый и приближается к нулю, а при полном несмачивании он тупой и стремится к 180°. В промежуточных ситуациях его значение лежит между 0 и 180° ( 0°< θ <180°), т.е. зависит от степени смачивания. По этой причине английский физик Т. Юнг в 1805г. предложил использовать его в качества меры смачивания. При равновесном смачивании угол θ связан с поверхностными натяжениями жидкости σж, смачиваемого тела σт, а также поверхностным натяжением, действующим на границе между ними σж,т , уравнением Юнга:
сos θ=(σт-σт,ж)/σж=В
Число В = cos θ называют критерием смачивания. Его значение заключено в пределах от1до -1(1>В>-1). При В > 0 жидкость смачивает поверхность и тело называют лиофильным («любящим жидкость» ). В случае В< 0 жидкость не смачивает поверхность и тело называют л и о ф о б н ы м ( «боящимся жидкости» ). По отношению к воде такие тела в первом случае называются гидрофильными ( смачиваются водой), а во втором - гидрофобными (не смачиваются водой). Замечено, что поверхность тела смачивают только те жидкости, которые понижают поверхностное натяжение данного тела на границе его с воздухом.
Предельным (максимальным ) случаем смачивания является растекание. Как правило, оно происходит в результате взаимодействия (соприкосновения ) тел, строение молекул которых похоже. Например, на поверхности воды ( тело с полярными молекулами) растекаются органические кислоты, растворы их солей, высшие спирты и другие вещества с полярными молекулами. Растекание возможно и при контакте двух взаимно нерастворимых тел ( жидкостей), обладающих значительным различием поверхностных натяжений ( σт>>σж) и достаточно большими силами адгезии, обуславливающими достаточно малое значение поверхностного натяжения на границе между жидкостью и смачиваемым телом (σт,ж). Условием и количественной характеристикой растекания служит критерий Гаркинса:
S=σт-(σж+σт,ж)>0
Из критерия Гаркинса следует, что растекание как и смачивание, - явление одностороннее: если тело Ж растекается по поверхности тела Т, то обратное явление произойти не может, т.е. тело Т не может растекаться по поверхности тела Ж, более того, оно не смачивает тело Ж, а стремится принять на его поверхности сферическую форму. Например, нефть растекается по поверхности воды, вода же на ее поверхности собирается в «шарики».
Для измерения коэффициентов поверхностного натяжения служит главным образом уравнение (1.28а). Наибольшую известность получили следующие способы: измерение веса отрывающейся капли; измерение силы, необходимой для отрыва тела от поверхности жидкости; измерение давления, необходимого для продавливания через капилляр пузырька газа или жидкости в испытуемую жидкость; измерение высоты капиллярного поднятия жидкости и другие. Описания указанных методов измерения коэффициента поверхностного натяжения приводятся в специальных руководствах.
Экспериментально установлено, что коэффициент поверхностного натяжения чистых жидкостей уменьшается при повышении температуры и с приближением последней к критической температуре рассматриваемого вещества стремится к 0.
Присутствие примесей также влияет на коэффициент поверхностного натяжения жидкостей:
- вещества, присутствие которых в жидкости приводит к уменьшению ее коэффициента поверхностного натяжения, называются поверхностно - активными веществами (ПАВ);
- вещества, присутствие которых в жидкости приводит к увеличению ее коэффициента поверхностного натяжения, называются поверхностно - неактивными веществами (ПНАВ).
Примеры ПАВ для воды: мыла, белки, спирты, аминокислоты и другие, а минеральные кислоты, многие сульфаты, карбонаты и другие соли для воды являются ПНАВ.
Судя по уравнениям Юнга и Гаркинса, для повышения смачивания необходимо, чтобы ПАВ уменьшали поверхностное натяжение только одного из соприкасающихся тел (например, тела Ж) и, по возможности, увеличивали поверхностное натяжение другого из них. Это значит, что ПАВ относительно первого тела должно быть ПНАВ по отношению ко второму из соприкасающихся тел, т.е. - избирательным.
8 Особенности жидких металлов. Особенности жидких сплавов
Что же происходит с металлом, когда его температура приближается к точке плавления? Если нагреть при постоянном давлении, то наблюдается явление теплового расширения - кусок металла увеличивается в объеме. Переход из твердого состояния в жидкое резко меняет большинство свойств: пластичность, объем, нарушается структура. Пока весь металл не расплавится, температура остается неизменной. Теплота плавления тратится на разобщение атомов и перестройку их в более свободную структуру. Объем большинства металлов при плавлении увеличивается примерно на 3 - 4 %. Структура из плотнейшей упаковки переходит в менее плотную. Относительно небольшое увеличение объема означает, что и в жидком состоянии при температурах, близких к точке плавления, имеются построения с плотной упаковкой. Вблизи точки плавления атом окружен таким же количеством соседей, что и в твердом кристалле. Нарушен лишь дальнейший порядок, но в области ближнего порядка применительно к соседним соотношения в положении атомов сохраняются. Если в кристаллах, таких, например, как у Bi и Ga имелась не плотнейшая упаковка, то объем металла при плавлении уменьшается, как у воды, для которой известно, что лед (твердое состояние) имеет больший объем, чем жидкая вода. Жидкие металлы отличаются большими величинами поверхностного натяжения.
Сплавы — это металлообразные макроскопически однородные вещества, обладающие металлическими свойствами и состоящие из двух или более компонентов.
Образование новой структуры происходит при охлаждении и кристаллизации металлических расплавов в некотором интервале температур. Основой сплавооб-разования является металлическая связь и способность металлов перестраивать свои кристаллические решетки. Природа образовавшейся структуры может быть различной в зависимости от отношения составляющих ее атомов. Они могут не взаимодействовать, притягиваться друг к другу, взаимно отталкиваться.
1. Разупорядоченные твердые растворы (не взаимодействуют, распределяются статистически равномерно).
2. Смеси (атомы различных компонентов притягиваются слабее чем подобные, стремятся обособиться, появляются отдельные мелкие кристаллы разного типа, связанные между собой только общими границами зерен).
3. Если атомы различных металлов притягиваются друг к другу сильнее чем однородные, то каждый из них стремится окружить себя атомами другого. Образуется строение упорядоченного твердого раствора. Возникает т.н. сверхструктура. Могут возникнуть интерметаллические соединения. В предельном случае - с С, S, О, С1 - образуются чисто химические соединения.
9 Изотермы реальных газов
При достаточно высоких давлениях и низких температурах расстояние между молекулами уменьшается, а силы межмолекулярного взаимодействия увеличиваются настолько , что вещество из газообразного состояния может перейти в жидкое. При сжижении газов низкие температуры получаются за счёт расширения предварительно сжатых компрессоров газа. При разрежении газа на преодолении сил межмолекулярного взаимодействия должна быть затрачена тепловая энергия, вследствие чего окружающее газ пространство охлаждается. Подобным многократным повторением сжатия и расширения газов можно получить достаточно низкие температуры, необходимые для их сжижения. На этом основано получение низких температур и сжиженных газов.
В 1823г. Фарадей, применяя низкие температуры и высокие давления, осуществил сжижение CO2 , NH3 , CL2 . Но некоторые газы ( водород, азот , кислород) ему не удалось перевести в жидкое состояние даже при очень низких температурах и самых высоких давлениях, достигаемых в то время.
Теория сжижения газов была разработана Менделеевым в 1860г.
Для каждого газа существует предельная температура, выше которой газ не может быть превращён в жидкость ни при каком давлении. Такая температура называется критической.
Чем температура ниже критической, тем меньшее давление надо применить для сжижения газов. При критической температуре для сжижения необходимо наибольшее, так называемое критическое давление.
Объём моля газа при критических температуре и давлении называется критическим объёмом.
Состояние газа, находящегося при критической температуре и под критическим давлением и занимающего критический объём, называется критическим состоянием.
Например, для CO2 : Tкр = +31,30C ; Pкр = 72,9 атм.;Vкр = 0.096л.
Следовательно, CO2 переходит в жидкое состояние при этих температурах и давлении. Если же температура выше критической, то CO2 ни при каких давлениях не перейдёт в жидкость.
Переход газа в жидкость можно показать графически - с помощью изотерм. Изотермы реальных газов отличаются от таковых идеальных газов. Рассмотрим на примере CO2. Изотермы идеальных газов, как известно ,имеют форму симметричной гиперболы, а изотермы реальных – значительно деформированы.

Рассмотрим изотермы при 100С. На ней можно отметить три участка: АВ, ВС, СД. Здесь только участок АВ соответствует газовому состоянию, подчиняющемуся закону Бойля-Мариотта, т.е V уменьшается обратно пропорционально P.
Участок ВС показывает резкое уменьшение V при постоянном P. Это характерно для перехода газа в жидкое состояние. Участок же СД не показывает заметного уменьшения V с повышением P. Следовательно, газ не сжимается, несмотря на значительное увеличение Р. Такое свойство характерно уже не для газообразного, а для жидкого состояния. При более высоких температурах горизонтальные части изотерм, соответствующие участку ВС, постепенно уменьшаются и, наконец, при 31,30С превращаются в точку перегиба К. Эта точка и называется критической. Ей соответствует Р=72,9 атм., Т=31,30, V=0,096л. Выше температуры 31,30С СО2 не удается превратить в жидкость ни при каких давлениях , а изотермы при дальнейшем повышении температуры по виду всё более приближаются к изотермам идеального газа.

Если соединить между собой точки, характеризующие начало кипения жидкости при различных температурах ( давлениях ),то на диаграмме получится кривая АК, называемая нижней пограничной кривой. Если соединить между собой точки, характеризующие окончание кипения или начало конденсации при различных температурах ( давления ), то на диаграмме получится кривая ВК, называемая верхней пограничной кривой.
Область расположения на диаграмме левее нижней пограничной кривой, характеризует жидкое состояние вещества. Область , расположенная на диаграмме правее верхней пограничной кривой , характеризует газообразное состояние вещества. Область, расположенная на диаграмме между пограничными кривыми, характеризует состояние жидкости ,кипящей в равновесии с собственным паром. Процесс конденсации внешне отличается от процесса испарения и проходит через стадию образования так называемого влажного пара ( о влажном паре подробно будет сказано в лекции 14).
10 Особенности реальных газов. Уравнение Ван-дер-Ваальса
Практика показывает, что приведенные ранее газовые законы не всегда могут быть использованы, т.к обычные газы значительно отличаются по свойствам от идеальных.
Согласно закону Бойля-Мариотта, при T= const произведение PVm должно оставаться постоянным и при 00С равным 2271,1 Дж/моль. Однако, например, для Н2 это произведение при давлении 1000 атм. равно 3887,84; 100 атм.- 2417,61; 0,1 атм.- 2270,69.
Таким образом , лишь при низких давлениях ( Р< 106 Па ) значение PVm близки к теоретическим, реальные газы практически подчиняются законам идеального газа.
Повышение температуры расширяет область применения уравнения состояния идеального газа ,распространяя его действие и на более высокие давления. Из этого следует, что законы идеального газа могут быть использованы для обычных газов лишь при низких давлениях и высоких температурах.
Отклонение свойств реальных газов от свойств идеального газа объясняеться следующими основными причинами:
1. Наличие собственного объёма у молекул обычного газа, чего нет у частиц идеального газа.
2. Ассиметричностью молекул обычного газа (у идеального газа частицы приняты сферическими )
3. Взаимным притяжением молекул обычного газа (электростатическое и др. виды взаимодействия ), что также отсутствует у реальных газов.
4. Непостоянство состава молекул реального газа и др. причины.
Из п.4 следует, что молекулы многих веществ в зависимости от внешних условий могут диссоциировать или ассоциировать. Например, диоксид азота при температурах и высоких давлениях диссоциирует по схеме :
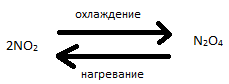
(при 640С приблизительно половина N2O4 находиться в виде NO2, при более высоких температурах содержание NO2 ещё больше увеличивается).
Или:

4.2 Для описания свойств обычных газов часто используют уравнение состояния, предложенное в 1873г. голландским учёным Ван-дер-Ваальсом
( P+ a/V2m) (Vm - b)= RT
(или уравнение состояния реального газа).
Уравнение Ван-дер-Ваальса выведено с использованием уравнения состояния идеального газа с учётом собственного объёма молекул и сил их взаимного притяжения в реальных газах.
Силу взаимного притяжения молекул 1моль вещества называют внутренним давлением. Она "стягивает" частицы, что эквивалентно действию давления ( такое же по результату действия); поэтому-то в уравнении Ван-дер-Ваальса её прибавляют к давлению газа (сила взаимных столкновении молекул вещества увеличивается за счёт их притяжения). Внутреннее давление газа обратно пропорционально квадрату занимаемого им объёма, что в уравнении Ван-дер-Ваальса выражается в виде отношения a/V2m, где
а-постоянная ,свойственная данному веществу, а Vm - молярный объём газа.
Постоянная b характеризует собственный объём молекул 1моль вещества. Занимая часть пространства, в котором находится газ, молекулы уменьшают объём пространства ,в котором они могли бы беспрепятственно перемещаться; это и отражается в уравнении Ван-дер-Ваальса вычитанием из объёма, занимаемого газом, собственного объёма молекул.
Постоянные a и b называются к о н с т а н т а м и Ван-дер-Ваальса.
Уравнение Ван-дер-Ваальса учитывает далеко не все причины отклонения свойств реальных газов от идеального газа, поэтому его применение ограничено и распространяется лишь на вещества с постоянным составом молекул.
11 Способы выражения состава газовых смесей. Закон Дальтона. Плотность и средняя малярная масса смеси.
На практике индивидуальные газы применяют редко, а имеют дело с их смесями. Отличительная особенность смесей газов состоит в том, что для их описания, кроме обычных физических свойств (Р,Т) используют еще одно свойство – состав.
Состав газовой смеси можно охарактеризовать объемной, массовой и молярной долями ее компонентов.
ОБЪЕМНАЯ
доля
 i
компонента i
в смеси – это отношение его объема Vi
к общему объему смеси Vсмеси.
i
=
i
компонента i
в смеси – это отношение его объема Vi
к общему объему смеси Vсмеси.
i
=
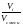 (1.17)
(1.17)
МАССОВАЯ
доля
 gi
компонента i
в смеси – это отношение его массы mi
к общеq
массе смеси mсмеси.
gi
=
gi
компонента i
в смеси – это отношение его массы mi
к общеq
массе смеси mсмеси.
gi
=
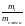 (1.18)
(1.18)
МОЛЯРНАЯ
доля
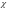 i
компонента i
в смеси – это отношение его числа молей
ni
к общему числу молей смеси n
смеси.
i
=
i
компонента i
в смеси – это отношение его числа молей
ni
к общему числу молей смеси n
смеси.
i
=
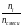 (1.19)
(1.19)
Согласно закону Авогадро, молярные доли компонентов газовой смеси равны их объемным долям, т. е. для любой газовой смеси

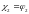
В химико-технологической практике состав газовой смеси часто характеризуется молярной или массовой концентрацией ее компонентов.
Молярная концентрация Сi компонента I – это отношение его химического количества n i к объему смеси Vсмеси
Сi
= (1.20)
(1.20)
Массовая концентрация ρ i компонента i – это отношение его массы mi к объему смеси Vсмеси.
ρi
=
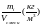 (1.21)
(1.21)
Закон Дальтона.
В 1801-1803 г.г. англичанин Дж. Дальтон (1784-1844), исходя из опытных данных, пришел к заключению, что:
Если смесь состоит из газов, не вступающих между собой во взаимодействие, то каждый компонент смеси ведет себя так, как будто он один занимает весь объем, занимаемый смесью.
Закон Дальтона полностью соответствует кинетической теории идеального газа. Действительно, если взаимодействия нет, то поведение каждой частицы не зависит от наличия других частиц, и, следовательно, поведение совокупности частиц одной природы не зависит от наличия совокупности частиц другой природы.
Допустим, что смесь газов состоит из k компонентов. Общее число моль в этой смеси, очевидно, равно сумме чисел моль компонентов, составляющих эту смесь.
nСМЕСИ = n1 + n2 + …+ n k
I.
Умножим это равенство на
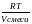 ,
где Т и VСМЕСИ
– температура и объем рассматриваемой
смеси:
,
где Т и VСМЕСИ
– температура и объем рассматриваемой
смеси:
nСМЕСИ۰ = n1۰ + n2 ۰ + …+ nk ۰
Но согласно (1.16в): nСМЕСИ۰ = РСМЕСИ; n1۰ = Р1;
n2 ۰ = Р2, где Р1, Р2 и т. д. равны тем давлениям, которые создавали бы компоненты 1, 2 и т. д., занимая объем Vсмеси при Т.
Эти давления называются ПАРЦИАЛЬНЫМИ давлениями компонентов газовой смеси.
Р1 + Р2 + … +Рk (1.22)
Иными словами, давление газовой смеси равно сумме парциальных давлений составляющих ее компонентов.
Если умножить приведенное исходное равенство на
 ,
то после преобразований получим:
,
то после преобразований получим:
VСМЕСИ = V1 + V2 + …+ V k (1.23)
где V1 V2 и т. д. равны тем объемам, которые занимали бы компоненты 1, 2 и т. д., находясь при тех же условиях, что и смесь.
Эти объемы называются ПАРЦИАЛЬНЫМИ объемами компонентов газовой смеси. Согласно (1.23), сумма парциальных объемов компонентов газовой смеси равна объему этой смеси Vсмеси.
Разделим почленно выражение Рi = ni۰ на выражение
РСМЕСИ = nСМЕСИ ۰ (эти выражения рассматривались при выводе уравнения (1.22) В результате получаем:
Pi
/ Pсмеси
=
ni
/n
смеси
= (1.19)
Но χi
=
I
, следовательно, Pi
/ Pсмеси
= Vi
/ Vсмеси
=
(1.17)
(1.19)
Но χi
=
I
, следовательно, Pi
/ Pсмеси
= Vi
/ Vсмеси
=
(1.17)
Из этого следует, что Рi = Рсмеси۰ (1.24)
т. е. парциальное давление компонента газовой смеси равно произведению общего давления смеси на молярную долю данного компонента.
Аналогичное можно сказать и относительно парциального объема компонента: Vi = Vсмеси۰ (1.25)
Из закона Дальтона вытекает еще одно следствие, имеющее важное значение – ПРАВИЛО СМЕШЕНИЯ:
Свойство газовой смеси равно сумме произведений соответствующих свойств ее компонентов на их молярные доли в рассматриваемой смеси
А
= а1 1+
а2
2+
… + аk
k
(1.26)
1+
а2
2+
… + аk
k
(1.26)
где А – свойство газовой смеси, а1, а2 и т. д. – соответствующие свойства компонентов 1,2 … (плотность, теплопроводность и другие свойства).
Для доказательства последнего следствия рассмотрим некоторую массу газовой смеси mСМЕСИ, состоящую из k компонентов, массы которых равны m1, m2, …, m k. Очевидно, что: mСМЕСИ = m1+ m2+ …+ m k. Поскольку m = ρV, то ρСМЕСИ VСМЕСИ = ρ1 V1 + ρ2 V2 + ρk Vk,
где V1, V2, …, Vk – исходные объемы компонентов, взятых для составления данной смеси;
ρ1, ρ2, …ρk – плотности компонентов при тех же внешних условиях, при которых находится газовая смесь. Разделив полученное равенство на VСМЕСИ и воспользовавшись (1.25), окончательно получаем:
ρСМЕСИ = ρ1 χ1 + ρ2 χ2 + … + ρk χk (1.26а)
то есть плотность газовой смеси равна сумме произведений плотностей его компонентов на их молярные доли в этой газовой смеси.
Если в последнем выражении плотности заменить равноценными выражениями, полученными из (1.16б), то:


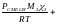 …+
…+
Сократив
это уравнение на
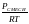 ,
получим еще одно выражение для правила
смешения
,
получим еще одно выражение для правила
смешения
МСМЕСИ = М1χ1 + М2χ2 + Мkχk (1.26б)
то есть средняя молярная масса газовой смеси равна сумме произведений молярных масс ее компонентов на их молярные доли.
12 Уравнение состояния идеального газа.
Между давлением, температурой и объемом газа существует зависимость, которая подчиняется основному уравнению состояния идеального газа. Для его вывода возьмем 1 моль идеального газа при нормальных условиях (Р0, Т0 и V0) и нагреем его до температуры Т при постоянном давлении Р0. Объем газа при этом изменится и станет равным VT. Согласно закону Гей – Люссака
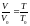 ,
откуда V=
,
откуда V=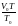 (1.12)
(1.12)
Если при постоянной температуре Т изменить давление до некоторого значения Р, объем газа при этом также изменится и станет равным V. По закону Бойля – Мариотта PV = P0VT
Подставив значение VT в уравнение (1.12), получим:
РV=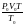 ,
,
откуда
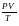 =
=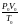 ,
(1.13)
,
(1.13)
где Р0, V0, Т0 – величины постоянные; следовательно, отношение есть также величина постоянная. Ее обозначают буквой R и называют универсальной газовой постоянной.
Подставив в уравнение (1.13) вместо постоянную R, получим:
= R или PV = RT (1.14)
Рассмотрим физический смысл универсальной (молярной) газовой постоянной.
Если давление газа измеряется в паскалях (Па), объем – в метрах кубических (м3), а температура – в градусах Кельвина (К), то R=8,3144 Дж/(моль۰К). Отсюда следует, что молярная газовая постоянная R – это работа, равная 8,3144 Дж, совершаемая 1 моль идеального газа при его расширении в результате повышения температуры на 1К.
При произвольном изменении температуры 1 моль идеального газа на ∆Т К работа расширения W, совершаемая им, равна:
W = R∆Т = ∆(PVm) (1.15)
Для
произвольного количества идеального
газа уравнение состояния имеет вид: PV
=
 ۰RT
или PV
= nRT,
(1.16)
۰RT
или PV
= nRT,
(1.16)
где – m – масса, М – молярная масса, n – число моль.
Выражение (1.16) позволяет экспериментально определить молярные массы легколетучих веществ (метод Майера).
М
=
 (1.16а),
(1.16а),
а также рассчитывать плотности газов (ρ) при условиях, близких к нормальным:
ρ
=
 =
=
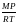 (1.16б)
(1.16б)
Решая (1.16) относительно давления, получим
Р
=
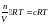 (1.16в)
(1.16в)
где с – молярная концентрация рассматриваемого газа.
Уравнение (1.16) называют, как известно, уравнением Клапейрона-Менделеева. Им пользуются в расчетах различных величин, характеризующих газ или его состояние: давление, температуру, массу, молярную массу.
13 Основное уравнение мкт и следствие из него
Допустим, что в кубе (рис.1.1) с длиной ребра l (эль) заключено N частиц идеального газа с Т=соnst. Согласно п.3. приведенных ранее положений в направлении каждой координатной оси движется N/3 частиц со средней квадратичной скоростью (среднее квадратичное значение величины представляет собой результат двойного усреднения). В рассматриваемом случае вначале определяют средние скорости каждой из N частиц в отдельности. Затем находят среднее значение этой средней энергии в расчете на одну из N частиц (среднее арифметическое из первых результатов).
Среднее количество движения одной частицы (импульс) с массой m согласно п.2 основных положений равно mu, а изменение количества движения ее в результате столкновения с гранью куба равно
m - (- m
)=2
m
- (- m
)=2
m
Для повторного
столкновения с этой гранью частица
должна пройти расстояние, равное 2l
(два эль), на что требуется время
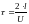 .
.
Изменение
количества движения тела (изменение
импульса) согласно второму закону
Ньютона равно импульсу силы, действующей
на тело, т.е. 2mu
=f ,
где – f
– сила, с которой грань куба воздействует
на частицу;
-продолжительность периода, на который
приходится одно столкновение, равная
времени пробега частицы до противоположной
грани и обратно.
,
где – f
– сила, с которой грань куба воздействует
на частицу;
-продолжительность периода, на который
приходится одно столкновение, равная
времени пробега частицы до противоположной
грани и обратно.
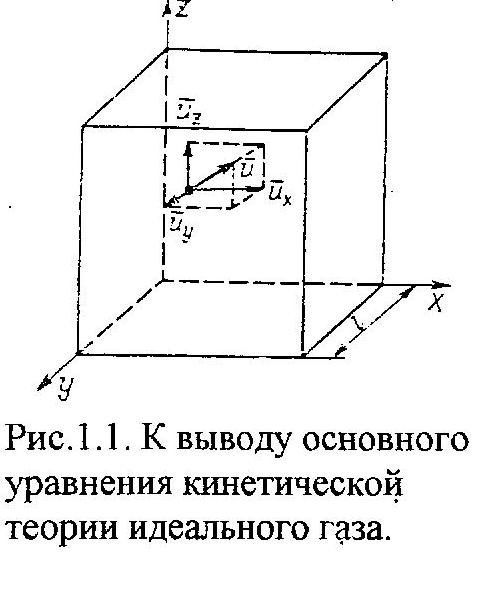
Отсюда,
сила воздействия одной частицы на грань
куба равна f
=
 /
=
۰
/2l=
/
=
۰
/2l= 2/l,
а сила воздействия всех частиц
2/l,
а сила воздействия всех частиц
газа на рассматриваемую грань куба согласно п.3 основных положений составляет: F=Nf/3=N 2/3l.
Зная, что давление – это отношение силы, действующей нормально к поверхности к площади этой поверхности, а площадь поверхности грани куба равна l2, получаем: P = F/S = N 2/3l.۰l2 = N 2/3l3
Но l3 – это объем куба, следовательно: PV = 1/3 N 2 (1.3)
Полученное выражение указывает на связь микро- и макроскопических свойств идеального газа и называется основным уравнением кинетической теории идеального газа. Основным это уравнение называется потому что:
а) из него можно вывести все газовые законы;
б) оно показывает, что кинетическая энергия молекул газа пропорциональна абсолютной температуре:
преобразуем
основное уравнение PV
= 2/3 N =
2/3NEК
(1.3а)
=
2/3NEК
(1.3а)
В таком виде оно выявляет связь объема и давления еще с одним микроскопическом свойством тела – средней энергией поступательного движения его частиц EК.
На основании равенства PV=RT (для одного моля газа) можно записать RT = 2/3NaEК или EК = T۰const,
где const объединяет все постоянные величины.
в) из основного уравнения МКТ можно вывести уравнение для вычисления средней квадратичной скорости:
так
как PV=RT
,то RT=1/3
Nа
2,
 =
=

Так
как Nam
– молярная масса, значит:
=
и
=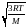 (1.4)
(1.4)
Таким образом, средняя квадратичная скорость зависит только от температуры и молярной массы.
14 Основные газовые законы
Первые количественные исследования реакций между газами принадлежат французскому ученому Гей-Люссаку. Измерив объемы газов, вступающих в реакцию и образующихся в результате реакции, Гей-Люссак пришел к выводу, известному под названием закона простых объемных отношений или «химического» закона Гей-Люссака:
ОБЪЕМЫ ВСТУПАЮЩИХ В РЕАКЦИЮ ГАЗОВ ОТНОСЯТСЯ ДРУГ К ДРУГУ И К ОБЪЕМАМ ОБРАЗУЮЩИХСЯ ГАЗООБРАЗНЫХ ПРОДУКТОВ РЕАКЦИИ КАК НЕБОЛЬШИЕ ЦЕЛЫЕ ЧИСЛА.
Например, при взаимодействии 2 объемов водорода и 1 объема кислорода образуется 2 объема водяного пара.
Конечно, при этом предполагается, что все измерения объемов проведены при одном и том же давлении и при одной и той же температуре. В 1811 г. Итальянский ученый Авогадро объяснил простые отношения между объемами газов, наблюдающиеся при химических реакциях, установив закон:
В РАВНЫХ ОБЪЕМАХ ЛЮБЫХ ГАЗОВ, ВЗЯТЫХ ПРИ ОДНОЙ И ТОЙ ЖЕ ТЕМПЕРАТУРЕ И ПРИ ОДИНАКОВОМ ДАВЛЕНИИ, СОДЕРЖИТСЯ ОДНО И ТО ЖЕ ЧИСЛО МОЛЕКУЛ.
Действительно, свойство идеального газа зависит не от природы газа (объема молекул и сил сцепления между ними), а от температуры и давления. Если газ находится при одинаковой температуре и давлении, скорости движения молекул одинаковы, а, следовательно, и расстояния между ними тоже одинаковы.
А так как объем газа зависит от расстояния между молекулами, то одинаковые количества молекул разных газов при одинаковых условиях должны занимать одинаковый объем.
Эта закономерность легко выводится из основного уравнения МКТ, его преобразованного вида:
PV
=
 (см. 1.3а)
(см. 1.3а)
Рассмотрим равные объемы двух различных газов, находящихся при одинаковых внешних условиях (Р и Т). Тогда получим:

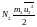
Так как абсолютная температура не зависит от природы газа, а зависит лишь от среднестатистического значения энергии его частиц, то при одинаковых температурах рассматриваемых газов средние энергии их частиц равны:
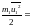

Отсюда следует, что N1 = N2, т. е. в равных объемах различных газов при одинаковых внешних условиях содержится одинаковое число частиц.
Из закона Авогадро вытекает два очень важных следствия:
Молярная масса газа или пара равна произведению его плотности по отношению к любому другому газу на молярную массу последнего.
При этом под плотностью понимают отношение массы определенного объема данного газа к массе такого же объема другого газа (при одинаковых Т и Р), молярная масса которого известна.
Моль любого газа при нормальных условиях (273 К и 1,033∙105 Па) занимает объем 22, 4 дм3 или 22, 4 л.
3.1.2 Законы Гей-Люссака, Шарля, Бойля-Мариотта.
Состояние любого газа определяется давлением, объемом и температурой. Свойства идеальных газов рассматриваются чаще всего при так называемых нормальных условиях ( температура 273 К или 00С и давление 1,033∙105 Па или 760 мм рт. ст. или 1 атм.).
При этих условиях, как известно, 1 моль газа занимает объем 22,4 литра.
Если же условия отличаются от нормальных, то и состояние газа будет иным, в зависимости о температуры и давления.
а) Зависимость объема газа от температуры при постоянном давлении была установлена Гей-Люссаком:
для данной массы идеального газа объем при постоянном давлении прямо пропорционален абсолютной температуре.
V = kT, где k – константа (1.5)
При н. у. это выражение примет вид:
V0 = kT0 (1.6)
Разделив равенство (1.5) на (1.6) и сократив постоянные k, получим:
 ,
откуда V=
(1.7)
,
откуда V=
(1.7)
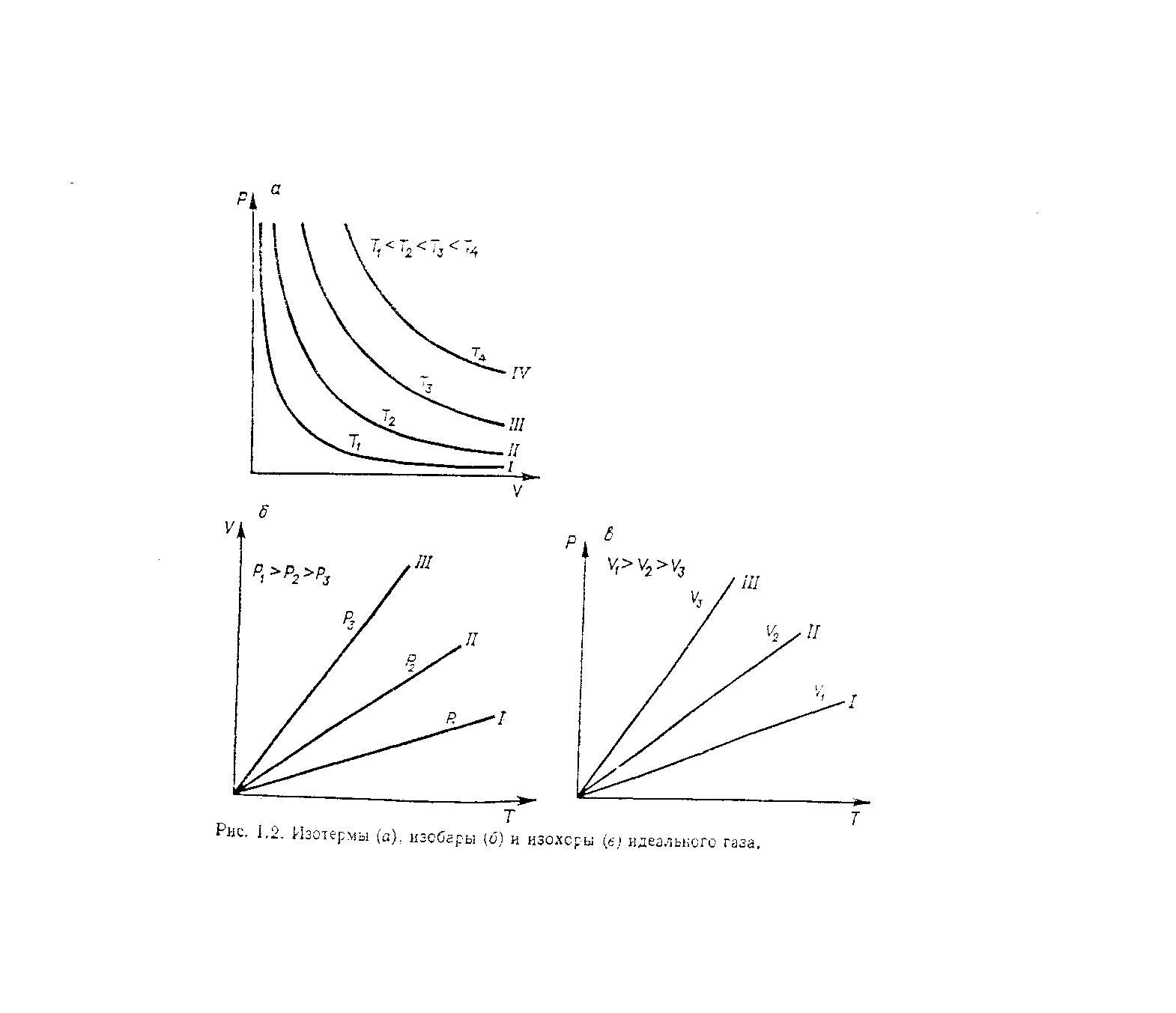
Графически уравнение закона Гей-Люссака изображается изобарами – прямыми, исходящими из начала координат V-T диаграммы (рис. 1.2б). Коэффициент k в уравнении закона Гей-Люссака зависит от природы газа, его массы и давления, что следует из основного уравнения МКТ. При постоянной массе газа изобара 1 описывает поведение газа при более высоком давлении, чем изобара II и III.
б) Закон Шарля устанавливает зависимость давления газа от температуры при постоянном объеме:
для данной массы идеального газа давление при постоянном объеме прямо пропорционален абсолютной температуре.
Р = kT, где k – константа (1.8)
При н. у. это выражение примет вид:
Р0 = kT0 (1.9)
Разделив равенство (1.8) на (1.9) и сократив постоянные k, получим:
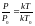
 ,
откуда Р=
,
откуда Р= (1.10)
(1.10)
Графически закон Шарля в координатах Р – Т изображается изохорами. Они имеют такой же вид как и изобары, изображенные в координатах V – T. Точно гак же, как и в уравнении закона Гей-Люссака, k в уравнении закона Шарля зависит от природы газа, его массы и объема. При постоянной массе газа изохора 1 описывает газ, занимающий больший объем, чем изохоры II и III.
в) Закон Бойля-Мариотта устанавливает зависимость между объемом газа и давлением при постоянной температуре:
объем данной массы идеального газа при постоянной температуре обратно пропорционален давлению, под которым газ находится, то-есть, во сколько раз увеличивается давление, во столько же раз уменьшается объем, занимаемый газом. В этом случае P1V1=P2V2=P3V3=k, т. е. произведение объема газа на давление при постоянной температуре будет величиной постоянной.
РV = const (1.11)
Графически закон Бойля - Мариотта изображается в координатах Р – V в виде симметричной гиперболы. Расстояние гиперболы от начала координат до вершины зависит от природы газа, его массы и температуры, что следует из основного уравнения МКТ (рис. 1.2а).
Кривые, иллюстрирующие закон Бойля – Мариотта, называются изотермами. Изотерма 1 соответствует более низкой температуре, а изотермы II – IV – более высокой.
