
- •1 Основные положения молекулярно-кинетической теории газов.
- •2 Основные типы кристаллических решеток. Изоморфизм, полиморфизм
- •4 Особенности металлической кристаллической решетки.
- •5 Особенности строение твёрдого тела
- •6 Кристаллизация металлов и сплавов
- •7 Поверхностная энергия
- •8 Особенности жидких металлов. Особенности жидких сплавов
- •9 Изотермы реальных газов
- •10 Особенности реальных газов. Уравнение Ван-дер-Ваальса
- •11 Способы выражения состава газовых смесей. Закон Дальтона. Плотность и средняя малярная масса смеси.
- •12 Уравнение состояния идеального газа.
- •13 Основное уравнение мкт и следствие из него
1 Основные положения молекулярно-кинетической теории газов.
Молекулярно- кинетическая теория газов основывается на нескольких допущениях:
1. Молекулы газа находятся на таких расстояниях друг от друга, что по сравнение с этими расстояниями можно пренебречь собственными размерами молекул и рассматривать их как точки, обладающие определенной массой (материальные точки).
2. Между молекулами идеального газа нет сил притяжения. Они ведут себя как упругие шары в пустоте и к ним применимы законы механики.
3. Молекулы находятся в состоянии вечного хаотического движения. Они движутся по всем направлениям и скорости их по абсолютной величине могут быть самыми разнообразными, но для каждой постоянной температуры средняя скорость молекул есть величина постоянная. Различают среднюю арифметическую и среднюю квадратичную скорости. Средняя арифметическая скорость молекул газа определяется из соотношения.
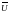 a
=
a
=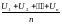 (1.1)
(1.1)
где a - средняя арифметическая скорость; U1, U2, …Un - скорости движения отдельных молекул газа; n – общее число молекул газа.
Средняя квадратичная скорость вычисляется делением суммы квадратов скоростей отдельных молекул на общее число молекул
2
=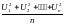
отсюда
=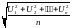 (1.2)
(1.2)
2 Основные типы кристаллических решеток. Изоморфизм, полиморфизм
В зависимости от природы частиц, из которых построена кристаллическая решетка, и природы сил взаимодействия между ними, различают ионные, атомные, металлические и молекулярные кристаллы.
Изоморфизм и полиморфизм.
Некоторые вещества могут существовать в различных кристаллических разновидностях.
Способность веществ одного и того же химического состава существовать в различных кристаллических разновидностях называется полиморфизмом (термическая аллотропия). Углерод может существовать в виде графита чешуйчатого строения и алмаза, обладающего большой твердостью. Каждая кристаллическая форма устойчива при определенных Т и Р.. При изменении условий происходит изменение кристаллических форм. Олово может находиться в двух кристаллических разновидностях: серое и белое. При Т > 13,2°С устойчиво белое, а при меньшей Т белое переходит в серое олово.
Полиморфные разновидности отличаются друг от друга температурой плавления, плотностью, твердостью. Если же разрушить кристаллическую структуру (расплавить или растворить), то различий в свойствах их не наблюдается.
Как правило, модификации одного и того же вещества обозначаются греческими буквами, стоящими перед его названием или химическим символом: буква α - при более низкой температуре; β - при более высокой температуре; γ и δ - еще при более высокой температуре.
Переход вещества из одной модификации в другую совершается обычно с поглощением тепла, если имеет место переход из низкотемпературной формы в высокотемпературную, и с выделением тепла - при обратном переходе.
Полиморфизм - весьма распространенное явление для твердого кристаллического состояния вещества. Можно предположить, что полиморфные превращения должны были бы иметься во всех без исключения случаях, если бы отсутствовали сублимация и плавление, ограничивающие область устойчивого существования кристаллов.
Железо также имеет полиморфные модификации. Ниже 910°С оно образует α - модификацию с объемно-центрированной кубической решеткой, между 910° и 1400°С существует γ - железо с плотной гранецентрированной кубической решеткой; выше 1400°С - δ —форма, похожая на α- модификацию, но с иными параметрами решетки. Аллотропная β - модификация железа существует между 769 и 9100С. Она сохраняет структуру α - Fe, но отличается по магнитным свойствам ( α -Fe - ферромагнитно , a β -Fe — нет).
Многие вещества различного химического состава образуют кристаллы совершенно одинаковой формы и близкие по внутренней структуре. Это явление называется изоморфизмом. Например, СаС03, MgC03, алюминиевые и хромовые квасцы. Изоморфные вещества могут кристаллизоваться совместно с образованием смешанных кристаллов (алюминиевые и хромовые квасцы).
3 Макро- и микроскопические свойства веществ. Идеальный газ.
Об окружающих телах мы судим по их свойствам, которые, будучи воспринимаемыми органами чувств, принято называть макроскопическими. Таковы температура, давление, объем, масса, агрегатное состояние, цвет, тепло- и электропроводность и др. Но уже ученые древности допускали, что все перечисленные свойства – это лишь «отголоски» некоторых основных свойств тела, связанных с его сущностью, о наличии которых можно лишь предполагать или судить на основании наблюдений (эксперимента). Так, предполагалось, что все тела состоят из невидимых мельчайших частиц, форма сосуществования которых и объясняет макроскопические свойства тел. Исходя из этого, свойства газов объяснили наличием большого расстояния между микрочастицами и как следствие слабым воздействием их друг на друга. И, напротив, в жидких и твердых телах расстояние между микрочастицами минимальны и, таким образом, значительны воздействия друг на друга.
Форма, объем, масса, электрический заряд и множество других свойств микрочастиц, а также характер взаимодействия между ними называются микроскопическими свойствами тела.
Между микро- и макроскопическими свойствами тесная связь, изучению которой и посвящен данный раздел.
Начнем с рассмотрения свойств газа, а для большей простоты возьмем за основу идеальный газ. В современно понимании идеальный газ – это тело, состоящее из неограниченного множества материальных точек, у которых единственной формой взаимодействия является прямое столкновение.
Материальная точка – это гипотетический (воображаемый) объект, обладающий массой, но не имеющий геометрических размеров , т. е. не имеющий объема.
