
- •4.3 Окислительно-восстановительные реакции
- •4.3.1 Общие сведения об окислительно-восстановительных реакциях
- •Если в формуле (6.1 а) не использовать множитель 100%, то массовая доля будет выражена не в процентах, а в долях единицы.
- •2.1 Зависимость скорости реакции от природы реагирующих веществ
- •2.2 Зависимость скорости реакции от концентрации реагирующих веществ
- •2.3 Зависимостьскорости реакции от температуры
- •2.4 Зависимость скорости реакции от присутствия катализаторов.
- •1. Тривиальная номенклатура
- •4. Радикало-функциональная номенклатура
- •2. Физические свойства спиртов
- •3. Одноатомные предельные спирты.
- •3.1 Методы получения
- •3.2 Химические свойства предельных спиртов
- •4. Двухатомные и трехатомные спирты. Методы получения и химические свойства.
- •5. Фенолы. Общая характеристика. Методы получения и химические свойства.
- •6. Отдельные представители. Методы идентификации.
- •Общая характеристика: строение, классификация, номенклатура
- •2. Способы получения аминов
- •3. Физические свойства аминов
- •4. Химические свойства аминов
- •2. Физические свойства альдегидов и кетонов
- •3. Способы получения
- •4. Химические свойства
- •1 Общая характеристика (строение, классификация, номенклатура, изомерия).
- •Классификация и номенклатура аминокислот.
- •5. С анионобразующими группами в боковых цепях-аспарагиновая и глутаминовая кислоты:
- •Физико-химические свойства аминокислот.
- •Химические реакции аминокислот.
- •Общая характеристика: строение, и свойства белков
- •1.1 Строение белковой молекулы
- •Физико-химические свойства белков.
- •Классификация белков
- •Мальтоза
- •Целлобиоза
- •Лактоза
- •Сахароза
- •Ферментативный гидролиз крахмала и гликогена
- •2. Физические свойства карбоновых кислот
- •3. Способы получения
- •4. Химические свойства
- •Общие признаки, функции, классификация
- •Жирные кислоты
- •Омыляемые липиды
- •Простые липиды
- •Прогоркание жира
- •Сложные липиды Фосфолипиды
- •Гликолипиды
- •Неомыляемые липиды
- •Стероиды
- •Терпены
2.1 Зависимость скорости реакции от природы реагирующих веществ
В зависимости от природы реагирующих веществ реакции могут протекать как очень медленно (некоторые реакции между органическими веществами, многие реакции с участием твердых веществ, как, например, коррозия металлов), так и очень быстро (ионные реакции в растворах). В
промежуточном случае, скорость реакции может быть такой, что ее нетрудно измерять в ходе короткого опыта.
2.2 Зависимость скорости реакции от концентрации реагирующих веществ
Необходимым условием того, чтобы между частицами исходных веществ, произошло химическое взаимодействие, является их столкновение друг с другом. Только при этом станут возможны те переходы электронов и перегруппировки атомов, в результате которых образуются молекулы новых веществ — продуктов реакции. Поэтому скорость реакции пропорциональна числу соударений, которые претерпевают молекулы реагирующих веществ.
Число соударений в свою очередь тем больше, чем выше концентрация каждого из исходных веществ или, что, то же самое, чем больше произведение концентрации реагирующих веществ.
Чтобы исследовать зависимость скорости реакции от концентрации реагирующих веществ, рассмотрим гомогенную реакцию, протекающую по уравнению:
А+В → АВ
Для ее осуществления необходимо, чтобы молекулы А и В в некоторый момент времени оказались в каком-то элементе объема, имеющем «молекулярные размеры» («столкнулись»).
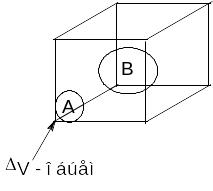
Вероятность того, что молекула А окажется в этом элементе объема (WA), очевидно, пропорциональна количеству молекул в единице объема, т. е. их концентрации:
WA ~ [А]
Подобным же образом, вероятность того, что молекула В окажется в том же объеме, пропорциональна концентрации молекул В:
WB ~ [В]
Из теории вероятности известно, что вероятность одновременного осуществления двух независимых событий равна произведению вероятностей каждого из событий. Следовательно, вероятность того, что и молекула А, и молекула В окажутся в одном и том же элементе объема:
WAB=WA • WB ~ [А]• [В]
Соответственно и скорость реакции будет пропорциональна произведению концентраций веществ А и В, т. е.
V= k• [А] • [В]
где k — коэффициент пропорциональности, называемый константой скорости реакции
Константа скорости реакции –постоянная для данной химической реакции величина, которая зависит от химической природы реагирующих веществ, температуры и катализатора, но не зависит от концентраций реагирующих веществ.Она равна той скорости, с которой должна совершаться реакция, если концентрация каждого из реагирующих веществ равна 1 моль/л.
Если химический процесс осуществляется в ходе одновременного столкновения двух частиц А и одной частицы В:
2А+В → А2В,
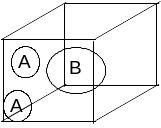
то легко показать с помощью рассуждений, аналогичных приведенных выше, что WA ~ [А]2
V= k[А]2•[В]
Уравнение, описывающее зависимость скорости реакции от концентрации реагирующих веществ, называется кинетическим уравнением реакции.
Для гомогенной реакции с участием а молекул вещества А и bмолекул вещества В: aA + bB → АаВb,
Уравнение скорости имеет вид: V= k[А]a •[B]b
Таким образом, скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, в степенях с показателями, численно равными коэффициентам в уравнении реакции.
Для гетерогенных реакций (т – ж, т – г), протекающих на границе раздела фаз, концентрация твердого вещества, реагирующего с газом или раствором, остается постоянной, поэтому в кинетическое уравнение концентрация твердых веществ не включается. Так, для реакции:
CaO(т) + CO2 (г)→ CaCO3(т)
Концентрации СаО и CaCO3 не изменяются,
Тогда кинетическое уравнение имеет вид: V= k[CO2]
