
- •Современные представления о строении атома. Состояние электрона в атоме. Квантовые числа. Строение электронных оболочек атомов. Строение атома
- •Периодический закон и периодическая система д.И.Менделеева.
- •4. Природа химической связи. Типы химических связей: ионная, ковалентная, донорно-акцепторная, водородная.
- •5.Основные типы химических реакций. Классификация химических реакций.
- •6. Растворы. Характеристика растворов. Процесс растворения. Состав растворов. Свойства растворов. Способы количественного выражения состава растворов.
- •7.Химическое равновесие.Необратимые и обратимые реакции.
- •Понятие химического равновесия. Смещение химического равновесия. Принцип Ле-Шателье.
- •Основные положения химической кинетики. Понятие скорости химических реакций. Константа скорости.
- •Факторы, влияющие на скорость химических реакций.
- •Классификация электролитов. Ионное произведение воды. Водородный показатель. Буферные растворы. Реакции гидролиза.
- •Окислительно-восстановительные реакции. Понятие окисления, восстановления, окислитель, восстановитель.
- •Типы окислительно-востановительных реакций. Типичные окислители и восстановители. Составление уравнений окислительно-восстановительных реакций (метод электронного баланса, метод полуреакций).
- •Предмет органической химии. Исторический обзор развития органической химии. Первые теоретические воззрения. Теория строения а.М.Бутлерова.
- •Химические свойства атомов и атомных групп неизменны и меняются только под влиянием присутствующих атомов и атомных групп, особенно непосредственно связанных друг с другом.
- •16. Основы номенклатуры в органической химии. Классификация органических соединений.
- •4. Радикало-функциональная номенклатура
- •Углеводороды алифатического ряда (алкены). Общая характеристика: строение, изомерия, номенклатура. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
- •20.Ароматические углеводороды (арены). Общая характеристика: строение, изомерия, номенклатура. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
- •А)Гидрирование
- •Б)Радикальное хлорирование
- •21.Спирты и фенолы. Общая характеристика: номенклатура и изомерия. Физические и химические свойства. Методы получения и идентификации. Отдельные представители
- •Изомерия
- •Электронное строение
- •Физические свойства
- •23.Простые эфиры и эфиры неорганических кислот. Общая характеристика: номенклатура и изомерия. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
- •24.Амины и аминоспирты. Общая характеристика: номенклатура и изомерия. Физические и химические свойства. Методы получения и идентификации.
- •25.Альдегиды и кетоны алифатического и ароматического ряда. Общая характеристика. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
- •1 Реакции присоединения
- •3 Реакция полимеризации
- •26.Аминокислоты. Общая характеристика: строение, классификация и номенклатура. Физические и химические свойства. Методы получения и идентификации. Биологически значимые аминокислоты.
- •27.Белки. Общая характеристика: строение и свойства белков. Классификация белков. Функции белков.
- •Классификация белков
- •28.Углеводы. Общая характеристика. Моносахариды. Строение, классификация, номенклатура. Оптическая изомерия. Физические и химические свойства.
- •29.Дисахариды. Строение, химические свойства отдельных представителей.
- •Мальтоза
- •30.Полисахариды. Строение, химические свойства отдельных представителей.
- •31.Карбоновые кислоты и их производные. Общая характеристика: номенклатура и изомерия. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
- •32.Липиды. Строение и свойства липидов. Классификация липидов. Физические и химические свойства жиров. Аналитическая характеристика жиров. Мыла и детергенты. Воски. Сложные липиды.
- •Жирные кислоты
Классификация белков
Белки в зависимости от химического строения делят на простые и сложные. Простые белки при гидролизе распадаются только на аминокислоты. При гидролизе сложных белков наряду с аминокислотами образуется вещество небелковой природы – простетическая группа. Классификация простых белков основана на их растворимости.
Альбумины – водорастворимые белки с высокой гидрофильностью, выпадают в осадок при 100%-ом насыщении сульфатом аммония. К этим белкам относятся белок куриного яйца, белки зародыша семян злаковых и бобовых культур. Альбумин пшеницы называют лейкозин, гороха – легумелин. Альбумины содержат все незаменимые аминокислоты.
Глобулины – растворяются в солевых растворах, чаще всего для извлечения глобулинов используют 2 –10%-ый раствор хлорида натрия. Они осаждаются 50%-ым раствором сульфата аммония. Белки семян бобовых и масличных культур в основном представлены глобулинами; легумин – гороха и чечевицы, фазеолин – фасоли; глицин – соевых бобов. Многие альбумины и глобулины обладают ферментативным действием.
Проламины. Эта группа белков характерна исключительно для семян злаков. Эти белки растворяются в 60-80%-ом растворе этилового спирта. Эти белки содержат значительные количества пролина и глютаминовой кислот. Лизина они не содержат или содержат его в следовых количествах. Хорошо изучены проламины пшеницы – глиадины, ячменя – гордеин, кукурузы – зеин. Проламины – это комплексы белков различающиеся по составу и молекулярной массе.
Глютелины находятся, как правило, с проламинами. Растворяются они в щелочах (чаще 0,2%-ым NaOH). Глютелины не однородные белки, а смеси разных белков со сходными свойствами. Наиболее исследованы глютелин пшеницы, орезенин риса.
Глютенин и глиадин пшеницы образуют комплекс, который называют клейковиной. Клейковина муки влияет на структурно-механические свойства теста, а, следовательно на качество хлеба.
Протамины – самые низкомолекулярные белки. Встречаются эти белки в молоках рыб. На 2/3 эти белки состоят из аргинина, поэтому имеют основной характер. Протамины не содержат серы.
Гистоны – содержаться в хромосомах клеточных ядер, они участвуют в стабилизации пространственной структуры ДНК. Гистоны на 20-30% состоят из основных аминокислот. Из растворов их осаждают аммиаком.
28.Углеводы. Общая характеристика. Моносахариды. Строение, классификация, номенклатура. Оптическая изомерия. Физические и химические свойства.
Углеводы наряду с белками и липидами являются важнейшими химическими соединениями, входящими в состав живых организмов. У человека и животных углеводы выполняют важные функции: энергетическую, структурную и защитную.
При окислении углеводов выделяется значительное количество энергии, которая накапливается в виде АТФ.
Углеводы (рибоза и дезоксирибоза) используются для синтеза нуклеиновых кислот, они являются составными компонентами нуклеиновых коферментов, играющих исключительно важную роль в метаболизме у живых существ.
Промежуточные продукты распада углеводов служат исходными веществами для синтеза других соединений, необходимых живой клетке.
С нарушением обмена углеводов тесно связан ряд заболеваний: сахарный диабет, галактоземия и т.д.
На долю углеводов приходится 60-70% пищевого рациона. Они содержатся преимущественно в растительных продуктах, являются основными компонентами хлеба, круп, макарон, кондитерских изделий, служат сырьем в бродильной промышленности, в производстве пищевых кислот: уксусной, молочной, лимонной.
Классификация углеводов основана на структуре и физико-химических свойствах.
Углеводы подразделяются на три основные группы: моносахариды, олигосахариды и полисахариды.
 Моносахариды
(простые
сахара) – углеводы, которые не способны
гидролизоваться до более простых
соединений.
Моносахариды
(простые
сахара) – углеводы, которые не способны
гидролизоваться до более простых
соединений.
Олигосахариды (низкомолекулярные сахара) – углеводы, которые при гидролизе распадаются на 2-8 моносахарида («олигос» – по-гречески немногий).
Полисахариды (сложные сахара) – продукты конденсации моносахаридов, они способны гидролизоваться с образованием простых углеводов (от десятков до сотен тысяч молекул моносахаридов).
Моносахариды (монозы) классифицируют по количеству атомов углерода и по характеру карбонильной группы.
По количеству атомов углерода различают: триозы – сахара с тремя атомами углерода, тетрозы – с четырьмя, пентозы – с пятью, гексозы – с шестью и т.д. Сахара, содержащие семь и более атомов углерода, называют высшими сахарами.
Моносахариды, содержащие альдегидную группу, называют альдозами, кетонную – кетозами. Часто эти названия объединяют, чтобы одновременно показать и число углеродных атомов, и характер карбонильной группы. Например: глюкоза является альдогексозой, а фруктоза – кетогексозой, простейшей альдотриозой является глицериновый альдегид, а простейшей кетотриозой – дигидроксиацетон:
Пространственная изомерия
|
|
|
Слева D-глицеральдегид, справа L-глицеральдегид. |
||
Изомерия (от др.-греч. ἴσος — равный, и μέρος — доля, часть) — существование химических соединений (изомеров), одинаковых по составу и молекулярной массе, различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
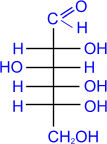
Стереоизомерия моносахаридов: изомер глицеральдегида у которого при проецировании модели на плоскость ОН-группа у асимметричного атома углерода расположена с правой стороны принято считать D-глицеральдегидом, а зеркальное отражение — L-глицеральдегидом. Все изомеры моносахаридов делятся на D- и L- формы по сходству расположения ОН-группы у последнего асимметричного атома углерода возле СН2ОН-группы (кетозы содержат на один асимметричный атом углерода меньше, чем альдозы с тем же числом атомов углерода). Природные гексозы — глюкоза, фруктоза, манноза и галактоза — по стереохимической конфигурациям относят к соединениям D-ряда[5].
Номенклатура
Наличие в молекуле асимметрических атомов, углерода делает моносахариды оптически активными соединениями, причем величина удельного вращения является хараткеристическим параметром моносахарида. Номенклатура моносахаридов основывается на соединениях с неразветвленной цепью атомов углерода. Углеродные атомы нумеруют таким образом, чтобы карбонильный углерод имел наименьший номер. Заместители (атомы функциональные группы) получают тот же номер, что и углеродный атом, с которым они соединены. Если в молекуле имеется более одной функциональной группы, они перечисляются в алфавитном порядке. Отсутствие ОН-группы отражается префиксом «дезокси».
Энантиомерия (оптическая изомерия)
Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов — веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с другими оптически активными веществами и физических свойств в хиральной среде). Необходимая и достаточная причина возникновения оптических антиподов — принадлежность молекулы к одной из следующих точечных групп симметрии: Cn, Dn, T, O или I (хиральность). Чаще всего речь идет об асимметрическом атоме углерода, то есть об атоме, связанном с четырьмя разными заместителями.
Химические свойства
Моносахариды проявляют свойства спиртов и карбонильных соединений.
I. Реакции по карбонильной группе
1. Окисление.
a) реакция "серебряного зеркала"
|
+ 2[Ag(NH3)2]OH ® |
|
+ 2AgЇ + 3NH3 + H2O |
b) Реакция моносахаридов с гидроксидом меди при нагревании так же приводит к альдоновым кислотам.
|
+ 2Cu(OH)2 ® |
|
+ Cu2OЇ + 2H2O |
2. Восстановление.
Восстановление сахаров приводит к многоатомным спиртам. В качестве восстановителя используют водород в присутствии никеля, алюмогидрид лития и др.
D- глюкоза |
LiAlH4 ––––® |
|
II. Реакции по гидроксильным группам
1. Алкилирование (образование простых эфиров).
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
|
+ СH3ОН |
HCl(газ) ––––® |
|
+ H2О |
2. Ацилирование (образование сложных эфиров).
При действии на глюкозу уксусного ангидрида образуется сложный эфир – пентаацетилглюкоза.
|
––––––––® |
|
III. Специфические реакции
a) спиртовое брожение
C6H12O6 ® 2CH3–CH2OH(этиловый спирт) + 2CO2
b) молочнокислое брожение
C6H12O6 ® 2CH3– |
CH–СОOH(молочная кислота) I OH |
c) маслянокислое брожение
C6H12O6 ® CH3–CH2–СН2–СОOH(масляная кислота) + 2Н2 + 2CO2


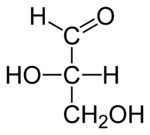
 D-
глюкоза
D-
глюкоза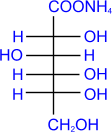 аммониевая
соль
D- глюконовой
кислоты
аммониевая
соль
D- глюконовой
кислоты D-
галактоза
D-
галактоза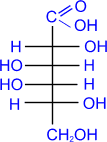 D-
галактоновая
кислота
D-
галактоновая
кислота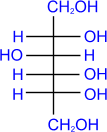 D-
сорбит
D-
сорбит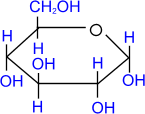 a, D-
глюкопираноза
a, D-
глюкопираноза метил- a,
D-
глюкопиранозид
метил- a,
D-
глюкопиранозид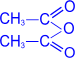
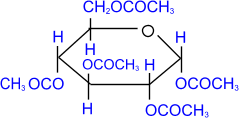 пентаацетил- a,D-
глюкопираноза
пентаацетил- a,D-
глюкопираноза