
- •Современные представления о строении атома. Состояние электрона в атоме. Квантовые числа. Строение электронных оболочек атомов. Строение атома
- •Периодический закон и периодическая система д.И.Менделеева.
- •4. Природа химической связи. Типы химических связей: ионная, ковалентная, донорно-акцепторная, водородная.
- •5.Основные типы химических реакций. Классификация химических реакций.
- •6. Растворы. Характеристика растворов. Процесс растворения. Состав растворов. Свойства растворов. Способы количественного выражения состава растворов.
- •7.Химическое равновесие.Необратимые и обратимые реакции.
- •Понятие химического равновесия. Смещение химического равновесия. Принцип Ле-Шателье.
- •Основные положения химической кинетики. Понятие скорости химических реакций. Константа скорости.
- •Факторы, влияющие на скорость химических реакций.
- •Классификация электролитов. Ионное произведение воды. Водородный показатель. Буферные растворы. Реакции гидролиза.
- •Окислительно-восстановительные реакции. Понятие окисления, восстановления, окислитель, восстановитель.
- •Типы окислительно-востановительных реакций. Типичные окислители и восстановители. Составление уравнений окислительно-восстановительных реакций (метод электронного баланса, метод полуреакций).
- •Предмет органической химии. Исторический обзор развития органической химии. Первые теоретические воззрения. Теория строения а.М.Бутлерова.
- •Химические свойства атомов и атомных групп неизменны и меняются только под влиянием присутствующих атомов и атомных групп, особенно непосредственно связанных друг с другом.
- •16. Основы номенклатуры в органической химии. Классификация органических соединений.
- •4. Радикало-функциональная номенклатура
- •Углеводороды алифатического ряда (алкены). Общая характеристика: строение, изомерия, номенклатура. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
- •20.Ароматические углеводороды (арены). Общая характеристика: строение, изомерия, номенклатура. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
- •А)Гидрирование
- •Б)Радикальное хлорирование
- •21.Спирты и фенолы. Общая характеристика: номенклатура и изомерия. Физические и химические свойства. Методы получения и идентификации. Отдельные представители
- •Изомерия
- •Электронное строение
- •Физические свойства
- •23.Простые эфиры и эфиры неорганических кислот. Общая характеристика: номенклатура и изомерия. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
- •24.Амины и аминоспирты. Общая характеристика: номенклатура и изомерия. Физические и химические свойства. Методы получения и идентификации.
- •25.Альдегиды и кетоны алифатического и ароматического ряда. Общая характеристика. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
- •1 Реакции присоединения
- •3 Реакция полимеризации
- •26.Аминокислоты. Общая характеристика: строение, классификация и номенклатура. Физические и химические свойства. Методы получения и идентификации. Биологически значимые аминокислоты.
- •27.Белки. Общая характеристика: строение и свойства белков. Классификация белков. Функции белков.
- •Классификация белков
- •28.Углеводы. Общая характеристика. Моносахариды. Строение, классификация, номенклатура. Оптическая изомерия. Физические и химические свойства.
- •29.Дисахариды. Строение, химические свойства отдельных представителей.
- •Мальтоза
- •30.Полисахариды. Строение, химические свойства отдельных представителей.
- •31.Карбоновые кислоты и их производные. Общая характеристика: номенклатура и изомерия. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
- •32.Липиды. Строение и свойства липидов. Классификация липидов. Физические и химические свойства жиров. Аналитическая характеристика жиров. Мыла и детергенты. Воски. Сложные липиды.
- •Жирные кислоты
24.Амины и аминоспирты. Общая характеристика: номенклатура и изомерия. Физические и химические свойства. Методы получения и идентификации.
Аминами называются производные аммиака, молекуле которого атомы водорода замещены на углеводородные радикалы.
Классификация
1– В зависимости от числа замещенных атомов водорода аммиака различают амины:
– первичные содержат аминогруппу аминогруппу (–NH2), общая формула: R–NH2,
– вторичные содержат иминогруппу (–NH),
общая формула: R1–NH–R2
– третичные содержат атом азота, общая формула: R3–N
2– В зависимости от строения радикала амины различают:
– алифатические (предельные и непредельные)
– алициклические
– ароматические (содержащие в ядре аминогруппу или боковой цепи)
– гетероциклические.
Номенклатура, изомерия аминов
1. Названия аминов по рациональной номенклатуре обычно производят от названий входящих в них углеводородных радикалов с присоединением окончания –амин: метиламин СН3–NН2, диметиламин СН3–NН–СН3, триметиламин (СН3)3N, пропиламин СН3СН2СН2–NН2, фениламин С6Н5– NН2 и т. д.
2. По номенклатуре ИЮПАК аминогруппу рассматривают как функциональную группу и ее название амино- ставят перед названием основной цепи:

Изомерия аминов зависит от изомерии радикалов.
Способы получения аминов
А) Действием на аммиак галогеналкилами
2NH3 + CH3I –– CH3– NH2 + NH4I
Б) Каталитическое гидрирование нитробензола молекулярным водородом: С6Н5NО2 –– С6Н5NН2 + Н2О
нитробензол кат анилин
В) Получение низших аминов (С1–С4) путем алкилирования спиртами:
3500C, Al2O3
R–OH + NH3 ––––––––––– R–NH2 +H2O
–N + 3H2O
Физические свойства аминов
Метиламин, диметиламин и триметиламин — газы, средние члены ряда аминов — жидкости, высшие — твердые тела. С увеличением молекулярной массы аминов увеличивается их плотность, повышается температура кипения и уменьшается растворимость в воде. Высшие амины в воде нерастворимы. Низшие амины имеют неприятный запах, несколько напоминающий запах испорченной рыбы. Высшие амины или не имеют запаха, или обладают очень слабым запахом. Ароматические амины представляют собой бесцветные жидкости или твердые вещества, обладающие неприятным запахом и ядовиты.
Химические свойства аминов
Химическое поведение аминов определяется наличием в молекуле аминогруппы. На внешней электронной оболочке атома азота имеется 5 электронов. В молекуле амина также, как и в молекуле аммиака, атом азота затрачивает на образование трех ковалентных связей три электрона, а два остаются свободными.
Наличие свободной электронной пары у атома азота дает ему возможность присоединять протон, поэтому амины подобны аммиаку, проявляют основные свойства, образуют гидроксиды, соли.
Солеобразование.
![]()
А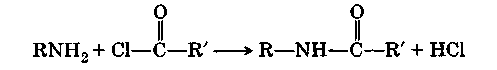 цилирование
аминов.
При
действии на первичные и вторичные амины
некоторых производных органических
кислот (галогенангидридов, ангидридов
и др.) образуются амиды:
цилирование
аминов.
При
действии на первичные и вторичные амины
некоторых производных органических
кислот (галогенангидридов, ангидридов
и др.) образуются амиды:
Третичные амины в эту реакцию не вступают.
Диамины
Диамины играют важную роль в биологических процессах. Как правило, они легко растворимы в воде, обладают характерным запахом, имеют сильно щелочную реакцию, взаимодействуют с С02 воздуха. Диамины образуют устойчивые соли с двумя эквивалентами кислоты.
Этилендиамин (1,2-этандиамин) H2NCH2СН2NН2. Он является простейшим диамином; может быть получен действием аммиака на этиленбромид:
![]()
Аминоспирты
Аминоспирты — соединения со смешанными функциями, в молекуле которых содержатся амино- и оксигруппы.
Этаноламин — густая маслянистая жидкость, смешивается с водой во всех отношениях, обладает сильными щелочными свойствами. Hаряду с моноэтаноламином получаются также диэтаноламин и триэтаноламин:

Этаноламины широко применяются в технике в качестве эмульгаторов и других поверхностно-активных веществ, а также в различных процессах газоочистки, в том числе для извлечения оксида углерода (IV) из топочных газов при производстве сухого льда (твердой двуокиси углерода).
Холин. Он представляет собой четырехзамещенное аммониевое основание. В нем с атомом азота связаны три метильные и одна окси-этильная группа:

Холин входит в состав лецитинов — жироподобных веществ, весьма распространенных в животных и растительных организмах, и может быть выделен из них. Холин представляет собой кристаллическую, весьма гигроскопичную, легко расплывающуюся на воздухе массу. Он обладает сильными щелочными свойствами и с кислотами легко образует соли.
