
11,12, 13 Образование простейших комплексов в растворах. Координационное число. Константа устойчивости
Рассмотрим
образование комплексных ионов
(комплексов) и химическую связь в них
на следующем примере. При действии
раствора аммиака на раствор соли цинка
(например, ZnCl2) выпадает осадок гидроксида
цинка Zn(OH)2, а при избытке аммиака осадок
растворяется. Что при этом происходит?
Из раствора можно выделить соль —
аммиакат цинка ZnCl2•4NH3. Это соединение
комплексное. Оно образовано комплексными
катионами [Zn(NH3)4]2+ и простыми анионами
Сl-. Происходящие реакции можно выразить
следующими уравнениями:
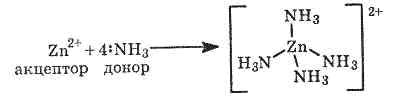
Zn2++4NH3=[Zn(NH3)4]2+
Образование
комплекса [Zn(NH3)4]2+ можно объяснить
донорно-акцепторным взаимодействием
иона Zn2+ с молекулами NH3. Атом цинка имеет
электронную конфигурацию:
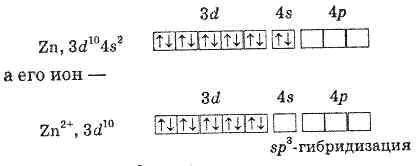 У
иона Zn2+ свободны одна s- и три р-валентные
орбитали. Поэтому ион может выступать
в качестве акцептора четырех электронных
пар. Молекула же NH3 имеет одну несвязывающую
(неподеленную) электронную пару и,
следовательно, может выступать в
качестве донора электронной пары. В
результате донорно-акцепторного
взаимодействия иона Zn2+ и молекул NH3
образуется комплексный ион [Zn(NH3)4]2+.
Вследствие sp3-гибридизации орбиталей
цинка этот ион имеет форму
тетраэдра:
У
иона Zn2+ свободны одна s- и три р-валентные
орбитали. Поэтому ион может выступать
в качестве акцептора четырех электронных
пар. Молекула же NH3 имеет одну несвязывающую
(неподеленную) электронную пару и,
следовательно, может выступать в
качестве донора электронной пары. В
результате донорно-акцепторного
взаимодействия иона Zn2+ и молекул NH3
образуется комплексный ион [Zn(NH3)4]2+.
Вследствие sp3-гибридизации орбиталей
цинка этот ион имеет форму
тетраэдра:
 Основополагающие
представления о комплексных соединениях
ввел швейцарский ученый А. Вернер
(1891). По Вернеру комплексное соединение
[Zn(NH3)4]Cl2 состоит из внутренней [Zn(NH3)4]2+
и внешней сферы Сl-; Zn2+ — комплексообразователь
(центральный атом), NH3 — лиганд (от
латинского — связывать).
Основополагающие
представления о комплексных соединениях
ввел швейцарский ученый А. Вернер
(1891). По Вернеру комплексное соединение
[Zn(NH3)4]Cl2 состоит из внутренней [Zn(NH3)4]2+
и внешней сферы Сl-; Zn2+ — комплексообразователь
(центральный атом), NH3 — лиганд (от
латинского — связывать).
Число координированных лигандов равно координационному числу комплексообразователя.
По характеру электрического заряда различают катионные, анионные и нейтральные комплексы. По ионной модели заряд комплекса представляет собой алгебраическую сумму зарядов образующихся частиц. Катионный комплекс можно рассматривать как образованный в результате координации вокруг положительного иона нейтральных молекул (Н2О, H3N и т.д.). Молекулы Н2О и NH3 в номенклатуре комплексных соединений называют аква и аммин соответственно. [Аl(Н2О)6]Сl3 — трихлорид гексаакваалюминия, или хлорид гексаакваалюминия (III) [Zn(NH3)4]Cl2 — дихлорид тетраамминцинка, или хлорид тетраамминцинка (II) Соединения, содержащие амминокомплексы, называются аммиакатами, а содержащие аквакомплексы, — гидратами. В роли комплексообразователя в анионном комплексе выступает атом с положительной степенью окисления (положительный ион), а лигандами являются атомы с отрицательной степенью окисления (анионы). Отрицательный заряд комплекса отражают добавлением к латинскому названию комплексообразователя суффикса -ат, например: K2[BeF4] — тетрафторбериллат (II) калия Са3[Аl(ОН)6]2 — гексагидроксоалюминат (II) кальция Нейтральные комплексы образуются при координации вокруг положительного иона-комплексообразователя отрицательных ионов и молекул. Например: [Pt(NH3)2Cl2] — дихлордиамминплатина [Ni(CO)4] — тетракарбонилникель [Cr(С6Н6)2] — дибензолхром
Электронейтральные комплексы, следовательно, являются комплексными соединениями без внешней сферы. Рассмотрим некоторые комплексные соединения платины (IV). С позиции метода валентных связей можно показать, что для платины (IV) характерно координационное число 6. Электронная конфигурация валентных орбиталей атома платины 5d96s1. Метод валентных связей не позволяет объяснить состав, строение и свойства всего многообразия комплексных соединений. Значительно шире используется теория кристаллического поля и метод молекулярных орбиталей, который стал в настоящее время ведущим. Комплексные соединения широко распространены в природе, играют важную роль в биологических процессах. Достаточно упомянуть гемоглобин крови (комплексообразователь Fe2+) и хлорофилл зеленых растений (комплексообразователь Mg2+), витамин В12 (комплексообразователь Со2+). Комплексные соединения и комплексообразование находят самое разнообразное практическое применение. Образование комплексов используется при умягчении жесткой воды и растворении камней в почках; важную роль играют комплексные соединения в химическом анализе, производстве металлов и т.д. Необходимо отметить, что внутренняя и внешняя сферы комплексного соединения сильно различаются по устойчивости; частицы, находящиеся во внешней сфере, связаны с комплексным ионом преимущественно электростатическими силами и легко отщепляются в водном растворе. : Эта диссоциация называется первичной, она протекает почти нацело по типу диссоциации сильных электролитов. Лиганды, находящиеся во внутренней сфере, связаны с нейтральным атомом значительно прочнее и отщепляются лишь в небольшой степени. Обратимый распад внутренней сферы комплексного соединения носит название вторичной диссоциации. Например, диссоциацию комплекса [Ag(NH3)2]Cl можно записать так: [Ag(NH3)2]++Сl- — первичная диссоциация [Ag(NH3)2]+Ag++2NH3 — вторичная диссоциация[Ag(NH3)2]Cl Г Вторичная диссоциация характеризуется наличием равновесия между комплексной частицей, центральным атомом и лигандами. В этом можно убедиться на основании следующих реакций. Если на раствор, содержащий комплексный ион [Ag(NH3)2]+, подействовать раствором какого-нибудь хлорида, то осадка не образуется, хотя из растворов обычных солей серебра при добавлении хлоридов выделяется осадок хлорида серебра. Очевидно, концентрация ионов серебра в аммиачном растворе слишком мала, чтобы при введении в него даже избытка хлорид-ионов можно было бы достигнуть величины произведения растворимости хлорида серебра (ПРAgCl=1,8•10-10). Однако после прибавления к раствору комплекса иодида калия выпадает осадок иодида серебра. Это доказывает, что ионы серебра все же имеются в растворе. Как ни мала их концентрация, но она оказывается достаточной для образования осадка, т.к. произведение растворимости иодида серебра AgI составляет только 1•10-16, т.е. значительно меньше, чем у хлорида серебра. Точно так же при действии сероводорода получается осадок сульфида серебра Ag2S, произведение растворимости которого равно 10-51. Константы нестойкости для различных комплексных ионов весьма различны и могут служить мерой устойчивости комплекса. Константы нестойкости, в выражения которых входят концентрации ионов и молекул, называются «концентрационными». Более строгими и не зависящими от концентраций и ионной силы раствора являются константы нестойкости, содержащие вместо концентраций активности ионов и молекул. В разбавленных растворах эти два различных выражения констант нестойкости совпадают друг с другом. Из приведенной формулы видно:
Чем меньше концентрация продуктов распада, т.е. чем устойчивее комплекс, тем меньше его константа нестойкости.
Наиболее устойчивые в растворах комплексные частицы имеют наименьшие константы нестойкости. устойчивость комплекса возрастает при переходе от [Ag(NO2)2]- к [Ag(CN)2]-. Ион [Аg(СN)2]-. настолько стоек, что даже прибавление иодида калия к раствору комплексной соли не приводит к образованию осадка иодида серебра. Но при действии сероводорода, ввиду очень малой величины произведения растворимости сульфида серебра, все же выпадает осадок сульфида серебра. Для характеристики устойчивости комплексных соединений предпочитают пользоваться величиной, обратной константе нестойкости, называемой константой устойчивости. До сих пор шла речь об общих константах нестойкости и устойчивости, относящихся к распаду комплекса на конечные продукты. В действительности же в растворах имеет место ступенчатая диссоциация комплекса, аналогично ступенчатой диссоциации слабых электролитов, например, многоосновных кислот.
с Каждое из этих равновесий характеризуется своей ступенчатой константой нестойкости K1 К2 и т.д. По мере отщепления хлорид-ионов заряд комплекса становится все более положительным, а число ионов Сl- в комплексе уменьшается. В результате последовательный отрыв хлорид-ионов все в большей степени затрудняется. Поэтому между ступенчатыми константами нестойкости иона [PtCl4]2- имеет место соотношение: К1>К2>К3>К4 Такое изменение в величинах последовательных констант нестойкости носит общий характер. Величина общей константы нестойкости равна произведению всех ступенчатых констант. Значения констант нестойкости и устойчивости приводятся в справочниках по химии. С помощью этих величин можно предсказать течение реакций между комплексными соединениями: при сильном различии констант устойчивости реакция пойдет в сторону образования комплекса с большей константой устойчивости или, что равноценно, меньшей константой нестойкости. Процессы комплексообразования широко используются в аналитической химии. При выборе условий наиболее эффективного разделения ионов исходят из соотношения констант устойчивости образуемых ими комплексных соединений. Например, катионы Ni2+, Co2+, Zn2+ дают устойчивые растворимые аммиакаты, а Аl3+, Fe3+, Cr3+ менее склонны к комплексообразованию с аммиаком и осаждаются при действии аммиака в виде гидроксидов. Это позволяет разделить действием аммиака эти две группы катионов. Подобного рода соображения могут быть использованы и для разделения анионов.
Константы устойчивости однотипных комплексов зависят от ряда факторов и прежде всего от природы центрального атома и лигандов. В комплексах с центральными ионами, обладающими слабой поляризующей способностью, например с ионами щелочных и щелочноземельных металлов, устойчивость растет по мере увеличения интенсивности электростатического взаимодействия между центральным атомом и лигандами: чем больше заряды центрального иона и лигандов и чем меньше их радиусы, тем выше устойчивость комплексов. Эти катионы образуют более устойчивые комплексы с лигандами, содержащими элементы малых периодов (кислород, азот) и с ионами F-. Для другой большой группы комплексообразователей — катионов платиновых металлов, ионов Hg2+, Ag+, Au3+, у которых поляризующая способность выражена сильно и характер связи центрального атома с лигандами приближается к ковалентному, — наиболее устойчивы комплексы с легко поляризующимися лигандами. К последним относятся, например, ионы I- и лиганды, содержащие атомы Р и S.
