
- •5Аминокислоты – производные карбоновых кислот или жирных кислот. Общая форма аминокислоты:
- •Ферменты поджелудочной железы. Поджелудочная железа является основной железой в системе пищеварения. Она секретирует ферменты в просвет двенадцатиперстной кишки.
- •86. Механизмы использования гликогена клетками.Синтез и фосфоролиз гликогена в печени.Понятие об анаэробном гликолизе и гликогенолизе.Энергитическая эффективность гликолиза.
- •98. Водорастворимые витамины это витамины группы в,аскорбиновая кислота,рр,р.
- •99. Водорастворимые витамины это витамины группы в,аскорбиновая кислота,рр,р.
- •Нейросекреторные клетки гипоталамуса:
86. Механизмы использования гликогена клетками.Синтез и фосфоролиз гликогена в печени.Понятие об анаэробном гликолизе и гликогенолизе.Энергитическая эффективность гликолиза.
Гликоген — полисахарид, образованный остатками глюкозы; основной запасной углевод человека и животных. Гликоген является основной формой хранения глюкозы в животных клетках. Откладывается в виде гранул в цитоплазме во многих типах клеток (главным образом печени и мышц). Гликоген образует энергетический резерв, который может быть быстро мобилизован при необходимости восполнить внезапный недостаток глюкозы.
Гликогеновый запас, однако, не столь ёмок в калориях на грамм, как запас жиров. Только гликоген, запасённый в клетках печени (гепатоциты) может быть переработан в глюкозу для питания всего организма, при этом гепатоциты способны накапливать до 8 процентов своего веса в виде гликогена, что является максимальной концентрацией среди всех видов клеток. Общая масса гликогена в печени может достигать 100—120 граммов у взрослых. В мышцах гликоген перерабатывается в глюкозу исключительно для локального потребления и накапливается в гораздо меньших концентрациях (не более 1 % от общей массы мышц), в то же время его общий мышечный запас может превышать запас, накопленный в гепатоцитах. Небольшое количество гликогена обнаружено в почках, и ещё меньшее — в определённых видах клеток мозга и белых кровяных клетках.
При голодании и значительной физической нагрузке содержание гликогена в печени и мышцах значительно уменьшается. Гликоген мышц и печени подвергается постоянному расщеплению и синтезу.
Ферментативное расщепление гликогена осуществляется двумя путями: гидролизом и фосфоролизом. Гидролитическое расщепление гликогена осуществляется альфа-амилазой, вследствие чего образуется мальтоза. При фосфорилировании гликогена при участии фосфорилазы (в печени) образуется глюкозо-1-фосфат.
Синтез гликогена осуществляется с глюкозо-6-фосфата при участии ДФ-глюкозы и ферментов гликозилтрансфераз, которые переносят остатки глюкозы с УДФ-глюкозы на нередуцированный конец полисахаридной цепи. Синтез и расщепление гликогена регулируется нервно-гуморальными системами (ЦНС, инсулином, адреналином). Нарушение обмена гликогена наблюдается при различных наследственных заболеваниях
Гликогенолиз - это распад гликогена. Гликогенолиз происходит непрерывно, и за счет этого поддерживается постоянная концентрация глюкозы в крови в промежутках между приемами пищи. Во время ночного голодания около 75% глюкозы печеночного происхождения образуется путем гликогенолиза. 25% глюкозы печеночного происхождения образуется путем глюконеогенеза
В процессе гликолиза пищевые вещества подвергаются окислению (дегидрированию) без участия кислорода. Конечным акцептором водорода (окислителем) в этом случае служит молекула какого-либо органического вещества. Энергетическая эффективность гликолиза невелика, и в конечном счете из каждой использованной молекулы глюкозы образуется всего 2 молекулы АТФ.(Аденозинтрифосфат — Универсальный источник энергии для всех биохимических процессов, протекающих в живых системах.)
87. Энергетическая потребность - это полное соответствие пищевой ценности питания энергетическим затратам организма (для поддержания жизни и выполнения работы). Энергетическая ценность выражается в килоджоулях (кДж) или килокалориях (ккал). Вся энергетическая потребность - это совокупность основной, поддерживающей и рабочей потребностей организма человека.
Основной обмен - это количество энергии, необходимое для поддержания жизни организма, который находится в состоянии покоя, то есть утром, лежа в кровати натощак при комфортной температуре. Для мужчин эта величина составляет 1 ккал на 1 кг массы тела в час, а для женщин - 0,9 ккал/кг/час.Все проявления соц активности (работа,трад…)требуют дополнительного количества энергии.В соответствии с характером трудовой деятельности,характером активности население может быть поделено на ряд профессиональных групп:-лица занятые приимущественно умственным трудом(коэффициент физической активности для них равен 1,4);-лица занятые физическим и умственным трудом(коэф.физ.активности равен 1,6) и т.д.
Энергия черпается за счет энергии компонентов пищи,при этом 1г углеводов дает 4,1 ккал,1г белков 4,1 ккал,1г жиров 9,3 кккал.
88. Аденозинтрифосфа́т (сокр. АТФ) — нуклеотид, играет исключительно важную роль в обмене энергии и веществ в организмах; в первую очередь соединение известно как универсальный источник энергии для всех биохимических процессов, протекающих в живых системах.
Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. Все это реакции синтеза сложных веществ в организме: осуществление активного переноса молекул через биологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществления мышечного сокращения.
Фосфорилирование — процесс присоединения к какому-либо субстрату остатков фосфорной кислоты. В организме АТФ синтезируется из АДФ, используя энергию окисляющихся веществ
АДФ + H3 PO4(ортофосфорная кислота) + энергия → АТФ + H2 O.
Фосфорилирование АДФ(аденозиндифосфат)возможно двумя способами: субстратное фосфорилирование и окислительное фосфорилирование. Основная масса АТФ образуется на мембранах митохондрий в ходе окислительного фосфорилирования H-зависимой АТФ-синтазой. Субстратное фосфорилирование АТФ не требует участия мембранных ферментов, оно происходит в процессе гликолиза или путём переноса фосфатной группы с других макроэргических соединений.
Реакции фосфорилирования АДФ и последующего использования АТФ в качестве источника энергии образуют циклический процесс, составляющий суть энергетического обмена.
В организме АТФ является одним из самых часто обновляемых веществ, так у человека продолжительность жизни одной молекулы АТФ менее 1 мин. В течение суток одна молекула АТФ проходит в среднем 2000—3000 циклов ресинтеза (человеческий организм синтезирует около 40 кг АТФ в день), то есть запаса АТФ в организме практически не создаётся, и для нормальной жизнедеятельности необходимо постоянно синтезировать новые молекулы АТФ.
Катаболи́зм -процесс метаболического распада, разложения на более простые вещества или окисления какого-либо вещества, обычно протекающий с высвобождением энергии в виде тепла и в виде АТФ.
89. Ци́кл трикарбо́новых кисло́т— центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух- и трёхуглеродных соединений, образующихся как промежуточные продукты в живых организмах при распаде углеводов, жиров и белков, до CO2. При этом освобождённый водород направляется в цепь тканевого дыхания, где в дальнейшем окисляется до воды, принимая непосредственное участие в синтезе универсального источника энергии — АТФ. Это ключевой этап дыхания всех клеток, использующих кислород, центр пересечения множества метаболических путей в организме. Кроме значительной энергетической роли циклу отводится также и существенная пластическая функция, то есть это важный источник молекул-предшественников, из которых в ходе других биохимических превращений синтезируются такие важные для жизнедеятельности клетки соединения как аминокислоты, углеводы, жирные кислоты и др . Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций (рис. 10.9). Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и двух декарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула окса-лоацетата регенерируется.
90.
Дыхательная цепь является частью
процесса окислительного фосфорилирования
(см. с. 126). Компоненты дыхательной цепи
катализируют перенос электронов от
НАДН + Н+ или восстановленного убихинона
(QH2) на молекулярный кислород. Из-за
большой разности окислительно-восстановительных
потенциалов донора (НАДН + Н+ и,
соответственно, QH2) и акцептора (О2)
реакция является высокоэкзергонической
(см. с. 24). Большая часть выделяющейся
при этом энергии используется для
создания градиента протонов (см. с. 128)
и, наконец,дляобразования АТФ с помощью
АТФ-синтазы.
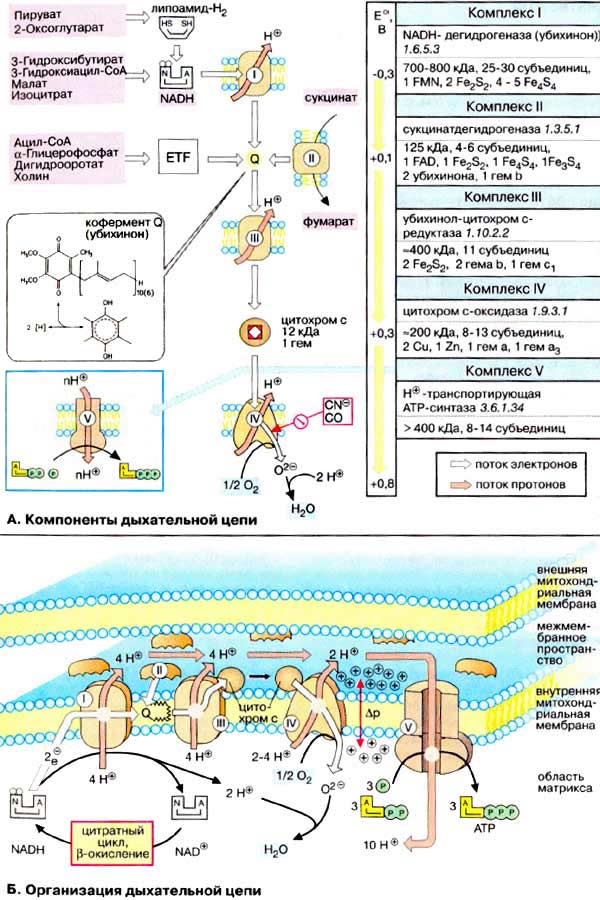
Дыхательная цепь включает три белковых комплекса (комплексы I, III и IV), встроенных во внутреннюю митохондриальную мембрану, и две подвижные молекулы-переносчики — убихинон (кофермент Q) и цитохром с. Сукцинатдегидрогеназа, принадлежащая собственно к цитратному циклу, также может рассматриваться как комплекс II дыхательной цепи. АТФ-синтаза (см. с. 144) иногда называется комплексом V, хотя она не принимает участия в переносе электронов.
Комплексы дыхательной цепи построены из множества полипептидов и содержат ряд различных окислительно-восстановительных коферментов, связанных с белками (см. сс. 108, 144). К ним принадлежат флавин [ФМН (FMN) или ФАД (FAD), в комплексах I и II], железо-серные центры (в I, II и III) и группы гема (в II, III и IV). Детальная структура большинства комплексов еще не установлена.
Электроны поступают в дыхательную цепь различными путями. При окислении НАДН + Н+ комплекс I переносит электроны через ФМН и Fe/S-центры на убихинон. Образующиеся при окислении сукцината, ацил-КоА и других субстратов электроны переносятся на убихинон комплексом II или другой митохондриальной дегидрогеназой через связанный с ферментом ФАДН2 или флавопротеин (см. с. 166), При этом окисленная форма кофермента Q восстанавливается в ароматический убигидрохинон. Последний переносит электроны в комплекс III, который поставляет их через два гема b, один Fe/S-центр и гем с1 на небольшой гемсодержащий белок цитохром с. Последний переносит электроны к комплексу IV, цитохром с-оксидазе. Цитохром с-оксидаза содержит для осуществления окислительно-восстановительных реакций два медьсодержащих центра (CuA и CuB) и гемы а и а3, через которые электроны, наконец, поступают к кислороду. При восстановлении О2 образуется сильный основной анион О2-, который связывает два протона и переходит а воду. Поток электронов сопряжен с образованным комплексами I, III и IV протонным градиентом. Перенос протонов комплексами I, III и IV протекает векторно из матрикса в межмембранное пространство. При переносе электронов в дыхательной цепи повышается концентрация ионов H+, т. е. понижается значение рН. В интактных митохондриях по существу только АТФ-синтаза (см. с. 144) позволяет осуществить обратное движение протонов в матрикс. На этом основано важное в регуляторном отношении сопряжение электронного переноса с образованием АТФ (см. с. 146).
Как уже упоминалось, все комплексы с I по V интегрированы во внутренней мембране митохондрий, тем не менее обычно они не контактируют друг с другом, так как электроны переносятся убихиноном и цитохромом с. Убихинон благодаря неполярной боковой цепи свободно перемещается в мембране. Водорастворимый цитохром с находится на внешней стороне внутренней мембраны.
Основное количество молекул АТФ вырабатывается по способу окислительного фосфорилирования на последней стадии клеточного дыхания: в электронтранспортной цепи. Здесь происходит окисление НАД∙Н и ФАДН2, восстановленных в процессах гликолиза, β-окисления, цикла Кребса и т. д.. Энергия, выделяющаяся в ходе этих реакций, благодаря цепи переносчиков электронов, локализованной во внутренней мембране митохондрий (у прокариот — в цитоплазматической мембране), трансформируется в трансмембранный протонный потенциал. Фермент АТФ-синтаза использует этот градиент для синтеза АТФ, преобразуя его энергию в энергию химических связей. Подсчитано, что молекула НАД∙Н может дать в ходе этого процесса 2.5 молекулы АТФ, ФАДН2 — 1.5 молекулы.
Конечным акцептором электрона в дыхательной цепи аэробов является кислород.
Разобщение Окисления И Фосфорилирования-состояние в митохондриях, когда процесс окисления и выделения свободной энергии протекает, а синтез АТФ не происходит. Возможно при воздействии некоторых веществ, нарушении структуры внутренних мембран митохондрий (например, при интенсивной физической разминке) и других факторах
91. Микросомальное окисление - совокупность реакций первой фазы биотрансформации ксенобиотиков и эндогенных соединений, катализирующихся ферментными системами мембран эндоплазматического ретикулума гепатоцитов при участии цитохрома Р-450. При дифференциальном центрифугировании эндоплазматический ретикулум оказывается в микросомальной фракции, поэтому эти реакции получили название микросомальных, а соответствующие ферменты - микросомальных оксигеназ.
Суть реакций заключается в гидроксилировании вещества типа R-H с использованием одного атома молекулы кислорода О2, второй атом соединяется с протонами водорода H+ с образованием воды. Донором протонов водорода является восстановленный NADPH + H+. Таким образом, меняется структура исходного вещества, а значит и его свойства, причём они могут как угнетаться, так и наоборот, усиливаться. Гидроксилирование позволяет перейти процессу обезвреживания ко второй фазе — реакциям конъюгации, в ходе которых к созданной функциональной группе будут присоединяться другие молекулы эндогенного происхождения.
Уравнение реакции: RH + O2 + NADPH + H+ → ROH + H2O + NADP+
Свободное окисление протекает при участии свободнорадикальных форм кислорода, которые образуются в процессе одноэлектронного восстановления кислорода и прежде всего супероксид-аниона кислорода.
Обычно эти реакции своднорадикального окисления протекают в активном центре соответствующих ферментов, а промежуточные продукты не появляются во внешней среде. При изменении условий функционирования дыхательной цепи (например, при гипоксии) в ней также возможно одно-электронное восстановление кислорода, объясняющееся тем, что его сродство к убихинону выше, чем к цитохромоксидазе. Эти процессы приводят к образованию супероксид-аниона кислорода. Этот радикал может образовываться и под влиянием ультрафиолетовых лучей, а также путем взаимодействия кислорода с ионами металлов переменной валентности (чаще всего с железом) или в ходе спонтанного окисления некоторых соединений, например дофамина. Наконец, он может продуцироваться в клетках и такими ферментами, как ксантиноксидаза или НАДФН-оксидаза.
Образование супероксид-аниона кислорода имеет важное биологическое значение. Он является высокореакционным соединением, которое вследствие высокой гидрофильности не может покидать клетку и накапливается в цитоплазме. Его превращения приводят к образованию ряда активных окислителей (рис. 9.10). Он способен активировать NO-синтазу, которая образует в тканях NO-радикал, обладающий свойствами вторичного посредника (активирует растворимую гуанилатциклазу, продукт которой – цГМФ – проявляет вазодилататорные свойства). С другой стороны, супероксид-анион способен снижать содержание NO-радикала, превращая его в пероксинитрит ONOOH
В биологических системах антиоксидантами называются вещества, способные ингибировать процессы свободнорадикального окисления. Для живых клеток наибольшую опасность представляет цепное окисление полиненасыщенных жирных кислот, или перекисное окисление липидов (ПОЛ). В реакциях ПОЛ образуется большое количество липидных гидроперекисей, которые обладают высокой реакционной способностью и оказывают мощное повреждающее действие на клетку1. В последнее время свободные радикалы и реакции с их участием считаются причиной возникновения: старения, раковых заболеваний, артрита, эмфиземы, атеросклероза, астмы, диабета, болезни Альцгеймера, болезни Паркинсона, катаракты и мн. др.
Защита организма от этих и многих других заболеваний - основная задача антиоксидантной системы2. Антиоксиданты предотвращают перекисное окисление липидов и не дают свободным радикалам накапливаться в организме. Однако, естественная антиоксидантная система организма часто оказывается перегруженной и буквально захлебывается лавиной свободных радикалов. Это состояние называется окислительным стрессом. Чаще всего окислительный стресс вызывается УФ излучением, которое не только индуцирует свободнорадикальное окисление, но и нарушает работу ферментных антиоксидантов кожи3 . По мнению ученых, антиоксидантные пищевые добавки и косметические средства могут предотвращать окислительный стресс и замедлять процессы старения4.
92. Для нормального функционирования клеток человеческого организма необходимо поддерживать постоянную внутреннюю среду - гомеостаз. Этот процесс осуществляется преимущественно деятельностью лёгких и почек за счёт дыхательной и выделительной функции. В основе гомеостаза лежит сохранение кислотно-основного баланса. В результате метаболизма белков образуются нелетучие кислоты, такие как серная и фосфорная. Для нормальной жизнедеятельности большинства клеток необходимы достаточно узкие пределы рН (6.9 - 7.8), и организм вынужден постоянно осуществлять нейтрализацию образующихся кислот. Этот процесс выполняют буферные системы, которые связывают избыток ионов водорода и контролируют их дальнейшие перемещения в организме. Регенерация буферных систем происходит в почках, освободившиеся ионы водорода экскретируются с мочой. Когда функция почек не нарушена, организму легко удаётся поддерживать оптимальную для себя рН - 7.4.
К механизмам регуляции кислотно-основного баланса относятся:
Система внешнего дыхания, обеспечивающая регуляцию содержания CO2
в крови. Так при увеличении кислотности крови, повышение содержания
ионов H+ приводит к возрастанию легочной вентиляции
(гипервентиляции), при этом молекулы CO2 выводятся в большом
количестве и pH возвращается к нормальному уровню. При увеличении
содержания оснований наступает гиповентиляция, в результате
напряжение CO2 и концентрация ионов H+ возрастают, и сдвиг реакции
крови в щелочную сторону частично или полностью компенсируется.
Роль почек - их функция состоит в удалении нелетучих кислот,
главным образом серной кислоты. Почки должны удалять в сутки 40-60
ммоль ионов H+, накапливающихся за счет образования нелетучих кислот.
Нарушения кислотно-основного баланса могут быть экзогенного или
эндогенного происхождения, тоесть возникать в следствии избыточного
или недостаточного поступления в организм кислых и щелочных
продуктов, либо в следствии черезмерного образования в организме и
нарушения выделения. Нарушение КОБ в кислую сторону называется
- ацидоз, в щелочную - алкалоз.
Ацидоз - нарушение кислотно-щелочного равновесия,
характеризующегося появлением в крови абсолютного или относительного
избытка кислот и повышением концентрации водородных ионов.(pH снижен)
Алкалоз - нарушение кислотно-щелочного равновесия, для которого
типично абсолютное или относительное увеличение количества оснований
и понижение концентрации водородных ионов (pH повышается).
По степени выраженности различают компенсированный и
некомпенсированный ацидоз и алкалоз. При компенсированных ацидозах и алкалозах буферные и физиологические системы организма, участвующие в нейтрализации и
выведении из организма кислых и щелочных продуктов, несмотря на
химические и функциональные сдвиги, обеспечивают поддержание pH в
пределах нормы. При истощении и недостаточности защитных механизмов
pH смещается за пределы нормы и развиваются некомпенсированные ацидоз и алкалоз. По механизму развития ацидозы и алкалозы делят на газовые
(дыхательные) и не газовые (обменные, метаболические).
Ацидоз.
1. Газовый (дыхательный) ацидоз развивается при увеличении
содержания в организме углекислоты. Его непосредственные причины:
а) недостаточность функции внешнего дыхания - снижение выведения
углекислоты из организма.
б) недостаточность кровообращения - в результате резкого
замедления кровотока затрудняется удаление углекислоты из крови.
в) вдыхание высоких концентраций углекислоты - замкнутые
помещения, шахты, подводные лодки.
2. не газовый (обменный, метаболический) ацидоз - самая частая и
очень тяжелая форма нарушения кислотно-щелочного баланса. В его
основе лежит накопление в организме нелетучих кислых продуктов.
Причинами развития не газового ацидоза являются:
Метаболического:
а) кетоз (кетоацидоз) - избыточное образование кислых продуктов
при нарушениях обмена веществ (сахарный диабет, гипоксия, голодание)
б) лактат-ацидоз в следствии нарушения обмена молочной кислоты
(инфекции, гипоксия, нарушение функций печени)
в) ацидоз при накоплении различных органических и неорганических
кислот (ожоги, обширные воспалительные процессы, травмы)
Выделительного:
а) нарушение выведения из организма кислых веществ при
недостаточности выделительной функции почек (нефриты, уремия)
б) потеря организмом большого количества оснований со щелочными
пищеварительными соками (диарея, гиперсаливация)
Алкалоз.
1. Газовый (дыхательный) алкалоз встречается при гипервентиляции,
когда из организма в избытке выводится углекислота (горная болезнь,
перегревание, анемии, черезмерное искуственное дыхание.
2. не газовый (обменный) алкалоз развивается при абсолютном или
относительном увеличении в организме количества щелочных соединений.
Его непосредственными причинами могут быть следующие факторы:
а) задержка щелочей (усиление реабсорбции щелочных анионов
(оснований) почками
б) потеря кислот (рвота при пилоростенозе, кишечная непроходимость
93. Организм человека почти на 70% состоит из воды. Вода - прежде всего растворитель, в среде которого протекают все элементарные акты жизнедеятельности. К тому же вода - продукт и субстрат энергетического метаболизма в живой клетке. Вода — участник множества метаболических реакций, в частности гидролиза. Она стабилизирует структуру многих высокомолекулярных соединений, внутриклеточных образований, клеток, тканей и органов, обеспечивает опорные функции тканей и органов, сохраняя их тургор, форму и положение (гидростатический скелет). Вода является носителем метаболитов, гормонов, электролитов; участвует в транспорте веществ через клеточные мембраны и сосудистую стенку в целом; участвует в регуляции осмоляльности жидких сред организма.
Поступление воды регулируется чувством жажды.Центр жажды находится в отдела ЦНС-гипоталамусе.В нем есть специальные детекторные нейроны,которые реагируют на изменение осматической концентрации внутренней среды(в норме 285 мосм на литр. Регуляция выведения воды обеспечивается гармональными мехэанизмами управления в почках:1)антидиуритический механизм-обеспечивается гармонном гипофиза-вазопресином.Этот гармон регулирует обратное всасывание воды в почечных канальцах, что обеспечивает формирование окончательной мочи.2)антинатрийуритический механизм-он обеспечивает реадсорбцию натрия из первичной мочи с помощью гармона коры надпочечников-альдостерона.
Вода распределяется по секторам:
1)внутриклеточный;2)внеклеточный(делится на внутрисосудный и интерстициальный.
Нарушения водного баланса :
-дегидратация(обезвоживание организма)при этом общее количество воды в организме является жесткой константой и потеря 7-10л может быть смертельной
-гипергидротация(оводнение)-однократное употребление большого количества жидкости может стать причиной смерти(перегрузка внутрисосудистого сектора,что приводит к резкому увеличению ОЦК и острой сердечной недостаточности.
Любое нарушение водного баланса сопровождается разнонаправленными изменениями осматической концентрации,т.е. дефицит или избыток воды сопровождается дефицитом или избытком электролитов.
94. Минеральные вещества играют исключительно важную роль в жизни живых организмов. Наряду с органическими веществами минералы входят в состав органов и тканей, а также участвуют в процессе обмена веществ.В общей сложности в организме человека определяется до 70 химических элементов. Из них 43 элемента являются абсолютно необходимыми для нормального протекания обмена веществ.
Все минеральные вещества, исходя от их количественного содержания в организме человека, принято разделять на несколько подгрупп: макроэлементы, микроэлементы и ультраэлементы.
Макроэлементы представляют собой группу неорганических химических веществ, присутствующих в организме в значительных количествах (от нескольких десятков граммов до нескольких килограммов). К группе макроэлементов относятся натрий, калий, кальций, фосфор и др.
Микроэлементы встречаются в организме в гораздо меньших количествах (от нескольких граммов до десятых долей грамма и менее). К таким веществам относятся: железо, марганец, медь, цинк, кобальт, молибден, кремний, фтор, йод и др. Особой подгруппой микроэлементов являются ультрамикроэлементы, содержащиеся в организме в исключительно малых количествах (золото, уран, ртуть и др.).
Минеральные (неорганические) вещества входящие в структуру организма выполняют множество важных функций. Многие макро и микроэлементы являются кофакторами ферментов и витаминов. Это значит, что без молекул минеральных веществ витамины и ферменты неактивны и не могут катализировать биохимические реакции (основная роль ферментов и витаминов). Активация ферментов происходит посредством присоединения к их молекулам атомов неорганических (минеральных) веществ, при этом присоединенный атом неорганического вещества становится активным центром всего ферментативного комплекса. Так, например, железо из молекулы гемоглобина способно связывать кислород, для того чтобы переносить его к тканям, многие пищеварительные ферменты (пепсин, трипсин) для активации требуют присоединения атома цинка и т.д.
Многие минеральные вещества являются незаменимыми структурными элементами организма – кальция и фосфор слагают основную массу минерального вещества костей и зубов, натрий и хлор являются основными ионами плазмы, а калий, в больших количествах содержится внутри живых клеток.
Вся совокупность макро и микроэлементов обеспечивает процессы роста и развития организма. Минеральные вещества играют важную роль в регуляции иммунных процессов, поддерживают целостность клеточных мембран, обеспечивают дыхание тканей. Поддержание постоянства внутренней среды (гомеостаза) организма, предусматривает в первую очередь поддержание качественного и количественного содержания минеральных веществ в тканях органах на физиологическом уровне. Даже небольшие отклонения от нормы могут повлечь самые тяжелые последствия для здоровья организма.
Гипокалиемия развивается вследствие уменьшения поступления калия с пищей,его перемещения в клетки или усиленного выведения. Симптомы гипокалиемии разнообразны и зависят от её тяжести Больные жалуются на утомляемость, слабость в ногах, миалгию . В тяжелых случаях наблюдаются парезы и параличи, нарушения дыхания, динамическая кишечная непроходимость. Гиперкалиемия возникает в результате выхода калия из клеток или нарушения выведения калия почками.
Кальций составляет основу костной ткани, нормализует обмен воды, хлорида натрия, углеводов, участвует в процессах передачи нервно-мышечного возбуждения, регулирует процессы свертывания крови, влияет на проницаемость клеточных мембран, уменьшает проницаемость стенок сосудов, активизирует некоторые ферменты, обладает противовоспалительным десенсибилизирующим действием, влияет на кислотно-щелочное равновесие организма, находится в биологическом антагонизме с ионами натрия и калия.
Усвоение кальция зависит от его соотношения в пищевом рационе с жирами и жирными кислотами, белками, кальциферолами, магнием, фосфором.
Из кишок кальций всасывается в виде комплексов с жирными и желчными кислотами. Оптимальным соотношением является 10-15 мг кальция на 1 г жира. Всасыванию кальция способствует достаточное содержание ненасыщенных жирных кислот. Недостаточное и избыточное количество жиров, особенно богатых насыщенными жирными кислотами (кулинарные жиры, баранье, говяжье сало и др.), ухудшают всасывание кальция. Избыточное количество жиров в рационе ведет к образованию невсасывающихся кальциевых мыл.
Недостаточное количество белка в рационе также ухудшает усвоение кальция. Всасывание кальция в кишках нарушается при дефиците кальциферолов, что приводит к использованию кальция костей.
95. Микроэлементы встречаются в организме в количествах от нескольких граммов до десятых долей грамма и менее. К таким веществам относятся: железо, марганец, медь, цинк, кобальт, молибден, кремний, фтор, йод и др. Особой подгруппой микроэлементов являются ультрамикроэлементы, содержащиеся в организме в исключительно малых количествах (золото, уран, ртуть и др.).
Железо является важнейшим микроэлементом, принимает участие в дыхании, кроветворении, иммунобиологических и окислительно-восстановительных реакциях, входит в состав более 100 ферментов. Железо является незаменимой составной частью гемоглобина и миогемоглобина.
В организме взрослого человека содержится около 4 г железа, из них более половины (около 2,5 г) составляет железо гемоглобина. Часть железа депонируется в организме человека, преимущественно в печени, селезенке и костном мозге.
Суточная потребность человека в железе составляет 10-30 мг, с учетом того, что всасывание железа из продуктов питания составляет около 10%.
Эта доза обеспечивается суточным пищевым рационом (15-40 мг) за счет животной и растительной пищи. Основными источниками железа служат: крупа, печень, мясо.
Всасывание поступившего с пищей железа происходит в кишечнике, но обычно не превышает 5-20% от общего содержания в пище. Значительно лучше железо всасывается из мясных продуктов (телятина - 17-21%, печень - 10-20%), из рыбных продуктов - 9-11%. Меньше всего железо всасывается из растительных продуктов (1-7%).
Добавка мяса в блюда, содержащие растительные продукты, значительно улучшает всасывание железа из них.
Недостаточность железа в организме может быть вызвана экзогенными (за счет недостаточно поступления с пищей) и эндогенными (за счет нарушения всасываемости в кишечнике: заболевания слизистой оболочки кишечника или понос) факторами.
Нарушение обмена и недостаточность железа в организме приводит к развитию железодефицитной анемии.
Биологические свойства йода многообразны. Йод обладает антивирусной и антибактериальной активностью, которая представляет важнейшую характеристику лекарственного антисептического препарата. Однако одним из самых важных проявлений биологической активности йода является функция его как микробиоэлемента, участвующего в синтезе жизненно необходимого гормона щитовидной железы. Биологическая роль йода заключается в обеспечении нормального состояния и функционирования щитовидной железы. Для нормального функционирования щитовидной железы суточное поступление йода должно составлять 150—200 мкг. В норме щитовидная железа аккумулирует примерно 15-20 % поступающего в организм йода, остальное его количество выводится с мочой. Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму) Так же при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Биологические функции катионов:
Структурообразующая: обусловлена комплексообразующими свойствами ме-таллов, катионы которых участвуют в образовании функционально активныхструктур макромолекул и надмолекулярных комплексов (гем, хлорофилл, белки,нуклеиновые кислоты и т.д.).
Транспортная: катионы в составе металлопротеидов участвуют в переносе
электронов или молекул простых веществ. Например, ионы железа и меди вхо-дят в цитохромы, которые переносят электроны, а железо в составе гемоглобинасвязывает и переносит кислород.
Регуляторная: ионы металлов, соединяясь с ферментами, влияют на активность катионов и регулируют (активируют или ингибируют) скорость химических реакций в клетке (Mg2+ активирует ДНК- и РНК-полимеразу, Ca2+ – креатинкиназу, Mg2+, Mn2+ – гексокиназу; ионы Mn2+, Zn2+, Co2+, Ni2+ ускоряют распад и син тез белков, а ионы Ca2+, Mg2+ участвуют в распаде и синтезе липидов и углеводов).
Осмотическая: катионы используются для регуляции осмотического и гидроосмотического давлений в клетке и организме в целом.
Биоэлектрическая: катионы участвуют в возникновении и регуляции величиныразности потенциалов на клеточных мембранах в возбудимых клетках (нервных,мышечных) и проведении нервных импульсов.
Синтетическая: связана с использованием неорганических катионов для синтеза сложных молекул, например, Fe3+ – в синтезе гемоглобина, Ca2+ – в синтезеамилазы. Cu2+, Mn2+, Zn2+, Co2+, Ni2+ поддерживают вторичную и третичнуюструктуру ДНК и РНК, Zn2+, участвуют в образовании активного центра 30ферментов.
96.Витамины обязательные компоненты пищевого рацитона.Витамины это органические,химические вещества которые не синтезируются в организме,но а бсолютно необходиымы для нормального роста,развития и метаболизма. Открыто около 30 витаминов и витаминоподобных веществ,но 20 из них для человека имеют жизненноважное знаечение.
Витамины отличаются по строению и подразделяются на:
-жирорастворимые(А,D,E,K)
-водорастворимые(витамины группы В,аскорбиновая кислота,РР,Р)
Общие свойства витаминов:-не синтезируются в организме и должны поступать в составе пищи;-дефицит витаминов в рационе формирует специфическую клиническую картину недостаточности данного витамина;-суточная потребность в витаминах невелика от 1мг до десятком мг;
Биологическая роль витаминов:все витамины включаются в метаболизм,витамины выступают в роли коферментов двух компонентных ферментов;из витаминов стероидных структур могут синтезироваться гармоны(D);ряд витаминов воздействует на биосистему полимеров(белков).
Формы нарушений витаминного баланса:
-авитаминоз(длительное полное отсутствие витаминов)
-гиповитаминоз-недостаточность одного или нескольких витаминов в организме
-гипервитаминозы(избыток того или иного витамина
Причины и механизмы нарушения витаминного баланса:
1)гиповитаминозы.Причины-недостаток витаминов в пище из за разбалансировки рациона;-подавление симбиотической микрофлоры;-нарушение всасывания витаминов в пищеварительном тракте;-употребление лекарств;-дефекты метаболизма витаминов.
20гипервитаминозы.Развиваются редко,но встречаются.Гипервитаминоз витамина D завершается летальным исходом младенцев.
97.Жирорастворимые витамины –это витамины А,D,E,K.
Витамин А- ретинол.Строение-особая форма спиртас длинным радикалом.Суточная потребность 1.5-2мг.Источники-растительная пища:морковь,тыква,перец,облипиха;животная пища-печень ,почки,молочные продукты. Витамин А необходим для роста и развитияи формирования скелета,учавствует в метаболизме кожи и слизистых. Дефицит витамина А приводит к поражению волос,кожы,слизистых, к гемеролания.
Витамин Д нормализует всасывание из кишечника солей кальция и фосфора, способствует отложению в костях фосфора и фосфата кальция (то есть укрепляет зубы) и препятствует заболеванию рахитом. Имеются также указания на роль витамина Д в определении ряда свойств мембран клетки и субклеточных структур, в частности их проницаемости для ионов кальция и других катионов. Высокое содержание витамина Д — в зародышах зерновых, зеленых листьях, пивных дрожжах, рыбьем жире. Богаты им яйца, сливочное масло, молоко. Провитамин Д содержится в белокочанной капусте и в небольшом количестве — в моркови. Из-за недостатка витамина Д в кишечнике нарушается всасывание кальция и отложение его в костях. Как следствие – истончение и размягчение костных тканей, ухудшение работы нервной системы, внутренних органов.
Витамин Е — токоферол. Физиологическое значение. Оно заключается в его антитоксическом действии на внутриклеточные липидные (жиры). Окисление внутриклеточных липидов обусловливает образование токсических для клетки веществ из расщепленных ненасыщенных жирных кислот. Они могут привести к нарушению функции клетки и затем к ее гибели. Эти токсические вещества подавляют действие ферментов и витаминов. Витамин Е тесно связан с состоянием и функцией биологических мембран, а также препятствует разрушению эритроцитов. Важнейшим свойством токоферолов является их способность повышать накопление во внутренних органах жирорастворимых витаминов, особенно А. Суточная потребность взрослых в витамине Е примерно 12—15 мг. Им богаты растительные масла, зародыши злаков, зеленые овощи. Дефицит витамина Е вызывает проблемы с репродукцией; неврологические нарушения, включая ослабление рефлексов, слабость конечностей, потерю чувствительности в руках и ногах и трудности с ходьбой; иммунологические нарушения; и гемолитическую анемию (разрушение эритроцитов).
К витаминам группы К относятся природные вещества — витамин K1 (филлохинон) и витамин К2 (мелахинон). Свое название витамин К получил от слова «коагуляция» (свертываемость) . Физиологическое значение. Эти витамины участвуют в процессах свертывания крови. Также проявляют анаболитическое действие путем участия в продукции АТФ, что важно в нормальном энергообеспечении организма. Вообще в витамине К нуждается каждая клетка организма, поскольку он имеет большое значение для сохранения структурных, функциональных свойств клеточных мембран и органелл. Дефицит витамина может привести к следующему: обильные внутренние кровоизлияния, окостенение хрящей, серьёзная деформация развивающихся костей или отложения солей на стенках артериальных сосудов.
