
- •5Аминокислоты – производные карбоновых кислот или жирных кислот. Общая форма аминокислоты:
- •Ферменты поджелудочной железы. Поджелудочная железа является основной железой в системе пищеварения. Она секретирует ферменты в просвет двенадцатиперстной кишки.
- •86. Механизмы использования гликогена клетками.Синтез и фосфоролиз гликогена в печени.Понятие об анаэробном гликолизе и гликогенолизе.Энергитическая эффективность гликолиза.
- •98. Водорастворимые витамины это витамины группы в,аскорбиновая кислота,рр,р.
- •99. Водорастворимые витамины это витамины группы в,аскорбиновая кислота,рр,р.
- •Нейросекреторные клетки гипоталамуса:
1Биохимия – Наука о молекулярной сущности жизни. Она занимается: 1)Изучением химического состава живых существ; 2)исследует превращения этих химических веществ в организме; 3)связь превращений веществ с деятельностью клеток, тканей, органов и организма в целом. Главной задачей биохимии является установление связи между молекулярной структурой и биологической функцией химических компонентов живых органов. В зависимости от объекта исследования биохимию условно подразделяют на биохимию человека и животных, биохимию растений, биохимию микроорганизмов. Становление биохимии проходило постепенно, и развитие ее укладывается в следующую логическую цепочку: 1)статистическая биохимия; 2)динамическая биохимия; 3)физиологическая биохимия. Основное назначение биохимии сводится к тому, чтобы решать на молекулярном уровне общебиологические задачи.
2ЭЛЕМЕНТНЫЙ СОСТАВ ОРГАНИЗМА ЧЕЛОВЕКА. Большинство биомолекул состоят в основном из углерода, кислорода, водорода и азота. Важным компонентом нуклеиновых кислот и других молекул является фосфат. Ключевую роль в многочисленных биологических процессах играет кальций. Так же в состав биомолекул входят: калий, сера, натрий, хлор, магний, железо, марганец, йод. ОСНОВНЫЕ КЛАССЫ ПРИРОДНЫХ БИОМОЛЕКУЛ. Основными сложными биомолекулами, присутствующими в клетках и тканях высших животных, включая человека, являются ДНК, РНК, белки, полисахариды и липиды. Эти сложные молекулы построены из простых биомолекул. Строительными блоками ДНК и РНК служат дезоксирибонуклеотиды и рибонуклеотиды. Строительными блоками белков являются аминокислоты. Полисахариды построены из простых углеводов; в частности, гликоген построен из глюкозы. Строительными блоками липидов можно считать жирные кислоты, хотя липиды и не являются полимерами жирных кислот. ДНК, РНК, белки и полисахариды называют биополимерами, поскольку они состоят из повторяющихся строительных блоков (мономеров). ХИМИЧЕСКИЙ СОСТАВ ОРГАНИЗМА ЧЕЛОВЕКА. Основными компонентами являются белки, жиры, углеводы, вода и минеральные вещества; при этом наибольшая часть приходится на долю воды, хотя ее содержание в разных тканях существенно различается. Вода—это полярное соединение, способное образовывать водородные связи; именно благодаря этим своим свойствам она является идеальным растворителем в организме человека.
3Несмотря на биохимическое единство всего живого, существуют и коренные различия как химического состава, так и обмена веществ в животных и растительных организмах. Обмен веществ, или метаболизм – это совокупность всех химических реакций, протекающих в организме и направленных на сохранение и самовоспроизведение живых систем. Растения строят сложные органические вещества из таких простых, как вода, углекислый газ и минеральные вещества; энергия, необходимая для этой деятельности, образуется за счет поглощения солнечных лучей в процессе фотосинтеза. Животные организмы нуждаются в пище, состоящей не только из воды и минеральных компонентов, но содержащей белки, жиры и углеводы; проявления жизнедеятельности и синтез веществ обеспечиваются за счет химической энергии, освобождающейся при распаде сложных органических соединений. Анаболизм — это совокупность процессов биосинтеза органических веществ, компонентов клетки и других структур органов и тканей. Анаболизм обеспечивает рост, развитие, обновление биологических структур, а также непрерывный ресинтез макроэргических соединений и их накопление.Катаболизм — это совокупность процессов расщепления сложных молекул, компонентов клеток, органов и тканей до простых веществ и до конечных продуктов метаболизма (с образованием макроэргических и восстановленных соединений).
4Биохимическая термодинамика, занимается изучением энергетических превращений, сопровождающих биохимические реакции. Небиологические системы могут совершать работу за счет тепловой энергии, биологические же системы функционируют в изотермическом режиме и для осуществления процессов жизнедеятельности используют химическую энергию.
СВОБОДНАЯ ЭНЕРГИЯ И ЗАКОНЫ ТЕРМОДИНАМИКИ. Организм человека является открытой термодинамической системой. Изменение свободной энергии (ΔG) — это та часть изменения внутренней энергии системы, которая может превращаться в работу, в химических системах ее называют химическим потенциалом. Первый закон термодинамики гласит: внутренняя энергия системы вместе с ее окружением остается постоянной. Она утверждает, что при любых изменениях системы внутренняя энергия не утрачивается и не приобретается. Вместе с тем внутри рассматриваемой системы энергия может переходить от одной ее части к другой или превращаться из одной формы в другую. Второй закон термодинамики гласит: энтропия системы при самопроизвольных процессах возрастает. Энтропия служит мерой неупорядоченности, хаотичности системы и достигает максимума, когда система приходит в истинное равновесие. При постоянных температуре и давлении соотношение между изменением свободной энергии системы (ΔG) и изменением энтропии (ΔS) представляется следующим выражением, которое объединяет оба закона термодинамики: ΔG = ΔН — ТΔ S, где ΔН—изменение энтальпии (теплоты), Т— абсолютная температура. В условиях, при которых протекают биохимические реакции, ΔН приблизительно равно ΔЕ— изменению внутренней энергии системы в результате реакции. В этих условиях приведенное выше выражение можно записать в виде
ΔG = ΔЕ — TΔS.
Если ΔG отрицательно, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии. Гомеоста́з — саморегуляция, способность открытой системы сохранять постоянство своего внутреннего состояния посредством скоординированных реакций, направленных на поддержание динамического равновесия. Организм человека должен обладать гомеостазом, чтобы сохранять стабильность и существовать. Гомеостаз в организме млекопитающих осуществляет следующие функции: регуляция количества минеральных веществ и воды в теле, удаление отходов процесса обмена веществ, регуляция температуры тела, регуляция уровня глюкозы в крови
5Аминокислоты – производные карбоновых кислот или жирных кислот. Общая форма аминокислоты:
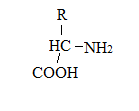 ,
отличаются друг от друга радикалом R.
,
отличаются друг от друга радикалом R.
Для классификации аминокислот используют: 1)деление аминокислот по структуре радикала: а) аминокислоты, у которых радикал представляет собой углеродную цепочку, например: аланин; б)циклические (ароматические) аминокислоты, например: фенил-аланин; в)серосодержащие аминокислоты, например: цистеин; в) оксиаминокислоты, например: серин; 2)функциональные группы аминокислот могут придавать им иные кислотные свойства: а)нейтральные аминокислоты: содержат одну λ-аминокислоту и одну λ-карбоксильную группу, данная кислота амфотерна, буферна; б)основные аминокислоты: есть дополнительная аминогруппа; в) кислые аминокислоты: есть дополнительная карбоксильная группа. Свойства аминокислот: 1) λ-аминные и λ-карбоксильные группы аминокислот выполняют пластическую функцию (формирование пептидной связи);2)образование положительного и отрицательного зарядов в процессе диссоциации;3)обладают стереохимическими свойствами. Функциональные группы аминокислот способны взаимодействовать с рядом реактивов, приводя к образованию окрашенных соединений.
6Аминокислоты в организме выолняют:1)пластическую функцию: а) по мере поступления в организм используются для построения белков; б)из аминокислот синтезируются биологически активные соединения;2)энергетическая функция: аминокислоты подвергаются окислительному распаду, что дает энергию. Аминокислоты могут подвергаться декарбоксилированию (отщепление), это приводит к тому, что образуются амины, некоторые из которых относятся к категории биополимерных аминов. Гистедин →гистамин (медиатор боли), триптофан→серотанин (медиатор аллергии, обеспечивает передачу нервных импульсов), фенил-аланин→холанины, дофалин, адреналин (медиаторы нервной системы). Аминокислоты могут образовывать короткие пептиды. Гармоны щетовидной железы – производные аминокислот.
7В состав белков входят аминокислоты, методами гидролиза может быть изучен аминокислотный состав белков. При гидролизе белка, не содержащего примесей освобождаются 20 различных λ-аминокислот. Все другие открытые в тканях животных, растений и микроорганизмов (более 300) существуют в природе в свободном состоянии, либо в виде коротких пептидов или комплексов с другими веществами. Все аминокислоты, входящие в состав природных белков, являются λ-аминокислотами. Аминокислоты:1)заменимые (могут быть синтезированы из других аминокислот);2)незаменимые (не могут быть синтезированы из других аминокислот). На сегодняшний день известно свыше 20 аминокислот, которые принято делить на заменимые (синтезируются в организме человека), частично заменимые (эти аминокислоты могут быть синтезированы организмом из других аминокислот) и незаменимые (поступают в организм только извне с пищей). К первой группе относятся такие аминокислоты, как аланин (источник энергии), аспарагиновая кислота (улучшает усвоение минералов), цистин (мощный антиоксидант), глутаминовая кислота (уменьшает тягу к алкоголю и сладостям) и глютамин (важнейший источник энергии), глицин, орнитин (способствует выработке гормона роста), пролин (полезен при лечении травм), серин (участвует в процессе обновления клеток), таурин (помогает поглощению жиров, имеет антиоксидантные свойства, снижает уровень холестерина). К частично заменимым аминокислотам относятся аргинин, цистеин и тирозин. Развитие мускулатуры, нормализация веса, заживление ран, а также регуляция работы вилочковой железы и улучшение иммунной функции связаны с выработкой такой аминокислоты, как аргинин. Он же участвует в выработке гормонов роста и интенсификации сперматогенеза. L-аргинин способствует улучшению настроения, делает человека более активным и выносливым, он используется для увеличения очистительных возможностей почек по выведению конечных продуктов азотистого обмена, а также он увеличивает скорость зарастания повреждённых тканей, растяжений сухожилий, переломов кости. Цистеин — антиоксидантная аминокислота, тирозин — кислота-антидепрессант, к тому же он способствует уменьшению количества жировых запасов в организме. Незаменимыми для человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин. Действие аминокислот связано с их способностью проникать во все органы и ткани организма.На сегодняшний день известно свыше 20 аминокислот, которые принято делить на заменимые (синтезируются в организме человека), частично заменимые (эти аминокислоты могут быть синтезированы организмом из других аминокислот) и незаменимые (поступают в организм только извне с пищей).К первой группе относятся такие аминокислоты, как аланин (источник энергии), аспарагиновая кислота (улучшает усвоение минералов), цистин (мощный антиоксидант), глутаминовая кислота (уменьшает тягу к алкоголю и сладостям) и глютамин (важнейший источник энергии), глицин, орнитин (способствует выработке гормона роста), пролин (полезен при лечении травм), серин (участвует в процессе обновления клеток), таурин (помогает поглощению жиров, имеет антиоксидантные свойства, снижает уровень холестерина). К частично заменимым аминокислотам относятся аргинин, цистеин и тирозин. Развитие мускулатуры, нормализация веса, заживление ран, а также регуляция работы вилочковой железы и улучшение иммунной функции связаны с выработкой такой аминокислоты, как аргинин. Он же участвует в выработке гормонов роста и интенсификации сперматогенеза. L-аргинин способствует улучшению настроения, делает человека более активным и выносливым, он используется для увеличения очистительных возможностей почек по выведению конечных продуктов азотистого обмена, а также он увеличивает скорость зарастания повреждённых тканей, растяжений сухожилий, переломов кости. Цистеин — антиоксидантная аминокислота, тирозин — кислота-антидепрессант, к тому же он способствует уменьшению количества жировых запасов в организме.Незаменимыми для человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин. Действие аминокислот связано с их способностью проникать во все органы и ткани организма.
8На сегодняшний день известно свыше 20 аминокислот, которые принято делить на заменимые (синтезируются в организме человека), частично заменимые (эти аминокислоты могут быть синтезированы организмом из других аминокислот) и незаменимые (поступают в организм только извне с пищей). К первой группе относятся такие аминокислоты, как аланин (источник энергии), аспарагиновая кислота (улучшает усвоение минералов), цистин (мощный антиоксидант), глутаминовая кислота (уменьшает тягу к алкоголю и сладостям) и глютамин (важнейший источник энергии), глицин, орнитин (способствует выработке гормона роста), пролин (полезен при лечении травм), серин (участвует в процессе обновления клеток), таурин (помогает поглощению жиров, имеет антиоксидантные свойства, снижает уровень холестерина). К частично заменимым аминокислотам относятся аргинин, цистеин и тирозин. Развитие мускулатуры, нормализация веса, заживление ран, а также регуляция работы вилочковой железы и улучшение иммунной функции связаны с выработкой такой аминокислоты, как аргинин. Он же участвует в выработке гормонов роста и интенсификации сперматогенеза. L-аргинин способствует улучшению настроения, делает человека более активным и выносливым, он используется для увеличения очистительных возможностей почек по выведению конечных продуктов азотистого обмена, а также он увеличивает скорость зарастания повреждённых тканей, растяжений сухожилий, переломов кости. Цистеин — антиоксидантная аминокислота, тирозин — кислота-антидепрессант, к тому же он способствует уменьшению количества жировых запасов в организме. Незаменимыми для человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин. Действие аминокислот связано с их способностью проникать во все органы и ткани организма.На сегодняшний день известно свыше 20 аминокислот, которые принято делить на заменимые (синтезируются в организме человека), частично заменимые (эти аминокислоты могут быть синтезированы организмом из других аминокислот) и незаменимые (поступают в организм только извне с пищей).К первой группе относятся такие аминокислоты, как аланин (источник энергии), аспарагиновая кислота (улучшает усвоение минералов), цистин (мощный антиоксидант), глутаминовая кислота (уменьшает тягу к алкоголю и сладостям) и глютамин (важнейший источник энергии), глицин, орнитин (способствует выработке гормона роста), пролин (полезен при лечении травм), серин (участвует в процессе обновления клеток), таурин (помогает поглощению жиров, имеет антиоксидантные свойства, снижает уровень холестерина). К частично заменимым аминокислотам относятся аргинин, цистеин и тирозин. Развитие мускулатуры, нормализация веса, заживление ран, а также регуляция работы вилочковой железы и улучшение иммунной функции связаны с выработкой такой аминокислоты, как аргинин. Он же участвует в выработке гормонов роста и интенсификации сперматогенеза. L-аргинин способствует улучшению настроения, делает человека более активным и выносливым, он используется для увеличения очистительных возможностей почек по выведению конечных продуктов азотистого обмена, а также он увеличивает скорость зарастания повреждённых тканей, растяжений сухожилий, переломов кости. Цистеин — антиоксидантная аминокислота, тирозин — кислота-антидепрессант, к тому же он способствует уменьшению количества жировых запасов в организме.Незаменимыми для человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин. Действие аминокислот связано с их способностью проникать во все органы и ткани организма
9Общие пути метаболизма предполагают отщепление от аминокислоты либо аминогруппы (дезанимнирование), либо отщепление от аминокислоты карбоксильной группы (декарбоксилирование). Дезаминирование. После отщепления аминогруппы от аминокислоты остается ее углеродный скелет (карбоновая кислота с ее карбоксильной группой) и эта карбоновая кислота либо подвергается распаду, путем включения в цикл трикарбоновых кислот (ЦТК). Ряд углеродных скелетов аминокислот могут быть вовлечены в процесс глюкогена, т.е. процесс синтеза глюкозы из аминокислот. В биологических системах выявлены 4 вида дезаминирования аминокислот: 1) Восстановительное дезаминирование. Обеспечивается путем присоединения к аминокислоте водорода и отщеплению аминогруппы. 2) Гидролитическое дезаминирование, в ходе которого молекула воды присоединяется к аминокислоте, отщипляется аминогруппа. 3) Внутримолекулярное дезаминирование – отщепление аминогруппы и появление двойной связи. 4) В организме человека представлено окислительное дезаминирование, в ходе которого к аминокислоте присоединяется 1 атом кислорода и она превращается в кетокислоту с выделением аммиака. Трансаминирование. В реакцию взаимодействия всегда вступают 2 аминокислоты. Смысл трансдезаминирования заключается в том, что аминогруппа с аминокислотой переносится на α-кетоглюторат и образовавшаяся при этом глютаминовая кислота подвергается окислительному дезаминированию – освобождается аммиак, а глютомат превращается в α-кетоглюторат и он снова может обеспечить трансаминирование другой кислоты. Катализ реакции трансаминирования осуществляется ферментами (трансаминазами).
10Общие пути метаболизма предполагают отщепление от аминокислоты либо аминогруппы (дезанимнирование), либо отщепление от аминокислоты карбоксильной группы (декарбоксилирование). Декарбоксилирование аминокислот сводится к отщеплению карбоксильной группы (α-декарбоксилирование). Эта реакция катализируется специфическиме декарбоксилазами аминокислот, т.е. для каждой аминокислоты есть своя декарбоксилаза, специфичность которой обеспечивается белковой частью фермента. В качестве кофермента выступает пиридоксальфосфат. Эти реакции характеризуются общими механизмами, но при декарбоксилировании различных аминокислот образуются биогенные амины, обладающие различной функциональной активностью и исполняющие важные роли.
В организме у человека биогенные амины образуются при декарбоксилировании следующих аминокислот: триптофан – триптанин, окситриптофан – серотонин.
11Основное количество фенилаланина расходуется по 2 путям: включается в белки, превращается в тирозин. Превращение фенилаланина в тирозин прежде всего необходимо для удаления избытка фенилаланина, так как высокие концентрации его токсичны для клеток. Образование тирозина не имеет большого значения, так как недостатка этой аминокислоты в клетках практически не бывает. Основной путь метаболизма фенилаланина начинается с его гидроксилирования, в результате чего образуется тирозин. При наличии блока метаболизма развивается тяжелая генетическая патология (фенилкетонурия). Блок метаболизма на пути синтеза меланина: клинические проявления сводятся к той или иной форме альбинизма. Возможно нарушение метаболизма в процессе окислительного распада тирозина: в организме накапливается кислота, которая конденсируется в полимер, называемый алкаптоном. Он плохо выводиться из организма с мочой. Алкаптон накапливается в хрящевых тканях, формируя их окрашивание. У таких людей кончики ушей и носа коричнего цвета.
12Глицин метаболически весьма активен, его пути превращения сводятся к следующему: глицин может быть подвергнут катаболизму (расщиплению), но в этом случае он не явдляется источником энергии, а ценность катаболизма в том, что оставшиеся после дезаминирования и декарбоксилирования одноуглеродистый фрагмент присоединяется к активному носителю, который выступает в роли поставщика этого одноуглеродистого фрагмента для синтеза аминокислоты метилаланина и нуклеотидов.
Глицин играет важную роль в синтезе оксикислот. Из глицина может быть синтезирован серин или тирозин. Глицин необходим для синтеза гемоглобина, креатина.
Серин. Большая часть серина в фосфопротеинах находится в форме
О-фосфосерина. Серин участвует в синтезе сфингозина. н участвует также в синтезе пуринов и пиримидинов. β-Углерод является источником метальных групп тимина (и холина) и атомов углерода в положениях 2 и 8 пуринового ядра.
Треонин в реакциях переаминирования не участвует; его D-изомер и соответствующая α-кетокислота млекопитающими не усваиваются. В ряде белков треонин находится в форме О-фосфотреонина.
13Дикарбоновые аминокислоты метаболически весьма активные аминокислоты, которые участвуют в метаболизме других аминокислот, в инактивации аминного азота, синтезе биологически активных соединений (ГАНК, глютотеон, производные кетакислоты являются компонентами цикла трикарбоновых кислот).Из триптофана синтезируется серотонин, так же может синтезироваться структурный компонент кофермента, называемый НАД, витамин РР (никотиновая кислота). Триптофан участвует в синтезе НАДа уменьшает потребность в организме витамина РР. При дефиците этого витамина развивается пеллагра – слабоумие, понос и воспаление). При карбоксилировании гистадина образуется гистамин. Гистамин обладает широким спектром биологической активности. Главным источником гистамина в организме являются клетки соединительной ткани, именуемые «тучными». При раздражении этих клеток происходит дегрануляция лаброцитов и освобождаемый гистамин выделяется в окружающие ткани. Гистамин изменяет проницаемость кровеносных сосудов и способствует развитию локального отека. Данный феномен происходит при воспалении и участвует в формировании спусковой стадии воспаления. Аналогичные гистаминовые механизмы формируются при аллергических реакциях, именуемых гиперчувствительностью немедленного типа (ГНТ). В очаге воспаления или при ГНТ гистамин вступает в роли медиатора боли или зуда. Гистамин влияет на функции слизистых оболочек пищеварительного тракта (стимулирует секрецию соляной кислоты в желудке)
14В организме обнаружены три серосодержащие аминокислоты (метионин, цистеин и цистин), метаболически тесно связанные друг с другом. Взаимодействие 2 молекул цистеина приводит к образованию аминокислоты – цестина, эта реакция является окислительно-восстановительной. В результате этой реакции формируется дисульфидная связь, которая образуется в молекулах белков, закрепляя их трипептидную стуктуру. Цистеин входит в состав глютотеона и его –SH- группа обусловливает способность глютотеона к участию в окислительно-восстановительных реакциях. Глютотеон благодаря своим способностям к окислительно-восстановительным превращениям участвует в формировании активно действующих ферментов и регулирует их активность. Он может способствовать разрыву дисульфидных связей в молекулах белка, в частности, к этому сводится механизм инактивации инсулина, поскольку под воздействием глютетеона разрываются дисульфидные мостики между 2 полипептидными цепями. Сера, входящая в состав серосодержащих аминокислот, взаимозаменяема, т.е. она используется при взаимопревращениях этих аминокислот. Очень высокой активностью обладает метионин, который содержит –S-CH3- группу. Метеонин может вступать в реакцию взаимодействия с АТФ, образуя соединение S-аденозилметионин.
Метаболизм аминокислот с разветвленной цепочкой. Речь идет о 3 аминокислотах.: лейцин, изолейцин, валин. Эти аминокислоты помимо участия в формировании полипептидных цепочек, подвергаются окислительному декарбоксилированию с участием высокоспецифичных ферментов. В отдельных случаях возможны генетические дефекты катаболизма этих аминокислот, которые проявляются в формировании заболевания «болезнь клинового сиропа» Моча пахнет кленовым сиропом.
15Белок
или протеин – высокомолекулярное
азотосодержащее вещество органическое
вещество, молекулы которых построены
из аминокислот. Живая природа отличается
рядом свойств:1)разнообразие строения
живых существ;2)живые системы способны
к воспроизведению себе подобных;3)способность
к движению;4)обновление составных частей.
Для каждой живой системы характерен
свой набор белков, например: а)кишечная
палочка – примерно 3000 белков, все из
них построены из двадцати
λ-аминокислот;б)человек – примерно
100тысяч белков. В природе обнаружено
![]() белков, все из них построены из двадцати
λ-аминокислот. Все аминокислоты линейно
последовательны в белках, линейная
последовательность аминокислот
закодирована в ДНК.
белков, все из них построены из двадцати
λ-аминокислот. Все аминокислоты линейно
последовательны в белках, линейная
последовательность аминокислот
закодирована в ДНК.
16Функции белков: 1)каталитическая – способность белков ускорять достижение равновесия химической реакции; 2)транспортная – участие белков в переносе молекул различной степени сложности; 3)защитная – белки нейтрализуют агрессивное воздействие веществ; 4)сократительная – способность специализированных белков изменять свои линейные параметры, или длину; 5)структурная (пластическая) – формирование структуры каждой клетки и ее органеллы, формирование основ ткани и органов; 6)гормональная (регуляторная) – обеспечение регуляторных воздействий в клетках и тканях; 7)питательная – белки могут быть использованы в виде трофического источника; 8)энергетическая – белковая молекула, отработав свой ресурс, подвергается деполяризации и освободившиеся аминокислоты вовлекаются в окислительный распад; энергетическая ценность 1 гр. Белка = 4,1 кКалл.
17Микроорганизмы, растения и животные отличаются по количеству белков в клетках, больше всего в животных тканях. Белки отличаются по аминокислотному составу, и чем сложнее организм, тем выше требования к соблюдению аминокислотного состава. Количественное отличие по содержанию белков предопределяет пищевую ценность данного источника белка, например: из 100 гр. мяса получается 20 гр. белка. Элементарный состав белков: углерод, кислород, водород, азот, сера.
18 Белки представляют собой сложные полипептиды, в которых отдельные аминокислоты связаны друг с другом пептидными связями, возникающими при взаимодействии –COOH и NH2-.

1)запись начинается с N-концевой аминокислоты, т.е. с той, которая имеет свободную аминогруппу, другой конец представлен С-концевой аминокислотой; 2)название полипептида начинается с названия N-концевой аминокислоты, далее добавляется последовательно С-концевая; конец первой меняется с «ин» на «ил».
19Под первичной структурой белка любого биополимера подразумевают последовательность соединения мономеров. Алгоритм определения первичной структуры белка:1)выделить свободную полипептидную цепь:
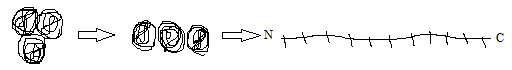
2)гидролиз цепи: узнать, из каких частей она состоит;3)последовательное отщепление аминокислот с любого конца. Характеристика первичной структуры белка: 1)первичная структура белка уникальна и генетически детерминирована: каждая белковая молекула имеет строго определенную последовательность аминокислот;2) стабильность первичой структуры обеспечивается ковалентными пептидными связями;3) полипептидная связь может быть сформирована разнообразными комбинациями аминокислот.
20Под вторичной структурой белка подразумевают конфигурацию полипептидной цепи, т.е. способ свертывания, скручивания полипептидной цепи в спиральную или какую-либо другую конфигурацию. Процесс этот не хаотичен. Две основные конфигурации полипептидных цепей: 1) λ-спираль: отдельные участки цепи закручиваются по часовой стрелке, выявляется ряд закономерностей: а) на каждый виток приходится 3,6 аминокислотных остатка; б) через каждые пять витков (18 аминокислот) конфигурация спирали повторяется; 2) β-структура: две или более линейные полипептидные цепи располагаются параллельно, между ними формируются водородные связи, в образовании которых участвует N-, H-, CO- группы. Надвторичные структуры (домены) – отдельные участки полипептидной цепи, обладающие собственной вторичной структурой, и и связанные между собой в своеобразные функциональные комплексы.
21полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Различают две основные формы третичных конфигураций, это Т-форма – напряженная форма и R-форма – расслабленная форма; эти формы могут взаимопереходить друг в друга, образуя на каком-то этапе трансформации оптимальную третичную конфигурацию. Полипептидная цепь предопределяет особенность третичной структуры, однако в некоторых случаях было обнаружено, что практические одинаковые полипептиды образуют различные трехмерные структуры; полипептиды с разными последованиями аминокислот имеют одинаково последовательную структуру.
22Под четвертичной структурой белка подразумевают объединение отдельных полипептидных цепей, каждая из которых обладает первичной структурой, вторичной структурой, третичной структурой в единую функционально-активную молекулу, обеспечивающую ту или иную функцию, например: молекула гемоглобина. В биосистемах четвертичная структура чаще построена из четного числа субъединиц (по отдельности которые не обладают биологической активностью). Многие из ферментов построены с использованием четвертичной структуры. Для отдельных органов и тканей характерно наличие ферментов, состоящих из субъединиц в различных соотношениях; на основании этого было выяснено явление изофермии ферментов, и доказана диагностическая значимость определения активности изомеров при патологии тех или иных органов.
23В соответствии с функциональным принципом выделяют 12 классов белков: 1)белки-ферменты;2) белки-гармоны;3) белки-регуляторы;4) защитные белки;5) транспортные белки;6) сократительные белки;7) рецепторные;8) таксические;9) мембранные;10) белки вирусных оболочек;11) ингибиторы-ферменты;12) с иными функциями. В зависимости от химического состава:1)простые (состоят из аминокислот); 2)сложные (состоят из простого белка и небелкового компонента).
24Физико-химические свойства белков: 1)белки амфотерны; 2)способны к буферному взаимодействию; 3)имеют заряд на молекуле белка; 4)явление светорассеяния – используется при количественном определение белков; 5)гидрофильность белка – формирование онкатического давления; 6)белки не способны к диффузии. Молекулярная масса белков: определение молекулярной массы проводится физико-химическими методами, к которым относят: а)седиментационныйанализ; б)дихромотографию; в)электрофорез. Современные методы диэлектрофореза позволяют достаточно точно и бычтро определить молекулярную массу белка по скорости его миграции. В тех случаях, когда известен молекулярный состав белка, его молекулярную массу определяют исходя из молекулярного веса конкретных аминокислот.
25Природные белковые тела наделены определенной, строго заданной пространственной конфигурацией и обладают рядом характерных физико-химических и биологических свойств при физиологических значениях температуры и pH среды. Под влиянием различных химических и биологических факторов белки подвергаются свертыванию и выпадают в осадок, теряя нативные свойства. Денатурация – нарушение общего плана уникальной структуры нативной молекулы белка, преимущественно ее третичной структуры, приводящее к потере характерных для нее свойств. Большинство белков денатурирует при нагревании их растворов выше 50 – 60 градусов по цельсию. Наиболее прочные – пептидные связи, закрепляющие первичную структуру, расщепление их происходит при сильном изменении условий среды. Так же денатурацию могут вызвать кислоты и щелочи высокой концентрации, концентрированные растворы неорганических солей и органических соединений. На первых этапах денатурации возможно восстановление исходной структуры – ренатурация. Суммарный заряд на молекуле белка придает ей устойчивость. Как правило, белок имеет тот или иной заряд, изменение кислотности среды нейтрализует заряд на белковой молекуле вплоть до полного его исчезновения, это состояние – изоэлектрическая точка.
26Наиболее часто встречаемые простые белки животных тканей – альбумины и глобулины, протамины и гистоны. Альбумины растворимы в дистиллированной воде, а глобулины нет, что связано с молекулярной массой их: у альбуминов 40 – 70 тысяч, у глобулинов 150 и более тысяч. Синтез белков плазмы крови осуществляется в печени, в моноцитах крови. В плазме крови: альбумины 40 - 60 г/л, глобулины 20 - 40 г/л, фибрины 2 – 4 г/л. Фибрин в неактивной плазме представляет собой глобулярный белок, но при запуске механизма свертывания он превращается в фибрин. Альбумины формируют в плазме крови онкатическое давление (метаболический обмен между кровью и тканями в капиллярах), обеспечивают вязкость крови. Белки плазмы крови участвуют в поддержании кислотно-основного баланса, выступают в роли резерва аминокислот, обеспечивают свертывание крови. Методы исследования белкового состава крови: 1. Электрофорез на бумаге – выделено 5 фракций белков, электрофорез в агаровом геле – выделено 8 фракций, в полиакриламиновом геле – 17 фракций.

Альбумин: период полураспада составляет около семи дней, участвует в транспорте стироидных структур, принимает участие в транспорте гормонов.
27 Гаммаглобулин – совокупность иммуноглобулинов, совокупность антител плазмы крови. Гаммаглобулин вырабатывается В-лимфоцитами. Дефицит гаммаглобулина – любая ситуация, которая приводит к имунодифициту. Главная причина избытка гаммаглобулина – опухолевое перерождение (В-лимфоциты продуцируют избыточное количество гаммаглобулина).
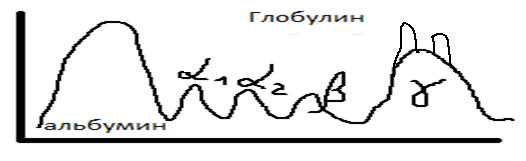
Пики указывают на избыток данной фракции гаммаглобулина. Бывает генетически обусловленная недостаточность гуморального иммунитета, когда отсутствуют В-лимфоциты → нет гаммаглобулинов (болезнь Бруттена, агаммаглобулинемия).
28При различных патологических изменениях в организме, а так же при нарушении баланса при взаимодействии с внешней средой в организме происходят количественные и качественные изменения белков в плазме крови. 1 – гипердиспротеинемия: увеличение количества белков в плазме крови: а)относительная гипердиспротеинемия: пропорциональное увеличение концентрации всех белковых фракций; б)абсолютная: неадекватное образование белковых фракций. 2 – гиподиспротеинемия: снижение количества белков в плазме крови: а) потеря белков из организма, здесь такие болезни, как асцит, нефратический синдром; б) нарушение синтеза белков в печени: атрофия печени, жировая дистрофия; в)белковая недостаточность рациона: голодание, истощение.
29Гаптоглобин – необходим для обеспечения катаболической фазы гемоглобина. Каптоглобин с гемоглобином формируют комплексы, которые задерживаются макрофагами ткани, и этот комплекс подвергается деполяризации. 2. Трансферин – относится к бетта-глобулинам. Этот белок осуществляет рециркуляцию железа в организме. 3. Церулоплазмин – при его недостаточности развивается гепотоцелибральная дистрофия, при этом заболевании нарушается структура и функция печени, а так же головного мозга, отвечающего за кинематику движений. 4. Криоглобулин – в норме отсутствует, но при при некоторых патологических процессах криоглобулин начинает циркулировать в крови (поражение печени, опухоли крови).
30В крови постоянно циркулируют постоянные ферменты: 1. Секретные ферменты: чаще синтезируются в печени, секретируются в кровь, где выполняют ту или иную функцию; 2. Экскреторные ферменты: образуются в печени, и в физиологических условиях выделяются в состав желчи и далее. 3. Клеточные ферменты: в норме они почти не содержаться в крови, при разрушении клеток, они вымываются в кровь, и наличие их в крови можно определить по их активности. Современные методы исследования позволяют определить не только общую активность данного элемента, но и установит изферментный спектр этого фермента. 4. Протамины и гистоны: эти белки отличаются своеобразием аминокислотного состава, в них преобладают основные аминокислоты, которые придают этим белкам способность взаимодействовать с карбоксильными радикалами. В протаминах содержание альгенина доходит до 60-80 %. Протамины хорошо растворимы в воде, сложно растворимы в солевых растворах.
31Протамины и гистоны: эти белки отличаются своеобразием аминокислотного состава, в них преобладают основные аминокислоты, которые придают этим белкам способность взаимодействовать с карбоксильными радикалами. В протаминах содержание альгенина доходит до 60-80 %. Протамины хорошо растворимы в воде, сложно растворимы в солевых растворах. Растительные белки – проламины и глютелины, они содеожаться в семенах злаков. В зависимости от злаков, выделяют специфические белки этих злаков, например: из кукурузы выделяют зиин, ячменя – гордеин, из пшеницы – глиалин и т.д. Эти белки отличаются друг от друга составом аминокислот. При гидролизе в пищеварительном тракте из этих белков могут образоваться короткие пептиды, обладающие для некоторых людей токсическим эффектом.
32Пептиды – короткие полипептидные цепочки, содержащие около десяти аминокислот. В организме у человека обнаружены эти пептидов, и исследованы их физиологические функции. В соответствии с этим подразделяют: пептиды, обладающие гормональной активностью; пептиды, регулирующие процессы пищеварения; пептиды, регулирующие гомеостаз; нейропептиды – пептиды нервной ткани.
33Сложные белки состоят их двух компонентов: 1)белковая часть – полипептидная цепь, 2)вещество любой химической природы, но не белковой, которое химически связано с белковой частью. Хромопротеиды – белки, имеющие ту, или иную окраску. В подавляющем большинстве хемопротеиды принимают участие в обменах, связанных с превращением энергии; обеспечивают фотосинтез, дыхание клеток, транспорт кислорода; входят в состав дыхательной цепи ферментов. Хемопротеины: 1)гемопротеины, 2) хлорофиллы, 3) флавопротеины. Гемопротеиды: 1)гемоглобин, и его производные, 2)меоглобин, 3)гемосодержащие ферменты, 4)железопорферины – небелковые компоненты.
34Структура белковой части гемоглобина: состоит из четырех полипептидных цепей, а точнее из двух пар. В зависимости от того, какие полипептидные цепи входят в состав данного гемоглобина, различают несколько его разновидностей: 1)гемоглобин взрослый (гемоглобин А): две альфа и две бета полипептидные цепи, в альфа-цепи 141 аминокислота, в бета-цепи 146, отсюда вся молекула белка в структуре гемоглобина содержит 574 аминокислоты. 2) гемоглобин F: состоит из двух альфа- и двух гамма-цепей. В процессе жизни и деятельности человека возможно нарушение структуры полепептидных цепей гемоглобина, причем важную роль играет локализация мутации в объеме трехмерной конфигурации. Если замена аминокислоты происходит на поверхности молекулы гемоглобина, то это мутация первого класса, она не приводит к развитию патологии, если происходит замена аминокислоты в непосредственной близости от гемо, то формируется клиническая картина заболевания. В структуру гемо встроена в качестве основной структурной единицы – железо. Часто количество гемоглобина определяется количеством железа, при его недостатке: железодифицитная анемия (в составе эритроцитов не хватает гемоглобина). В этом случае, если гемоглобин соединяется с кислородом, то его называют оксигемоглобином, если он отделяется от кислорода – восстановленный гемоглобин. Гемоглобин может присоединить окись углерода – карбоксигемогобин. Карбоксигемоглобин – обычный гемоглобин, занятый выполнением своих функций. При воздействии на гемоглобин оксидов азота в различных вариантах происходит изменение валентности железа.
35Структура белковой части гемоглобина: состоит из четырех полипептидных цепей, а точнее из двух пар. В зависимости от того, какие полипептидные цепи входят в состав данного гемоглобина, различают несколько его разновидностей: 1)гемоглобин взрослый (гемоглобин А): две альфа и две бета полипептидные цепи, в альфа-цепи 141 аминокислота, в бета-цепи 146, отсюда вся молекула белка в структуре гемоглобина содержит 574 аминокислоты. 2) гемоглобин F: состоит из двух альфа- и двух гамма-цепей. В процессе жизни и деятельности человека возможно нарушение структуры полепептидных цепей гемоглобина, причем важную роль играет локализация мутации в объеме трехмерной конфигурации. Если замена аминокислоты происходит на поверхности молекулы гемоглобина, то это мутация первого класса, она не приводит к развитию патологии, если происходит замена аминокислоты в непосредственной близости от гемо, то формируется клиническая картина заболевания. В структуру гемо встроена в качестве основной структурной единицы – железо.
36Структура белковой части гемоглобина: состоит из четырех полипептидных цепей, а точнее из двух пар. В зависимости от того, какие полипептидные цепи входят в состав данного гемоглобина, различают несколько его разновидностей: 1)гемоглобин взрослый (гемоглобин А): две альфа и две бета полипептидные цепи, в альфа-цепи 141 аминокислота, в бета-цепи 146, отсюда вся молекула белка в структуре гемоглобина содержит 574 аминокислоты. 2) гемоглобин F: состоит из двух альфа- и двух гамма-цепей. В процессе жизни и деятельности человека возможно нарушение структуры полепептидных цепей гемоглобина, причем важную роль играет локализация мутации в объеме трехмерной конфигурации. Если замена аминокислоты происходит на поверхности молекулы гемоглобина, то это мутация первого класса, она не приводит к развитию патологии, если происходит замена аминокислоты в непосредственной близости от гемо, то формируется клиническая картина заболевания. При мутации полипептидной цепи внутри молекулы – чаще всего летальный исход. Наиболее распространенная болезнь, связанная с нарушением структуры гемоглобина – гемоглабинопатия, в которой происходит мутационная замена одной или нескольких аминокислот; наиболее известна – серповидно-клеточная анемия, суть этого дефекта – в бета-цепи в шестом положении глютолиновая кислота заменена на валин (гемоглобин S в составе эритроцитов выпадает в осадок, что приводит к изменению формы эритроцитов). Другой вариант патологии – талассемия: изменение соотношения цепей в молекуле гемоглобина.
37Липопротеин – белок, в состав которого в качестве небелкового компонента входят липиды (нейтральный жир, холестерин, холестерол). Липиды обладают следующими функциями: 1) липиды являются главными структурными компонентами всех клеточных мембран; 2) выполняют ряд специфических функций, например: обеспечивают сохранение объема и структуры альвеолы в легких; 3) входят в структуру миелиновых оболочек нервных волокон. Большинство нервных островков нейрона заключено в миелиновую оболочку, которая изолирует отростки нервных клеток друг от друга. В крови у человека содержаться липиды в различных формах, которые являются транспортными системами, обеспечивающими доставку липидов в клетки; вывод «отработавших» липидов к местам выведения. Транспортные формы липидов синтезируются в слизистой оболочке кишечника. В печени осуществляется синтез липопротеинов, которые доставляют липиды к нуждающимся в них клеткам ткани, при этом синтезируются липопротеины очень низкой плотности. По мере «выедания» клетками липидов, они превращаются в липопротеины промежуточной плотности, которые после осуществляют выбор «отработавших » липидов из органов и тканей.
38Липопротеин – белок, в состав которого в качестве небелкового компонента входят липиды (нейтральный жир, холестерин, холестерол). Липиды обладают следующими функциями:1) липиды являются главными структурными компонентами всех клеточных мембран; 2) выполняют ряд специфических функций, например: обеспечивают сохранение объема и структуры альвеолы в легких; 3) входят в структуру миелиновых оболочек нервных волокон. Большинство нервных островков нейрона заключено в миелиновую оболочку, которая изолирует отростки нервных клеток друг от друга. В крови у человека содержаться липиды в различных формах, которые являются транспортными системами, обеспечивающими доставку липидов в клетки; вывод «отработавших» липидов к местам выведения. Транспортные формы липидов синтезируются в слизистой оболочке кишечника. В печени осуществляется синтез липопротеинов, которые доставляют липиды к нуждающимся в них клеткам ткани, при этом синтезируются липопротеины очень низкой плотности. По мере «выедания» клетками липидов, они превращаются в липопротеины промежуточной плотности, которые после осуществляют выбор «отработавших » липидов из органов и тканей. В организме существует баланс между этими двумя группами липопротеинов. При нарушении этого баланса, возможна избыточная поставка липидов в органы и ткани, в том числе и холестерина, что приводит в конечном итоге к избыточному накоплению холестерина. В том случае, если происходит накопление холестерина в клетках артерии в виде артериальных бляшек, говорят о развитии атеросклероза, поэтому группу липидов ЛПОНП и ЛПНП называют атерогенными липопротеинами, а ЛППП и ЛПВП носят название антиатерогенных липопротеинов.
39Глипопротеины – сложные белки, которые содержат сахара, т.е. углеводный компонент. Углеводный компонент – гликоканьюгат. В зависимости от того, что из себя представляет углеводный компонент: 1) гликопротеины: содержат гетерополисахариды, это углеводная часть гликопротеинов обеспечивает участие этих белков в опознании структурных компонентов клетки, а так же участвует в формировании активных детерминант. При различных заболеваниях, связанных с нарушением функций иммунной системы, изменяется структура этих детерминант, что приводит к конфликту между макроорганизмом и его собственной иммунной системы. 2) протеогликаны: состоят из белка и гликозингликанов. Функции, которые выполняют гликопротеины: клеточное сцепление, молекулярное клеточное образование, обладают регуляторной активностью, оказывают защитное действие. Антитела – иммуноглобулины. В случае клеточного иммунитета опознание антигенных детерминант чужеродных носителей обеспечивается гликопротеинами.
40Фосфопротеин – белок, который содержит в своем составе фосфорную кислоту и белковую полипептидную цепь. Фосфопротеины представлены в курином яйце, молоке, игре рыб. Высокая концентрация фосфопротеинов обнаружена в ЦНС. Фосфопротеин образуется в клетках под влиянием регуляторных стимулов, воздействующих на рецепторы клетки. Металопротеины – в структуру этих белков встраиваются один или несколько атомов металла: а) некиминовые железопротеины, типичные представители: трансферин, ферритин, гемосидерин. Трансферин – группа сложных белков, которые способны связываться с трехвалентным железом, так же имеют в своем составе углеводный комплекс. Ферритин – депо железа в организме. Гемоседерин – внутриклеточный белок, содержится главным образом в печени и селезенке, водонерастворим.
41Нуклепротеины состоят из белков и нуклеиновых кислот. Нуклеиновые кислоты рассматриваются как простетические группы. В природе обнаружено 2 типа нуклеопротеинов, отличающихся друг от друга по составу, размерам и физико-химическим свойствам, - дезоксирибонуклеопротеины (ДНП) и рибонуклеопротеины (РНП). Названия нуклеопротеинов отражают только природу углеводного компонента, входящего в состав нуклеиновых кислот. У РНП углевод представлен рибозой, у ДНП – дезоксирибозой. Термин «нуклеопротеины» связан с названием ядра клетки, однако ДНП и РНП содеожаться и в других субклеточных структурах. Следовательно, речь идет о химически индивидуальном классе органических веществ, имеющих своеобразный состав, структуру и функции независимо от локализации в клетке. Доказано, что ДНП преимущественно локализованы в ядре, а РНП – в цитоплазме. В то же время ДНП открыты в митохондриях, а в ядрах и ядрышках обнаружены так же высокомолекулярные РНП.
42Виды
нуклеиновых кислот. Нуклеиновые
кислоты —
фосфорсодержащие биополимеры живых
организмов, обеспечивающие хранение и
передачу наследственной информации.
Они были открыты в 1869 г. швейцарским
биохимиком Ф. Мишером в ядрах лейкоцитов,
сперматозоидов лосося. Впоследствии
нуклеиновые кислоты обнаружили во всех
растительных и животных клетках, вирусах,
бактериях и грибах. В природе существует
два вида нуклеиновых кислот —
дезок-сирибонуклеиновые
(ДНК) и
рибонуклеиновые
(РНК). Различие
в названиях объясняется тем, что молекула
ДНК содержит пяти-углеродный сахар
дезоксирибозу, а молекула РНК— рибозу.
В настоящее время известно большое
число разновидностей ДНК и РНК,
отличающихся друг от друга по строению
и значению в метаболизме. ДНК находится
преимущественно в хромосомах клеточного
ядра (99% всей ДНК клетки), а также в
митохондриях и хлоропластах. РНК входит
в состав рибосом; молекулы РНК содержатся
также в цитоплазме, матриксе пластид и
митохондрий. Нуклеотиды — структурные
компоненты нуклеиновых кислот. Нуклеиновые
кислоты представляют собой биополимеры,
мономерами которых являются нуклеотиды.
Нуклеотиды
—сложные вещества. В состав каждого
нуклео-тида входит азотистое основание,
пятиуглеродный сахар (рибоза или
дезоксирибоза) и остаток фосфорной
кислоты. Есть два типа нуклеиновых
кислот: ДНК и РНК. ДНК присутствует в
ядрах всех растительных и животных
клеток, где она находится в комплексе
с белками и является составной частью
хромосом. У особей каждого конкретного
вида содержание ядерной ДНК обычно
одинаково во всех клетках, кроме гамет
(яйцеклеток и сперматозоидов), где ДНК
вдвое меньше. Таким образом, количество
клеточной ДНК видоспецифично. ДНК
найдена и вне ядра: в митохондриях
(«энергетических станциях» клеток) и в
хлоропластах (частицах, где в растительных
клетках идет фотосинтез). Эти субклеточные
частицы обладают некоторой генетической
автономиейНекоторое количество РНК
присутствует в клеточном ядре, основная
же ее масса находится в цитоплазме –
жидком содержимом клетки. Б![]() льшую
ее часть составляет рибосомная РНК
(рРНК). Рибосомы – это мельчайшие тельца,
на которых идет синтез белка. Небольшое
количество РНК представлено транспортной
РНК (тРНК), которая также участвует в
белковом синтезе. Однако оба этих класса
РНК не несут информации о структуре
белков – такая информация заключена в
матричной, или информационной, РНК
(мРНК), на долю которой приходится лишь
небольшая часть суммарной клеточной
РНК. Генетический материал вирусов
представлен либо ДНК, либо РНК, но никогда
обеими одновременно. Молекулы нуклеиновых
кислот содержат множество отрицательно
заряженных фосфатных групп и образуют
комплексы с ионами металлов; их калиевая
и натриевая соли хорошо растворимы в
воде. Концентрированные растворы
нуклеиновых кислот очень вязкие и слегка
опалесцируют, а в твердом виде эти
вещества белые. Нуклеиновые кислоты
сильно поглощают ультрафиолетовый
свет, и это свойство лежит в основе
определения их концентрации
льшую
ее часть составляет рибосомная РНК
(рРНК). Рибосомы – это мельчайшие тельца,
на которых идет синтез белка. Небольшое
количество РНК представлено транспортной
РНК (тРНК), которая также участвует в
белковом синтезе. Однако оба этих класса
РНК не несут информации о структуре
белков – такая информация заключена в
матричной, или информационной, РНК
(мРНК), на долю которой приходится лишь
небольшая часть суммарной клеточной
РНК. Генетический материал вирусов
представлен либо ДНК, либо РНК, но никогда
обеими одновременно. Молекулы нуклеиновых
кислот содержат множество отрицательно
заряженных фосфатных групп и образуют
комплексы с ионами металлов; их калиевая
и натриевая соли хорошо растворимы в
воде. Концентрированные растворы
нуклеиновых кислот очень вязкие и слегка
опалесцируют, а в твердом виде эти
вещества белые. Нуклеиновые кислоты
сильно поглощают ультрафиолетовый
свет, и это свойство лежит в основе
определения их концентрации
43МОНОНУКЛЕОТИДЫ, органические соединения, состоящие из пуринового или пиримидинового основания, углевода рибозы или дезоксирибозы и остатка фосфорной кислоты. Во всех живых организмах образуют полимерные цепи нуклеиновых кислот. С помощью АТФ клетка синтезирует новые молекулы белков, углеводов, жиров, избавляется от отходов, осуществляет активный транспорт веществ, биение жгутиков и ресничек и т. д. Молекула АТФ представляет собой нуклеотид, образованный азотистым основанием аденином, пятиуглеродным сахаром рибо-зой и тремя остатками фосфорной кислоты. Фосфатные группы в молекуле АТф соединены между собой высокоэнергетическими (макроэргическими) связями Связи между фосфатными группами не очень прочные, и при их разрыве выделяется большое количество энергии. В результате гидролитического отщепления от АТФ фосфатной группы образуется аденозиндифосфорная кислота (АДФ) н высвобождается порция энергииАДФ также может подвергаться дальнейшему гидролизу с отщеплением еще одной фосфатной группы и выделением второй порции энергии; при этом АДФ преобразуется в аденозин-монофосфат (АМФ), который далее не гидролизуетсяАТФ образуется из АДФ и неорганического фосфата за счет энергии, освобождающейся при окислении органических веществ и в процессе фотосинтеза. Этот процесс называется фосфорили-рованием. При этом должно быть затрачено не менее 40 кДж/моль энергии, которая аккумулируется в макроэргических связяхТаким образом, АТФ — это главный универсальный поставщик энергии в клетках всех живых организмов. АТФ чрезвычайно быстро обновляется. Синтез АТФ осуществляется главным образом в митохондриях и хлоропластах (частично в цитоплазме). Образовавшаяся здесь АТФ направляется в те участки клетки, где возникает потребность в энергии.
44, 45, 46Мономеры в молекулах нуклеиновых кислот соединены сложноэфирной связью, образованной фосфатным остатком одного мононуклеотида и З'-гидроксиль-ной группой пентозного остатка другого мононуклеотида (3',5'-фосфодиэфир-ная связь) Межнуклеотидная 3',5'-фосфодиэфирная связь гидролитически расщепляется нуклеазами. Это большая группа ферментов, различающихся по специфичности. Есть нуклеазы, гидролизующие как РНК, так и ДНК, есть такие, которые расщепляют только РНК (РНКазы) или только ДНК (ДНКазы). Одни из них отщепляют только концевые нуклеотиды (экзонуклеазы), другие гидролизуют внутренние связи (эндонуклеазы). Используя определенный набор нуклеаз, можно гидролизо-вать нуклеиновые кислоты до нуклеозидмонофосфатов — мономеров нуклеиновых кислот. При этом в гидролизате РНК обнаруживается четыре типа рибонук-леозидмонофосфатов, а в гидролизате ДНК — четыре типа дезоксирибонуклео-зидмонофосфатов (см. табл. 3.1). Азотистые основания мономеров РНК и ДНК в трех случаях совпадают, а в одном — различны: УМФ (основание урацил) — в РНК, ТМФ (основание тимин) — в ДНК. Таким образом, нуклеиновые кислоты представляют собой линейные полимеры нуклеозидмонофосфатов, полинуклеотиды. Концы полинуклеотида различаются по структуре: на одном конце имеется свободная 5'-фосфатная группа (5'-конец), на другом - свободнаяЗ'-ОН-группа(З'-конец). Разные ДНК отличаются друг от друга числом мононуклеотидных остатков в молекуле, нуклеотидным составом и порядком чередования нуклеотидных остатков (фактически оснований, поскольку пентозофосфатные части у всех мономеров одинаковы). Так же отличаются друг от друга разные РНК. Для краткого изображения первичной структуры нуклеиновых кислот пользуются однобуквенными символами нуклеозидов: А — аденозин, G — гуанозин, С — цитидин, U — уридин, Т — тимидин. Эти две записи, помимо символа «д», различаются еще тем, что в первой (РНК) не встречается символ Т, а во второй (ДНК) не встречается символ U. При такой записи предполагается, что слева находится 5'-конец, справа — З'-конец. Иногда приходится писать полинуклеотиды противоположным образом; в этом случае во избежание путаницы вводят дополнительные приставки: (5'-3') AUAAG... — здесь 5'-конец слева; или (3'-5') GAAUA..., 5'-конец справа. Из четырех разных нуклеотидов можно построить огромное количество нуклеиновых кислот, различающихся по первичной структуре. В этом отношении нуклеиновые кислоты сходны с белками.
49Изоферменты – это ферменты, представленные во множественных формах, которые катализируют одну и ту же реакцию, но отличаются друг от друга по функциональным и физико-химическим свойствам. Изоферменты по структуре представляют собой белки, состоящие из нескольких мономерных частиц. Первый изофермент – лактат дегидрогиназа (ЛДГ), который наиболее активен в печени и сердечной мышце; состоит из пяти субъединиц, причем они представлены двумя типами: 1)h-протомеры 2)m-протомеры, которые могут отличаться между собой по молекулярному весу, электрической активности. При патологии миокарда, печени и других тканей определяют активность ЛДГ ; при изучении изоферментного спектра ЛДГ удается установить: 1) из какого органа появился в крови избыток этого фермента; 2) степень поражения клеток органа.
50Высокая каталитическая активность ферментов достигается благодаря тому, что фермент и субстрат образуют ферментосубстратный комплекс; именно это промежуточное соединение позволяет осуществить, например: расщепление субстрата на продукты реакции. Субстрат и фермент взаимодействуют по принципу «ключа и замка». Взаимодействие субстрата и фермента, которые предполагали изменения в процессе взаимодействия приводит к снижению реакции активизации, что ускоряет ход катализа.
51Ферменты (энзимы) - это высокоспецифичные белки, выполняющие функции биологических катализаторов. Катализатор - это вещество, которое ускоряет химическую реакцию, но само в ходе этой реакции не расходуется.
Катализаторы сами не вызывают химическую реакцию, а только ускоряют реакцию, которая протекает и без них.
Не влияют на энергетический итог реакции.
В обратимых реакциях катализаторы ускоряют как прямую, так и обратную реакцию, причем в одинаковой степени, из чего следует, что катализаторы:
не влияют на направленность обратимой реакции, которая определяется только соотношением концентраций исходных веществ (субстратов) и конечных продуктов;
не влияют на положение равновесия обратимой реакции, а только ускоряют его достижение.
Различают два главных вида специфичности ферментов: субстратную специфичность и специфичность действия. Субстратная специфичность, это способность фермента катализировать превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента. Различают 3 типа субстратной специфичности:
абсолютная субстратная специфичность - это способность фермента катализировать превращение только одного, строго определенного субстрата;
относительная субстратная специфичность - способность фермента катализировать превращения нескольких, сходных по строению, субстратов;
стереоспецифичность - способность фермента катализировать превращения определенных стереоизомеров.
Например, фермент оксидаза L-аминокислот способен окислять все аминокислоты, но относящиеся только к L-ряду. Таким образом, этот фермент обладает относительной субстратной специфичностью и стереоспецифичностью одновременно. Специфичность действия - это способность фермента катализировать только определенный тип химической реакции. В соответствии со специфичностью действия все ферменты делятся на 6 классов. Классы ферментов обозначаются латинскими цифрами. Название каждого класса ферментов соответствует этой цифре.
52Активность ферментов регулируется в процессе их биосинтеза (в т.ч. благодаря образованию изоферментов, к-рые катализируют идентичные р-ции, но отличаются строением и каталитич. св-вами), а также условиями среды (рН, т-ра, ионная сила р-ра) и многочисленными ингибиторами и активаторами, присутствующими в организме. Ингибиторами и активаторами могут служить сами субстраты (в определенных концентрациях), продукты р-ции, а также конечные продукты в цепи последоват. превращений в-ва. Активаторы ферментов — соединения, которые приводят ферменты в каталитически активное состояние. Иногда это могут быть ионы металлов: Co++, Mg++, Zn++, Ca++ и др.
53Активность ферментов регулируется в процессе их биосинтеза (в т.ч. благодаря образованию изоферментов, к-рые катализируют идентичные р-ции, но отличаются строением и каталитич. св-вами), а также условиями среды (рН, т-ра, ионная сила р-ра) и многочисленными ингибиторами и активаторами, присутствующими в организме. Ингибиторами и активаторами могут служить сами субстраты (в определенных концентрациях), продукты р-ции, а также конечные продукты в цепи последоват. превращений в-ва. ИНГИБИТОРЫ (от лат mhibeo - останавливаю, сдерживаю), в-ва, тормозящие хим. р-ции. Ингибирование характерно для каталитич и цепных р-ций, к-рые протекают с участием активных центров или активных частиц. Тормозящее действие обусловлено тем, что ингибитор блокирует активные центры катализатора или реагирует с активными частицами с образованием малоактивных радикалов, не способных продолжать цепь. Ингибитор вводится в систему в концентрации много меньшей, чем концентрации реагирующих в-в (102-105 моль%). Кинетика р-ций с участием ингибиторов принципиально различна для каталитических и цепных р-ций. В каталитич. р-ции число активных центров фиксировано и ингибитор, блокируя часть из них, не расходуется в ходе процесса. Поэтому при введении ингибитора скорость р-ции снижается, а затем процесс протекает длит. время с постоянной скоростью. В нек-рых случаях эта скорость может медленно возрастать из-за расходования ингибитора по к.-л. побочной р-ции. В цепной р-ции активные частицы непрерывно генерируются, что приводит к расходованию ингибитора и постепенному самоускорению р-ции (в случае цепной неразветвленной р-ции обычно восстанавливается исходная скорость. Большинство ингибиторов ферментов действуют обратимо, т. е. не вносят в молекулу фермента каких-либо изменений после своей диссоциации. Однако существуют также необратимые ингибиторы ферментов, которые необратимо модифицируют целевой фермент. Принцип действия ингибитора, тип его ингибирования определяют путем сравнения кинетики реакции (см. с. 98) в присутствии ингибиторам без него (см. схему Б). Различают конкурентное (А, слева) и неконкурентное (А, справа) ингибирование. В регуляции обмена веществ важную роль играет аллостерическое ингибирование (А, 6). Так называемые аналоги субстрата (2) имеют свойства, подобные свойствам субстрата целевого фермента. Они обратимо блокируют часть молекул имеющегося в наличии фермента, но не могут далее превращаться в продукт. Поэтому для достижения половины максимальной скорости реакции необходимы более высокие концентрации субстрата: в присутствии такого ингибитора константа Михаэлиса Km растет (Б). Субстрат в высоких концентрациях вытесняет ингибитор с фермента. Поэтому максимальная скорость V (см. с. 98) при этом типе торможения не претерпевает изменений. Так как субстрат и ингибитор конкурируют за место связывания на ферменте, данный тип торможения называют конкурентным. Аналоги переходного состояния (3) также действуют как конкурентные ингибиторы. Если ингибитор реагирует с функционально важной группой фермента, не препятствуя связыванию субстрата, такое ингибирование называется неконкурентным (на схеме справа). В этом случае Km остается неизменной, напротив уменьшается концентрация функционально активного фермента [Е] t и, следовательно, максимальная скорость реакции V. Неконкурентные ингибиторы действуют как правило необратимо, поскольку они модифицируют функциональные группы целевого фермента (4).
54По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов. Классификация была предложена Международным союзом биохимии и молекулярной биологии). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
КФ 1: Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа
КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза
КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата.
КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. Пример: ДНК-полимераза
Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям. Код каждого фермента содержит четыре цифры, разделенные точками, и составляется по определенному принципу. Первая цифра указывает номер одного из шести главных классов ферментов. Вторая цифра означает подкласс, характеризующий основные виды субстратов, участвующих в данном типе химических превращений. Например, у трансфераз вторая цифра указывает на природу той группы, которая подвергается переносу, у гидролаз – на тип гидролизуемой связи и т.д. Эти подклассы в свою очередь делятся на более частные подгруппы (подпод-классы), отличающиеся природой химических соединений доноров или акцепторов, участвующих в данной подгруппе реакций. Номер (цифра) подподкласса ставят на 3-е место в шифре фермента. У гидролаз, например, эта цифра уточняет тип гидролизуемой связи, а у лиаз – тип отщепляемой группы и т.д. Первые 3 цифры кода точно определяют тип фермента. Наконец, все ферменты, относящиеся к данному подподклассу, получают порядковый номер в алфавитном порядке, который ставят на 4-е место в шифре.
55Оксидоредукта́зы — отдельный класс ферментов, катализирующих лежащие в основе биологического окисления реакции, сопровождающиеся переносом электронов с одной молекулы (восстановителя — акцептора протонов или донора электронов) на другую (окислитель — донора протонов или акцептора электронов). Трансфера́зы — отдельный класс ферментов, катализирующих перенос функциональных групп и молекулярных остатков от одной молекулы к другой. Широко распространены в растительных и животных организмах, участвуют в превращениях углеводов, липидов, нуклеиновых и аминокислот.
Реакции, катализируемые трансферазами, в общем случае выглядят так:
A—X + B ↔ A + B—X.
Молекула A в здесь выступает в качестве донора группы атомов (X), а молекула B является акцептором группы. Часто в качестве донора в подобных реакциях переноса выступает один из коферментов. Многие из катализируемых трансферазами реакций являются обратимыми. Гидролазы (КФ3) — это класс ферментов, катализирующий гидролиз ковалентной связи. Общий вид реакции, катализируемой гидролазой выглядит следующим образом:
A–B + H2O → A–OH + B–H
Лиа́зы — отдельный класс ферментов, катализирующих реакции негидролитического и неокислительного разрыва различных химических связей (C—C, C—O, C—N, C—S и других) субстрата, обратимые реакции образования и разрыва двойных связей, сопровождающиеся отщеплением или присоединением групп атомов по её месту, а также образованием циклических структур.
Изомеразы — ферменты, катализирующие структурные превращения изомеров (рацемизация или эпимеризация). Изомеразы катализируют реакции, подобные следующей: A → B, где B является изомером A.
Лигаза (лат. ligāre — сшивать, соединять) — фермент, катализирующий соединение двух молекул с образованием новой химической связи (лигирование). При этом обычно происходит отщепление (гидролиз) небольшой химической группы от одной из молекул.
Лигазы относятся к классу ферментов EC 6.
В молекулярной биологии лигазы (подкласс 6.5) разделяют на две большие группы — РНК-лигазы и ДНК-лигазы.
56Набор используемых сегодня ферментов весьма невелик и применяются они в основном в пищевой промышленности.. Химическая промышленность, особенно в США и Японии, проявляет постоянный интерес к разработке аналогичных процессов получения других дешевых продуктов на основе микробиологического окислительного катализа. Считается, что таким путем удается осуществлять более экономичные процессы, чем их нынешние аналоги в химической промышленности. Использование ферментов в качестве терапевтических средств имеет много ограничений вследствие их высокой иммуногениости. Тем не менее энзимотерапию активно развивают в следующих направлениях:
заместительная терапия - использование ферментов в случае их недостаточности;
элементы комплексной терапии - применение ферментов в сочетании с другой терапией.
Заместительная энзимотерапия эффективна при желудочно-кишечных заболеваниях,
Ферментные препараты стали широко применять при тромбозах и тромбоэмболиях. С этой целью используют препараты фибринолизина, стрептолиазы, стрептодеказы, урокиназы.
Фермент гиалуронидазу (лидазу), катализирующий расщепление гиалуроновой кислоты, используют подкожно и внутримышечно для рассасывания контрактур рубцов после ожогов и операций (гиалуроновая кислота образует сшивки в соединительной ткани) (см. раздел 8).
Ферментные препараты используют при онкологических заболеваниях. Аспарагиназа, катализирующая реакцию катаболизма аспарагина, нашла применение для лечения лейкозов:
57Определение активности ферментов наиболее широко используется при диагностике как первичных врожденных ферментопатий, так и вторичных, т.е. развивающихся в результате патологических нарушений на клеточном и субклеточном уровнях. Изменение активности одних и тех же ферментов может наблюдаться при самых различных заболеваниях и, следовательно, не является специфичным для какой-либо патологии. В связи с этим определение активности ферментов имеет диагностическую значимость только при сопоставлении с изменениями других показателей и клинической картиной заболевания в целом. Чаще всего для определения активности ферментов в клинико-диагностических лабораториях используют плазму. Ферменты, выявляемые в плазме, условно делятся на три группы: - собственные ферменты плазмы, выполняющие свои функции только в сосудистом русле (ферменты свертывания крови, холинэстераза, церулоплазмин); - экскреторные ферменты, попавшие в плазму из секретов (дуоденального сока, слюны); -клеточные ферменты, попавшие в плазму из поврежденного органа.
58Энергетический обмен (катаболизм) — процесс метаболического распада, разложения на более простые вещества или окисления какого-либо вещества, обычно протекающий с высвобождением энергии в виде тепла и в виде АТФ. Катаболические реакции лежат в основе диссимиляции: утраты сложными веществами, своей специфичности для данного организма в результате распада до более простых. Примерами катаболизма являются превращение этанола через стадии ацетальдегида (этаналя) и уксусной кислоты (этановой кислоты) в углекислый газ и воду, или процесс гликолиза — превращение глюкозы в молочную кислоту либо пировиноградную кислоту и далее уже в дыхательном цикле — опять-таки в углекислый газ и воду. Интенсивность катаболических процессов и преобладание тех или иных катаболических процессов в качестве источников энергии в клетках регулируется гормонами. Например, глюкокортикоиды повышают интенсивность катаболизма белков и аминокислот, одновременно тормозя катаболизм глюкозы, а инсулин, напротив, ускоряет катаболизм глюкозы и тормозит катаболизм белков. Катаболизм является противоположностью анаболизму. Соотношение катаболических и анаболических процессов в клетке регулируется гормонами. Например, адреналин или глюкокортикоиды сдвигают баланс обмена веществ в клетке в сторону преобладания катаболизма, а инсулин, соматотропин, тестостерон — в сторону преобладания анаболизма. Пластический обмен или анаболизм (от греч. anabolē — подъём) — совокупность химических процессов, составляющих одну из сторон обмена веществ в организме, направленных на образование составных частей клеток и тканей. Анаболизм взаимосвязан с противоположным процессом — катаболизмом, так как продукты распада различных соединений могут вновь использоваться при анаболизме, образуя в иных сочетаниях новые вещества. Процессы анаболизма, происходящие в зелёных растениях с поглощением энергии солнечных лучей, имеют планетарное значение, играя решающую роль в синтезе органических веществ из неорганических. Анаболизм (пластический обмен, ассимиляция) — одна из сторон обмена веществ. Включает процессы синтеза аминокислот, моносахаридов, жирных кислот, нуклеотидов, полисахаридов, макромолекул белков, нуклеиновых кислот, АТФ. Процесс происходит в три этапа: 1. Синтез промежуточных соединений из низкомолекулярных веществ. 2. Синтез "строительных блоков" из промежуточных соединений. 3. Синтез из "строительных блоков" макромолекул белков, нуклеиновых кислот, полисахаридов, жиров. Идет с поглощением энергии и участием ферментов. В результате такого обмена из питательных веществ, поступающих в клетку, строятся свойственные организму белки, жиры, углеводы, которые, в свою очередь, идут уже на создание новых клеток, их органов, межклеточного вещества. Противоположностью пластического обмена является энергетический (катаболизм — совокупность реакций разложения, идущих с выделением энергии). Период полураспада (время, за которое обновляется половина белковых молекул) составляет для белков организма человека примерно 80 дней, для белков печени и плазмы крови - десять суток, слизистой оболочки кишечника - трое-четверо суток, а гормона инсулина - шесть-девять минут. Такое постоянное переваривание собственных и "чужих" белков обеспечивает стабильность организма и его непрерывное обновление.
59Азотистое равновесие, состояние животного организма, при котором количество выводимого (с мочой и калом) азота равно количеству азота, получаемому с пищей. Взрослый организм в норме находится в состоянии А. р. Средняя потребность взрослого человека в азоте — 16 г в сутки, что соответствует 100 г белка. Если количество поступающего с пищей азота ниже белкового минимума, то организм начинает разрушать белки собственного тела и А. р. нарушается (отрицательный азотистый баланс: количество выводимого азота больше поступающего с пищей). Длительный недостаток белка (см. Голодание) ведёт к истощению. Растущий организм нуждается в положительном азотистом балансе, т. е. в превышении количества вводимого азота над количеством выводимого из организма. Азотистый баланс. Это соотношение количества азота, поступившего в организм с пищей и выделенного из него. Так как основным источником азота в организме является белок, то по азотистому балансу можно судить о соотношении количества поступившего и разрушенного в организме белка. Количество азота, поступившего с пищей, всегда больше количества усвоенного азота, так как часть его теряется с каломДля того чтобы установить количество разрушенного белка, необходимо знать общее количество азота, выведенного из организма. Азотсодержащие продукты белкового обмена (мочевина, мочевая кислота, креатинин и др.) выделяются преимущественно с мочой и частично с потом. В условиях обычного, неинтенсивного потоотделения количество азота в поте можно не принимать во внимание, поэтому для определения количества распавшегося в организме белка обычно находят количество азота в моче и умножают на 6,25. Между количеством азота, введенного с белками пищи, и количеством азота, выводимым из организма, существует определенная связь. Увеличение поступления белка в организм приводит к увеличению выделения азота из организма. У взрослого человека при адекватном питании, как правило, количество введенного в организм азота равно количеству азота, выведенного из организма. Это состояние получило название азотистого равновесия. Если в условиях азотистого равновесия повысить количество белка в пище, то азотистое равновесие вскоре восстановится, но уже на новом, более высоком уровне. Таким образом, азотистое равновесие может устанавливаться при значительных колебаниях содержания белка в пище. В случаях, когда поступление азота превышает его выделение, говорят о положительном азотистом балансе. При этом синтез белка преобладает над его распадом. Устойчивый положительный азотистый баланс наблюдается всегда при увеличении массы тела. Он отмечается в период роста организма, во время беременности, в периоде выздоровления после тяжелых заболеваний, а также при усиленных спортивных тренировках, сопровождающихся увеличением массы мышц. В этих условиях происходит задержка азота в организме (ретенция азота). Белки в организме не депонируются, т. е. не откладываются в запас, поэтому при поступлении с пищей значительного количества белка только часть его расходуется на пластические цели, большая же часть — на энергетические цели. Когда количество выведенного из организма азота превышает количество поступившего азота, говорят об отрицательном азотистом балансе. Отрицательный азотистый баланс отмечается при белковом голодании, а также в случаях, когда в организм не поступают отдельные необходимые для синтеза белков аминокислоты. Отрицательный азотистый баланс развивается при полном отсутствии или недостаточном количестве белка в пище, а также при потреблении пищи, содержащей неполноценные белки. Не исключена возможность дефицита белка при нормальном поступлении, но при значительном увеличении потребности в нем организма. Во всех этих случаях имеет место белковое голодание.
60, 61Белки занимают ведущее место среди органических элементов, на их долю приходится более 50 % сухой массы клетки. Они выполняют ряд важнейших биологических функций. Вся совокупность обмена веществ в организме (дыхание, пищеварение, выделение) обеспечивается деятельностью ферментов, которые являются белками. Все двигательные функции организма обеспечиваются взаимодействием сократительных белков — актина и миозина. Поступающий с пищей из внешней среды белок служит пластической и энергетической целям. Пластическое значение белка состоит в восполнении и новообразовании различных структурных компонентов клетки. Энергетическое значение заключается в обеспечении организма энергией, образующейся при расщеплении белков. В тканях постоянно протекают процессы распада белка с последующим выделением из организма неиспользованных продуктов белкового обмена и наряду с этим — синтез белков. Таким образом, белки организма находятся в динамическом состоянии: из-за непрерывного процесса их разрушения и образования происходит обновление белков, скорость которого неодинакова для различных тканей. С наибольшей скоростью обновляются белки печени, слизистой оболочки кишечника, а также других внутренних органов и плазмы крови. Медленнее обновляются белки, входящие в состав клеток мозга, сердца, половых желез и еще медленнее — белки мышц, кожи и особенно опорных тканей (сухожилий, костей и хрящей). Физиологическое значение аминокислотного состава пищевых белков и их биологическая ценность. Для нормального обмена белков, являющихся основой их синтеза, необходимо поступление с пищей в организм различных аминокислот. Изменяя количественное соотношение между поступающими в организм аминокислотами или исключая из рациона ту или иную аминокислоту, можно по состоянию азотистого баланса, росту, массе тела и общему состоянию животных судить о значении для организма отдельных аминокислот. Экспериментально установлено, что из 20 входящих в состав белков аминокислот 12 синтезируются в организме — заменимые аминокислоты, а 8 не синтезируются — незаменимые аминокислоты. Белки обладают различным аминокислотным составом, поэтому и возможность их использования для синтетических нужд организма неодинакова. В связи с этим было введено понятие биологической ценности белков пищи. Белки, содержащие весь необходимый набор аминокислот в таких соотношениях, которые обеспечивают нормальные процессы синтеза, являются белками биологически полноценными. Наоборот, белки, не содержащие тех или иных аминокислот или содержащие их в очень малых количествах, являются неполноценными. Так, неполноценными белками являются желатина, в которой имеются лишь следы цистина и отсутствуют триптофан и тирозин; зеин (белок, находящийся в кукурузе), содержащий мало триптофана и лизина; глиадин (белок пшеницы) и гордеин (белок ячменя), содержащие мало лизина; и некоторые другие. Наиболее высока биологическая ценность белков мяса, яиц, рыбы, икры, молока. В связи с этим пища человека должна не просто содержать достаточное количество белка, но обязательно иметь в своем составе не менее 30% белков с высокой биологической ценностью, т. е. животного происхождения. Биологическая ценность одного и того же белка для разных людей различна. Вероятно, она не является какой-то определенной величиной, а может изменяться в зависимости от состояния организма, предварительного пищевого режима, интенсивности и характера физиологической деятельности, возраста, индивидуальных особенностей обмена веществ и других факторов. Практически важно, чтобы два неполноценных белка, один из которых не содержит одних аминокислот, а другой — других, в сумме могли обеспечить потребности организма.
62Пищеварение — сложный процесс, обеспечивающий переваривание пищи и её усвоение клетками. В ходе пищеварения происходит превращение макромолекул пищи в более мелкие молекулы, в частности, расщепление биополимеров пищи на мономеры. Этот процесс осуществляется с помощью пищеварительных (гидролитических) ферментов. Протеа́зы, протеиназы, протеолитические ферменты — ферменты из класса гидролаз, которые расщепляют пептидную связь между аминокислотами в белках. Классификация: Протеазы разделяют на шесть групп по строению активного центра фермента:
Сериновые
Треониновые
Цистеиновые
Аспартатные
Металлопротезы
Глютаминовые
63Переваривание белков в желудке. Роль соляной кислоты, пепсина и других ферментов в переваривании белков. В желудке имеются все условия для переваривания белков. Во-первых, в желудочном соке содержится активный фермент пепсин. Во-вторых, благодаря наличию в желудочном соке свободной соляной кислоты для действия пепсина создается оптимальная среда (рН 1,5–2,5). Следует особо указать на существенную роль соляной кислоты в переваривании белков: она переводит неактивный пепсиноген в активный пепсин, создает оптимальную среду для действия пепсина; в присутствии соляной кислоты происходят набухание белков, частичная денатурация и, возможно, гидролиз сложных белков. Кроме того, соляная кислота стимулирует выработку секретина в двенадцатиперстной кишке, ускоряет всасывание железа и оказывает бактерицидное действие. Ввиду исключительной роли соляной кислоты в переваривании белков были предприняты попытки объяснить механизм ее секреции в желудке. В деталях этот механизм до сих пор не выяснен, однако имеющиеся данные свидетельствуют, что образующиеся при диссоциации хлорида натрия в крови ионы хлора диффундируют через клеточную мембрану и соединяются с ионами водорода, которые в свою очередь освобождаются при диссоциации угольной кислоты, образующейся в обкладочных клетках из конечных продуктов обмена – Н2 О и СО2. Образовавшаяся соляная кислота затем экскретируется обкладочными клетками в полость желудка. Равновесие ионов Сl– между кровью и обкладочными клетками достигается поступлением отрицательно заряженных ионов HCO3–из клеток в кровь взамен ионов Сl–, поступающих из крови в клетки. Предполагается участие АТФ, поскольку синтез соляной кислоты требует энергии. Следует отметить, что при некоторых поражениях желудка (обычно при воспалительных процессах) могут нарушаться секреция соляной кислоты и соответственно переваривание белков. Пепсин, катализирующий гидролиз пептидных связей, образованных остатками ароматических аминокислот, расщепляет практически все природные белки. Исключение составляют некоторые кератины, протамины, гистоны и мукопротеины. При их гидролизе образуются различного размера пептиды и, возможно, небольшое число свободных аминокислот. В желудочном соке детей грудного возраста, а также в секрете четвертого желудочка телят и других молодых жвачных животных содержится отличный от пепсина весьма активный фермент реннин. Он катализирует свертывание молока (превращение растворимого казеиногена в нерастворимый казеин). У взрослых людей эту функцию выполняет пепсин. Механизм этого процесса, несмотря на кажущуюся простоту, в деталях пока не выяснен. Предполагают, что реннин превращает растворимый казеиноген молока в параказеин, кальциевая соль которого нерастворима, и он выпадает в осадок. Интересно отметить, что после удаления ионов Са2+ из молока образования осадка не происходит. Наличие активного реннина в желудочном соке детей грудного возраста имеет, по-видимому, важное физиологическое значение, поскольку при свертывании молока, являющегося основным пищевым продуктом в этом возрасте, резко замедляется продвижение нерастворимого казеина через пищеварительный канал, в результате чего он дольше подвергается действию протеиназ.
64Поджелу́дочная железа́ (лат. pancreas, ПЖЖ) — о́рган пищеварительной системы позвоночных. У рыб поджелудочная железа слабо обособлена, более чёткое выделение в самостоятельный о́рган появляется у амфибий.[1] У птиц и млекопитающих поджелудочную железу огибает двенадцатиперстная кишка. Экзокринная (внешнесекреторная, или экскреторная) функция П. ж. заключается в секреции в двенадцатиперстную кишку сока, содержащего набор ферментов, гидролизующих все основные группы пищевых полимеров, основными из которых являются липаза, a-амилаза, трипсин и химотрипсин. Секреция неорганических и органических компонентов панкреатического сока происходит в разных структурных элементах П. ж. Синтез и секреция органических компонентов секрета (проферментов, ферментов, некоторых пептидных соединений) реализуются в ацинозных клетках, составляющих до 90% общей массы П. ж. Основные ферменты панкреатического сока секретируются в неактивной форме (трипсиноген, химотрипсиноген) и активизируются только в двенадцатиперстной кишке, превращаясь под действием энтерокиназы в трипсин и химотрипсин. Объем секрета ацинозных клеток невелик, и количество поджелудочного сока в основном определяется секрецией клеток протоков, в которых продуцируется жидкая часть секрета, изменяются его ионный состав и количество вследствие реабсорбции и ионного обмена. Различают три фазы секреции панкреатического сока: сложнорефлекторную, желудочную и кишечную. Сложнорефлекторная фаза происходит под действием условнорефлекторных (вид и запах пищи) и безусловнорефлекторных (жевание и глотание) раздражителей; секреция панкреатического сока начинается через 1—2 мин после приема пищи. Раздражение ядер передней и промежуточной гипоталамических областей стимулирует секрецию, а задней — тормозит ее. Секреция панкреатического сока в желудочной фазе, когда происходит растяжение желудка при наполнении его пищей, связана с влиянием блуждающего нерва, а также действием гастрина, выделяемого желудком. Основная фаза секреции панкреатического сока — кишечная: она имеет гуморальную природу и зависит от высвобождения двух кишечных гормонов — секретина и холецистокинина (панкреозимина). Секретин — пептидный гормон, выделяемый эндокриноцитами слизистой оболочки верхнего отдела тонкой кишки под действием соляной кислоты желудка, стимулирует секрецию большого количества насыщенного бикарбонатами и содержащего небольшое количество хлоридов и ферментов панкреатического сока. Кроме того, он обеспечивает создание нейтральной среды, что необходимо для активации панкреатических ферментов. Холецистокинин — полипептидный гормон верхнего отдела тонкой кишки, стимулирует секрецию панкреатического сока, богатого пищеварительными ферментами и обедненного бикарбонатами. На секреторную функцию П. ж. оказывают влияние гормоны щитовидной и паращитовидных желез, надпочечников. К стимуляторам панкреатической секреции относят такие вещества, как дофамин, соли кальция и магния, жирных кислот, жиры, белки и др.; к ингибиторам — кальцитонин, вазопрессин, адреналин, норадреналин и др. Голодание приводит к снижению объема сока и концентрации в нем ферментов, прием пищи стимулирует сокоотделение. При органических поражениях паренхимы П. ж. (например, в результате диффузного прорастания ее опухолью, при обтурации панкреатического протока, врожденной аплазии или оперативном удалении органа) отмечается значительное снижение сокоотделения вплоть до полного его прекращения (панкреатическая ахилия). Эндокринная (инкреторная) функция П. ж. заключается в продукции ряда полипептидных гормонов, поступающих в кровь; она осуществляется клетками панкреатических островков. Физиологическое значение инсулина заключается в регуляции углеводного обмена и поддержании необходимого уровня глюкозы в крови путем его снижения. Глюкагон обладает противоположным действием. Его основная физиологическая роль — регуляция уровня глюкозы в крови путем его увеличения; кроме того, он оказывает влияние на метаболические процессы в организме. Соматостатин ингибирует освобождение гастрина, инсулина и глюкагона, секрецию соляной кислоты желудком и поступление ионов кальция в клетки панкреатических островков. Панкреатический полипептид, более 90% которого продуцируется РР-клетками панкреатических островков и экзокринной частью П. ж., по своему эффекту является антагонистом холецистокинина. Гормоны поджелудочной железы. Поджелудочная железа является органом смешанной секреции. С одной стороны, она вырабатывает пищеварительные ферменты, которые по специальным каналам поступают в двенадцатиперстную кишку, при этом они находятся в неактивном состоянии. С другой стороны, ее клетки синтезируют рад гормонов, предназначенных для регуляции работы внутренних органов. Ответственны за синтез этих соединений особые клеточные скопления, называемые островками Лангерганса по имени ученого, который их открыл. Они рассредоточены по всему телу железы и не имеют специальных выводных путей. Их секрет поступает непосредственно в кровь и доставляется к органам-мишеням. Основными гормонами щитовидной железы являются следующие соединения:
Инсулин
Глюкагон
С-пептид
