
- •5Аминокислоты – производные карбоновых кислот или жирных кислот. Общая форма аминокислоты:
- •Ферменты поджелудочной железы. Поджелудочная железа является основной железой в системе пищеварения. Она секретирует ферменты в просвет двенадцатиперстной кишки.
- •86. Механизмы использования гликогена клетками.Синтез и фосфоролиз гликогена в печени.Понятие об анаэробном гликолизе и гликогенолизе.Энергитическая эффективность гликолиза.
- •98. Водорастворимые витамины это витамины группы в,аскорбиновая кислота,рр,р.
- •99. Водорастворимые витамины это витамины группы в,аскорбиновая кислота,рр,р.
- •Нейросекреторные клетки гипоталамуса:
Ферменты поджелудочной железы. Поджелудочная железа является основной железой в системе пищеварения. Она секретирует ферменты в просвет двенадцатиперстной кишки.
Протеазы:
Трипсин является протеазой, аналогичной пепсину желудка.
Химотрипсин — также протеаза, расщепляющая белки пищи.
Карбоксипептидаза
Несколько различных эластаз, расщепляющих эластин и некоторые другие белки.
Нуклеазы, расщепляющие нуклеиновые кислоты ДНК и РНК.
Стеапсин, расщепляющий углеводы.
Амилазу, расщепляющую крахмал и гликоген, а также другие углеводы.
Липаза поджелудочной железы является важнейшим ферментом в переваривании жиров. Она действует на жиры (триглицериды), предварительно эмульгированные желчью, секретируемой в просвет кишечника печенью.
65ПРОТЕОЛИТИЧЕСКИЕ ФЕРМЕНТЫ (протеазы), ферменты класса гидролаз, катализирующие гидролиз (протео-лиз) пептидных связей. Место расщепления пептидной связи в полипептидной цепи определяется позиционной и субстратной специфичностью фермента и пространств. структурой гидролизуемого субстрата (белка или пептида). Различают экзопептидазы, расщепляющие связи вблизи С- или N-конца цепи (соотв. карбоксипептидазы и аминопеп-тидазы)и эндопептидазы (протеиназы), гидролизующие связи, удаленные от концевых остатков (напр., трипсин). Лишь ограниченное число протеолитических ферментов обладает строгой субстратной специфичностью. К ним относят, напр., ренин, гидроли-зующий связь между остатками лейцина в положениях 10 и 11 в ангиотензиногене (предшественник ангиотензина пептида, участвующего в регуляции кровяного давления), или энтеропептидазу отщепляющую N-концевой гексапептид в трипсиногене (предшественник трипсина). Специфичность большинства протеолитических ферментов определяется в осн. структурой аминокислотного остатка, расположенного рядом с расщепляемой связью. Ферменты трипсинового типа катализируют гидролиз связей, образованных карбоксильной группой основных аминокислот (остатками лизина и аргинина). Для мн. ферментов (химотрипсин, пепсин, субтилизины и др.) важно наличие вблизи расщепляемой связи объемистых гидрофобных остатков (фенилаланина, тирозина, триптофана и лейцина). Протеолитические ферменты типа эластазы (фермент поджелудочной железы) гидролизуют связи, образованные аминокислотными остатками с небольшой боковой группой (напр., остатками аланина и серина). Место расщепления зависит от расположения пептидной связи в пространств. структуре субстрата-легче всего гидролизуются связи на р-изгибах цепи, к-рые расположены на пов-сти молекулы. Углеводные цепи в гликопротеинах могут препятствовать доступу фермента к данной связи. Многие протеолитические ферменты прочно ассоциированы с клеточными мембранами и поэтому действуют только на определенные белки (т. наз. компартментализация). К ним относят, напр., сигнальные протеазы, участвующие в транспорте белков во внеклеточное пространство. В зависимости от локализации фермента протеолиз происходит при разл. рН. Так, протеолитические ферменты желудка (напр., пепсин, гастриксин) функционируют при рН 1,5-2, лизосомные ферменты-при рН 4-5, а протеолитические ферменты сыворотки крови, тонкого кишечника и др.-при нейтральных или слабощелочных значениях рН. Нек-рые протеолитические ферменты используют в качестве кофактора ионы металлов-Са2+, Mg2+ и др. Дефектные и чужеродные белки деградируют в клетке при участии АТФ-зависимой системы протеолиза. У эукариот (все организмы, кроме бактерий и синезеленых водорослей) эта система включает низкомол. белок убикитин, образующий с белками-субстратами конъюгат, и протеазы, расщепляющие этот конъюгат.
Протеолитические ферменты играют важную роль во мн. процессах, происходящих в организме, напр. при оплодотворении, биосинтезе белка, свертывании крови и фибринолизе, иммунном ответе (активации системы комплемента), гормональной регуляции. Во мн. этих случаях фермент расщепляет в субстрате лишь одну или неск. связей (ограниченный протеолиз). Активность протеолитических ферментов регулируется на посттрансляц. стадии путем активации их неактивных предшественников (зи-могенов), а также действием прир. ингибиторов ферментов (a2-макроглобулина, a1антитрипсина, секреторного панк-реатич. ингибитора и др.). Нарушения механизмов регуляции активности протеолитических ферментов-причина мн. тяжелых заболеваний (мышечной дистрофии, аутоиммунных заболеваний, эмфиземы легких, панкреатитов и др.). Протеолитические ферменты применяют в медицине, напр. для коррекции нарушений пищеварения, заживления ран и ожогов и др. Их также используют для получения смесей аминокислот, применяемых для парэнтерального питания, в произ-ве гормональных препаратов и нек-рых антибиотиков, в пищ. и кожевенной пром-сти, произ-ве моющих ср-в.
66Желудочное содержимое (химус) в процессе переваривания поступает в двенадцатиперстную кишку. Низкое значение рН химуса вызывает в кишечнике выделение белкового гормона секретина, поступающего в кровь. Этот гормон в свою очередь стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО3-, что приводит к нейтрализации НСl желудочного сока и ингибированию пепсина. В результате рН резко возрастает от 1,5-2,0 до ∼7,0. Поступление пептидов в тонкий кишечник вызывает секрецию другого белкового гормона - холецистокинина, который стимулирует выделение панкреатических ферментов с оптимумом рН 7,5-8,0. Под действием ферментов поджелудочной железы и клеток кишечника завершается переваривание белков. 1. Активация панкреатических ферментов. В поджелудочной железе синтезируются проферменты ряда протеаз: трипсиноген, химотрипсиноген, проэластаза, прокарбоксипептидазы А и В. В кишечнике они путём частичного протеолиза превращаются в активные ферменты трипсин, химотрипсин, эластазу и карбок-сипептидазы А и В. Активация трипсиногена происходит под действием фермента эпителия кишечника энтеропептидазы. Образуется активный трипсин. Образовавшийся трипсин активирует химотрипсиноген, из которого получается несколько активных ферментов. Остальные проферменты панкреатических протеаз также активируются трипсином путём частичного протеолиза. В результате образуются активные ферменты - эластаза и карбокси-пептидазы А и В.Слизистая оболочка кишечника представляет собой сложно устроенную структуру кот состоит из ворсинок, а так же микроворсинок. На них сорбируются молекулы гидролитических ферментов протеаз, и на этих микроворсинках осущ-ся процессы пристеночного пищеварения. Пристеночное пищеварение функционально сопряжено с механизмами всасывания и отщепившиеся аминокислоты и др. мономеры целенаправленно транспортируются через клеточную мембрану. Протеазы – ферменты гидролизирующие белки, работают не только в пищеварительном тракте, но и явл-ся компонентами различных функциональных систем во внутренней среде организма.
Плазменные факторы свертывания крови, защитная система крови – комплемента –осуществляются за счет процессов протеолиза. Микрофлора кишечника способна использовать мономеры пищи и синтезировать из них ряд токсических продуктов. При сбалансированности эти токсины выступают в роли факторов стимулирующих антитоксические ресурсы печени(тренирует ее на яды).
67Биосинтез белков представляет собой сложный процесс. Принципиальные подходы к биосинтетич-му процессу предполагают:
1. наличие информации кот обеспечивает синтез уникальной структуры белка, при чем эта информация должна иметь возможность передачи из поколения в поколение. Это обеспечивается информационными биополимерами, к ним относ-ся нуклеиновые к-ты (ДНК и РНК).
Белки – мол-лы обеспечивающие передачу фенотипической информации.
2. В клетке должен быть создан специфич. Ферментный комплекс, обеспечивающий три важнейщих механизма передачи инфотрмации: а) Репликация представляющая собой синтез ДНК на матрице РНК. Перенос генетич. Информации от клетки к клетке.
Б) Транскрипция. Синтез матричной РНК (МРНК) на молекуле ДНК. Механизм внутриклеточной реализации информации для биосинтеза белка.
В) трансляция. Входе этого процесса генетич. Информация МРНК используется для синтеза белка в соответствующей последовательности.
68 - 69 1. Рибосомы. Представл. Собой нуклеотиды скомпонованные в струкурно фунциональные компелксы. Каждая клетка эукариот содержит более 100 рибосом. Каждая рибосома состоит из рибосомальных РНК и специфич. Белков, при чем синтез этих белков и рибосом происходит в цитоплазме, а «сборка» в объеме ядра. Собраные рибосомы переносяся из ядра в цитоплазму где возможна из группировка в полирибосомальные комплексы. 2. Матричные РНК – это молекула РНК синтезированные на РНК под влиянием фермента ДНК-зависимой РНК-полимеразы. Отсинтезировавщаяся МРНК переносится в цитоплазму. Далее в цитоплазме МРНК соедин-ся с рибосомами и олна служит матрицей на кот будет синтезироваться мол-ла белка. 3. Аминоацил- тРНК – синтетазы. Это ферменты кот-е обеспечивают важный процесс. Ои активируют аминокислоту и связывают аминокислоту с траспртными РНК. Обладают абсолютной специфичностью, каждый из них узнает 1 аминокислоту и связывает с 1 тРНК. 4. Транспортные РНК. Их более 60 и каждая из них обеспечивает связывание 1й аминокислоты. Но бывает что для одной кислоты несколько ТРНК. В уч-ке ТРНК есть уч-к кот наз-ся антикодоном. Он сост. Из 7 нуклеотидов при чем 3 из них образуют антикодоновый триплет. Эти триплетом ТРНК взаимодействуют с кодоном на матричной РНК.
70В структуре нуклеиновых кислот содержится 4 вида мононуклеотидов отличающихся от друг друга по азотистому основанию( А, Т, Ц, У). Защифровка последовательности аминокислот в молекуле осуществляется путем сочетания 3 нуклеотидов, т.е. имеет место триплетный код . !й триплет на МРНК – УУУ(уридины) шифует фенил – аланин.
Из 64 теоретич возможных кадонов, 61 кадон имеет смысл, т.е.кодирует одну аминокислоту. Три кадона УАГ, УАА и УГА были названы бессмысленными или нонсенс кадонами. Они выполняют важную функцию сигналдов окончания синтеза полипептида в рибосоме. Триплетный код является унивесальным для всех организмов.
71Этапы белкового синтеза. 1. Активирование аминокислот. Специфические ферменты амино-ацил тРНК синтетазы используя энергию АТФ вступают в реакцию с определенное аминокислотой и усаживает эту аминокислоту на на строго определенную тРНК. В рез-те этого образ-ся аминоацил-тРНК комплекс. 2. Инициация трансляции. Для ИТ необходимо: а) готовые рибосомы. Б) инициаторный аминоацил тРНК. В) МРНК. Г) инициирующий кадон в составе МРНК. Д) белкове факторы инициации. При взаимодествии всего этого происхидит активция рибосомы и открывается свободный аминоацильный центр к кот присоедин-ся следующая тРНК. 3. Элонгация трансляции. Подводится аминоацилтРНК кот будет взаимодействоать своим антикадоном с кадоном на МРНК и на этом этапе нач-сят фотрмирование пептидной связи с участием гуаназин трифосфата. Происходит транслокация МРНК относительно рибосомы, при этом освобожд-ся новый уч-к на МРНК. ЖЭта стадия повтор-ся до тех пор пока не будут пройдены все триплеты МРНК. 4. Терминация трансляции. Вступает в работу белковый фактор терминации. Он реагирует на появление в структуре МРНК нонсенс кадона и обеспеч отделение белковой молекулы от рибосомы, а так же освобождение тРНК. Вместе с этим происходит диссоциация работающей рибосомы на 2составные части. 5. Постсинтетическая модификация белковой молекулы. Синтезированный полипептид транслируется через мембраны клеток. Припоступлении полипептидной молекуля в то место, где она должна функионировать происходят с ней так наз-е посттрансляционные модификации. Мол-ла прибретает 3х мерную структуру. Ряд ферментов или гормлной кот выраб-ся в виде проферментов подверга.тся постсинтетическому протеолизу, кот предполагает отщепление этих полипептидных цепей короткого фрагмента, что активирует данный белок.
72Трансляция – процесс построения полипептидной цепи по иРНК. Трансляция у всех организмов (прокариот и эукариот) происходит в цитоплазме на рибосомах при участии ферментов, тРНК и аминокислот, с затратой энергии (АТФ). Трансляция подразделяется на инициацию, элонгацию, терминацию. Инициация трансляции представляет собой событие, в ходе которого происходит образованиe комплекса, включающего мРНК и рибосому. Первоначально рибосомы соединяется с фактором инициации. Затем этот теперь уже более сложный комплекс связывается с концом мРНК. Один из факторов инициации присоединяется к участку на молекуле мРНК. Прикрепившись к мРНК начинает скользить по некодирующей части мРНК до тех пор, пока не достигнет инициирующего кодона кодирующей нуклеотидной последовательности. Скольжение по мРНК сопровождается гидролизом АТФ, энергия которого затрачивается на преодоление участков спирализации в нетранслируемой части мРНК. Достигнув начала кодирующей последовательности мРНК, происходит связывание с другими факторами инициации за счёт гидролиза ГТФ до ГДФ и неорганического фосфата. При этом формируются новые центры рибосомы,Элонгация-это наращивание (удлинение) пептидной цепочки, как и весь процесс трансляции, происходит на рибосомах.
73Терминация трансляции наступает в том случае, когда в центр рибосомы попадает один из стоп-кодонов. Для стоп-кодонов нет соответствующих тРНК. Вместо этого к рибосоме присоединяются 2 белковых фактора терминации. Один из них с помощью пептидилтрансферазного центра катализирует гидролитическое отщепление синтезированного пептида от тРНК. Другой за счёт энергии гидролиза ГТФ вызывает диссоциацию рибосомы. В целом же рост и функционирование митохондрии невозможны без импорта белков. Каждый поступивший белок должен достичь определенного субкомпартмента, в котором он функционирует. И каждый из этих субкомпартментов содержит отличный от других набор белков. Рост митохондрий возможен за счет импорта цитоплазматических белков, включающего последовательный избирательный перенос белков через одну или две мембраны. В большинстве случаев энергия, затрачиваемая на перемещение, используется в виде АТФ.
74Все гены находятся в большой самовоспроизводящейся молекуле ДНК. Каждый из них представляет собой небольшой участок такой молекулы. Но по своим функциям гены неодинаковы. Одни из них несут информацию о последовательности аминокислот в. белковой молекуле, т. е. определяют ее структуру, другие регулируют активность первых и контролируют тем самым процесс поступления информации от ДНК к и-РНК. Первая группа генов, получила название Структурных, Вторая—Регуляторных. Структурные гены, контролирующие синтез ферментов в какой-то одной цепи реакций, расположены обычно рядом друг с другом. Они составляют единый блок, и осуществляют последовательные этапы синтеза одного фермента, работая согласованно, как один элемент. Структурный ген - любой ген, кодирующий какую-либо полипептидную цепь или молекулу РНК, включая регуляторные гены, которые кодируют продукты, определяющие другие структурные гены. РНК-полимераза - Фермент, осуществляющий матричный синтез РНК. В зависимости от используемой матрицы – ДНК или РНК – различают ДНК-зависимую и РНК-зависимую РНК-полимеразу. РЕГУЛЯТОРНЫЕ БЕЛКИ -группа белков, участвующих в регуляции разл. биохим. процессов. Подавляющее большинство таких Р. б. функционирует на уровне транскрипции (синтез матричных РНК, или мРНК, на ДНК-матрице) и отвечает за активацию или подавление синтеза мРНК.
75Один из мощных ингибиторов белкового синтеза – пуромицин. Он представляет собой аналог аминоацил-тРНК адениловой кислоты и поэтому легко взаимодействует с центром пептидил-тРНК с образованием пептидил-пуромицина. Пептидил-пуромицин тормозит элонгацию пептидной цепи, вызывая обрыв реакции, т.е. преждевременную терминацию синтеза белка. Он тормозит синтез всех типов клеточной РНК, особенно мРНК. Данное свойство объясняется тормозящим влиянием актиномицина D на ДНК-зависимую РНК-полимеразу, поскольку он связывается с остатками дезоксигуанозина цепи ДНК, выключая матричную функцию последней. Другим антибиотиком, также тормозящим синтез клеточной РНК, является используемый при лечении туберкулеза рифамицин. Этот препарат тормозит ДНК-зависимую РНК-полимеразу, связываясь с ферментом. Наиболее чувствительной к нему оказалась бактериальная РНК-полиме-раза.
76.???
77В мочевину входит азот , находящийся в белке. Синтез мочевмны на 90 % происходит в печени. Должна переноситься с кровью в почки. Нарушение конечного этапа метаболизма азотосодержащих веществ связана с печенью и с почками. При этом поражении печени приводит к задержки мочевины. В крови повышается содержание низкомолекулярных азотосодержащих веществ (продукциональная гиперазотоеммия) При поражение печени развивается резестентная гиперазотоеммия и в крови резко повышаеться содержание мочевины.
78ЛИПИДЫ (от греч. lipos - жир)- жироподобные в-ва, входящие в состав всех живых клеток. Иногда к липидам относят любые природные в-ва, извлекаемые из организмов, тканей или клеток. В нек-рых случаях липиды рассматривают как производные жирных к-т. В соответствии с хим. строением различают три осн. группы липидов: 1) жирные к-ты и продукты их ферментативного окисления, 2) глицеролипиды (содержат в молекуле остаток глицерина), 3) липиды, не содержащие в молекуле остаток глицерина (за исключением соед., входящих в первую группу). В первую группу входят наряду с жирными к-тами простагландины и др. гидроксикислоты; во вторую - моно-, ди- и триглицериды и большинство фосфолипидов; в третью группу входят сфинголипиды, стерины и воски. По др. классификации липиды подразделяют на нейтральные липиды, фосфолипиды и гликолипиды. Нейтральные липиды (жиры) представляют собой форму депонирования метаболической энергии. Фосфолипиды, гликолипиды и стерины - структурные компоненты биологических мембран; оказывают влияние на множество мембранных процессов, на транспорт ионов , активность мембраносвязанных ферментов, межклеточные взаимод. и рецепцию. Некоторые гликолипиды -рецепторы или корецепторы гормонов, токсинов, вирусов и др. Фосфатидилинозиты участвуют в передаче биол. сигналов. Эйкозаноиды - высокоактивные внутриклеточные регуляторы, межклеточные медиаторы, участвующие в развитии защитных реакций и воспалит. процессов.
79Жиры — сложные эфиры трехатомного спирта глицерина и высших или средних жирных кислот, главная составная часть животных жиров и растительных масел, присутствуют во всех животных и растительных тканях, в питании человека являются одним из основных пищевых веществ. Физико-химические свойства Жиров определяются природой остатков жирных кислот в их молекуле, содержащие значительные количества насыщенных жирных кислот (пальмитиновой, стеариновой и др.), имеют более высокую температуру плавления; Жиры, в состав которых входит много моно- и полиненасыщенных жирных кислот, при обычной температуре находятся в жидком состоянии и называются маслами. Растительные масла, характеризующиеся большим содержанием полиненасыщенных жирных кислот (льняное, маковое, тунговое масло), известны под названием высыхающих масел, т.к. под действием кислорода воздуха они полимеризуются и затвердевают. Биологическая полноценность Жиров. определяется наличием в их составе жирорастворимых витаминов A, D и Е, а также легкостью всасывания в желудочно-кишечном тракте. Жиры. хорошо растворяются в органических растворителях — бензоле, эфире, горячем спирте и не растворяются в воде. Нейтральные жиры вступают во все химические реакции, свойственные сложным эфирам (продуктам замещения атомов водорода в ОН-группах минеральных или карбоновых кислот). Для получения из растительных масел жиров более твердой консистенции, использующихся в качестве жировой основы при производстве маргаринов, применяется гидрогенизация (гидрирование), т.е. насыщение молекул этих масел водородом.
80В первую фазу β-окисления, в течение четырех реакций удаляются ацетил-Кофермент А от карбоксильного конца насыщенных ацил-Кофермента А: 1) дегидрирование α и β-атомов углерода 2) гидрирование с образованием транс- двойных связей 3) дегидрирование образованного L-β-гидроксиацил-КоА 4) КоА-зависимое расщепление с образованием β-кетоацил-КоА и укороченного на 2 атома углерода ацил-КоА. Во вторую фазу окисления жирных кислот, ацетил-КоА окисляется с образованием CO2. Большая часть свободной энергии окисления жирных кислот запасается в виде АТФ.
81. Фосфолипи́ды — сложные липиды, сложные эфиры многоатомных спиртов и высших жирных кислот. Содержат остаток фосфорной кислоты и соединенную с ней добавочную группу атомов различной химической природы.
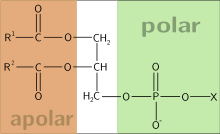 -это
фосфолепид.
-это
фосфолепид.
Классификация фосфолипидов:
В зависимости от входящего в их состав многоатомного спирта принято делить фосфолипиды на три группы:-глицерофосфолипиды (глицерофосфатиды) - содержат остаток глицерина ;-фосфатидилхолин (лецитин);-фосфатидилэтаноламин (кефалин);-фосфатидилсерин; -кардиолипин;-плазмены или плазмогены(этаноламиновый плазмоген); -фосфосфинголипиды - содержат остаток сфингозина ;-сфингомиелины;
-фосфоинозитиды - содержат остаток инозитола ;-фосфатидилинозитол.
Биологическая роль фосфолипидов-Главный липидный компонент клеточной мембран. Они сопутвуют жирам в пище и служат источником фосфорной кислоты, необходимый для жизни человека
Фосфолипиды — сложные липиды, в которых содержатся жирные кислоты, фосфорная кислота и дополнительная группа атомов, во многих случаях содержащая азот. Они есть во всех живых клетках. Содержатся в нервной ткани, участвуют в транспорте жиров, жирных кислот и холестерина.
Фосфолипиды входят в состав всех клеточных мембран. Между плазмой и эритроцитами происходит обмен фосфолипидами, которые играют важнейшую роль, поддерживая в растворимом состоянии неполярные липиды. Наиболее распространенная группа Фосфолипидов — фосфоглицериды, также к фосфолипидам относятся фосфосфинголипиды и фосфоинозитиды.
Фосфолипиды — амфифильные вещества. Они состоят из полярной «головки», в состав которой входит глицерин или другой многоатомный спирт, отрицательно заряженный остаток фосфорной кислоты и часто несущая положительный заряд группа атомов, и двух неполярных «хвостов» из остатков жирных кислот. Главная особенность фосфолипидов состоит в том, что «головка» у них гидрофильна, а «хвосты» гидрофобны. Это позволяет при нахождении в толще водной среды образовывать бислой — двойной слой фосфолипидных молекул, где гидрофильные головы с обеих сторон соприкасаются с водой, а гидрофобные хвосты упрятаны внутрь бислоя и тем самым защищены от контакта с водой.
Это определяет многие физические и химические свойства фосфолипидов, например, способность формировать липосомы и биологические мембраны (липидный бислой). Химическая структура полярной «головки» определяет суммарный электрический заряд и ионное состояние фосфолипида. «Хвосты» контактируют с липидным окружением, а «головки» — с водным, так как неполярные жирные хвосты не могут соприкасаться с водой.
82. Холестери́н— органическое соединение, природный жирный (липофильный) спирт. Нерастворим в воде, растворим в жирах и органических растворителях. Около 80 % холестерина вырабатывается самим организмом (печенью, кишечником, почками, надпочечниками, половыми желёзами), остальные 20 % поступают с пищей.[1] В организме находится 80 % свободного и 20 % связанного холестерина. Холестерин обеспечивает стабильность клеточных мембран в широком интервале температур. Он необходим для выработки витамина D, выработки надпочечниками различных стероидных гормонов, включая кортизол, кортизон, альдостерон, женских половых гормонов эстрогенов и прогестерона, мужского полового гормона тестостерона, а по последним данным — играет важную роль в деятельности синапсов головного мозга и иммунной системы, включая защиту от рака.Атеросклероз — это такое нарушение обмена, при котором в крови увеличивается содержание жироподобного вещества – холестерина,что приводит к формированию атеросклеротических бляшек в сосудах. Развитие атеросклероза может усиливаться по следующим причинам:
-Нервное перенапряжение. Стрессы.
-Наследственное нарушения деятельности некоторых желёз.
-Атеросклероз усиливается под влиянием пищевых погрешностей. -Переедание, особенно животных жиров, пищевых продуктов богатых холестерином (яиц, печёнки, животных масел и др.) - всего, что ведёт к ожирению.
-Курение также провоцирует атеросклероз.
83. Углеводы – это одна из важнейших составляющих нашего питания. По способности к гидролизу на мономеры углеводы делятся на две группы: простые (моносахариды) и сложные (олигосахариды и полисахариды). Сложные углеводы, в отличие от простых, способны гидролизоваться с образованием простых углеводов, мономеров. Простые углеводы легко растворяются в воде и синтезируются в зелёных растениях. Биологическое значение углеводов:
-Углеводы выполняют структурную функцию, то есть участвуют в построении различных клеточных структур (например, клеточных стенок растений).
-Углеводы выполняют защитную роль у растений (клеточные стенки, состоящие из клеточных стенок мертвых клеток защитные образования — шипы, колючки и др.).
-Углеводы выполняют пластическую функцию — хранятся в виде запаса питательных веществ, а также входят в состав сложных молекул (например, пентозы (рибоза и дезоксирибоза) участвуют в построении АТФ, ДНК и РНК.
-Углеводы являются основным энергетическим материалом. При окислении 1 грамма углеводов выделяются 4,1 ккал энергии и 0,4 г воды.
-Углеводы участвуют в обеспечении осмотического давления и осморегуляции. Так, в крови содержится 100—110 мг/% глюкозы. От концентрации глюкозы зависит осмотическое давление крови.
-Углеводы выполняют рецепторную функцию — многие олигосахариды входят в состав воспринимающей части клеточных рецепторов или молекул-лигандов.
Главными источниками углеводов из пищи являются: хлеб, картофель, макароны, крупы, сладости.
Глюконеогенез — процесс образования в печени и отчасти в корковом веществе почек (около 10 %) молекул глюкозы из молекул других органических соединений — источников энергии, например свободных аминокислот, молочной кислоты, глицерина. При голодании в организме человека активно используются запасы питательных веществ (гликоген, жирные кислоты). Они расщепляются до аминокислот, кетокислот и других неуглеводных соединений. Большая часть этих соединений не выводится из организма, а подвергаются реутилизации. Вещества транспортируются кровью в печень из других тканей, и используются в глюконеогенезе для синтеза глюкозы — основного источника энергии в организме. Таким образом при истощении запасов организма, глюконеогенез является основным поставщиком энергетических субстратов.
84. Моносахариды (от греческого monos: единственный, sacchar: сахар), — органические соединения, одна из основных групп углеводов; Моносахариды подразделяют на триозы, тетрозы, пентозы, гексозы и т. д. (3, 4, 5, 6 и т. д. атомов углерода в цепи).
Моносахариды - бесцветные кристаллические вещества, хорошо рстворимые в воде, плохо - в спирте, нерастворимые в эфире. Моносахариды - основной источник энергии в организме человека.
Самый важный моносахарид - глюкоза. Название произошло от греческого -
glykys - сладкий. Химическая формула - C6H12O6. Молекулы глюкозы выполняют роль биологического топлива в одном из важнейших энергегетических процессов в организме - в процессе гликолиза.
Гипогликемия- клинический симптом, обозначающий уменьшение содержания глюкозы в сыворотке крови. Причины:
-обезвоживание;-нерациональное питание со злоупотреблением рафинированными -углеводами, с резко выраженным дефицитом клетчатки, витаминов, минеральных солей;-лечение сахарного диабета инсулином, пероральными сахароснижающими препаратами при передозировке;-недостаточный или поздний прием пищи;-необычная физическая нагрузка;-болезни;-менструация у женщин;-злоупотребление алкоголем;
критическая недостаточность органа: почечная, печеночная или сердечная недостаточность, сепсис, истощение;-гормональная недостаточность: кортизол, гормон роста или они оба, глюкагон + адреналин;-не р-клеточная опухоль;-опухоль (инсулинома) или врождённые аномалии — 5-клеточная гиперсекреция, аутоиммунная гипогликемия, 7-эктопическая секреция -инсулина;-гипогликемии у новорожденных и детей;
Ги́пергликеми́я — клинический симптом, обозначающий увеличение содержания глюкозы в сыворотке крови. Причины:-Сахарный диабет;-Нарушения в питании; -Стресс
85. Са́харный диабе́т— группа эндокринных заболеваний, развивающихся вследствие абсолютной или относительной недостаточности гормона инсулина, в результате чего развивается гипергликемия — стойкое увеличение содержания глюкозы в крови. Заболевание характеризуется хроническим течением и нарушением всех видов обмена веществ: углеводного, жирового, белкового, минерального и водно-солевого.
Типы диабета:
-Диабет первого типа обычно развивается у молодых людей, у которых инсулин не вырабатывается в организме из-за повреждения или утраты бета-клеток поджелудочной железы. В результате этого организм не может использовать глюкозу и она накапливается в крови. В этом случае почки начинают выводить избыток глюкозы с мочой.
-Диабет второго типа наиболее. Обычно он развивается у людей старше 40 лет и имеющих избыточный вес. У них может быть нормальное, низкое или даже высокое содержание инсулина, и тем не менее, высокое содержание глюкозы в крови и диабет. Клетки организма не могут использовать инсулин должным образом. Одной из причин этого является отсутствие у клеток достаточного числа рецепторов для инсулина. В этом случае глюкоза не может полностью проникнуть в клетки и накапливается в крови.
Основные мероприятия при сахарном диабете первого типа направлены на создание адекватного соотношения между поглощёнными углеводами, физической нагрузкой и количеством введённого инсулина. Методы лечения, применяемые при сахарном диабете 2-го типа, можно разделить на 3 основные группы. Это немедикаментозная терапия, применяемая на ранних этапах заболевания, медикаментозная, применяемая при декомпенсации углеводного обмена, и профилактика осложнений, осуществляемая во время всего течения заболевания.
