
- •Вопрос1. Основные понятия кинематики.
- •Вопрос2. Скорость и ускорение.
- •Вопрос3. Кинематика вращ. Движения.
- •Вопрос4. 3 закона Ньютона.
- •Вопрос5. Центр масс и его движение. Закон сохранения импульса.
- •Вопрос6. Реактивное движение.
- •Вопрос7. Работа и мощность.
- •Вопрос8. Кинетическая энергия.
- •Вопрос9. Потенциальная энергия.
- •Вопрос10. Закон сохранения механической энергии.
- •Вопрос11. Упругий и неупругий удар шаров.
- •Вопрос12. Уравнение динамики вращательного движения.
- •Вопрос13. Теорема Штейнера.
- •Вопрос14. Работа при вращательном движении.
- •Вопрос15. Кинетическая энергия вращающегося тела.
- •Вопрос16. Закон сохранения момента импульса.
- •Вопрос17. Использование законов сохранения для решения задач.
- •Вопрос18. Гармонические колебательные движения.
- •Вопрос19. Динамика гармонических колебаний.
- •Вопрос20. Физический и математический маятники.
- •Вопрос21. Энергия колебательного движения.
- •Вопрос22. Сложение колебаний одинакового направления.
- •Вопрос23. Сложение взаимно перпендикулярных колебаний.
- •Вопрос24. Затухающие колебания.
- •Вопрос25. Вынужденные колебания. Резонанс.
- •Вопрос26. Распространение упругих волн.
- •Вопрос27. Уравнение плоской сферической волны.
- •Вопрос28. Уравнение плоской волны распространяющейся в произвольном направлении. Волновое уравнение.
- •Вопрос29. Скорость распространения упругих волн.
- •Вопрос30. Энергия упругой волны. Вектор Умова.
- •Вопрос31. Интерференция волн. Стоячие волны.
- •Вопрос32. Звук,ультразвук.
- •Вопрос33. Предмет молекулярной физики. Тепловое движение.
- •Вопрос34.Термодинамические параметры. Уравнение состояния.
- •Вопрос35.Изопроцессы в газах.
- •Вопрос36. Основное уравнение мкт.
- •Вопрос37. Распределение молекул по скоростям Максвелла
- •Вопрос38. Опыт Штерна.
- •Вопрос39. Барометрическая формула распределения Больцмана.
- •Вопрос40. Средняя длина свободного пробега молекул. Эффективный деаметр!
- •Вопрос41. Диффузия.
- •Вопрос42. Теплопроводность.
- •Вопрос43. Вязкость.
- •Вопрос44. Основные понятия и определения термодинамики.
- •Вопрос45. Внутренняя энергия системы тел.
- •Вопрос46.Теплота и работа.
- •Вопрос47. Первое начало термодинамики.
- •Вопрос48. Теплоемкости газов.
- •Вопрос49. Закон Дюлонга и Пти
- •Вопрос50. Уравнение Адиабаты. Политропические процессы.
- •Вопрос51. Работа в изопроцессах.
- •Вопрос52. Кпд тепловых двигателей (второе начало термодинамики)
- •Вопрос53. Цикл Карно.
Вопрос34.Термодинамические параметры. Уравнение состояния.
Термодинамические параметры
Параметры состояния
Термодинамические параметры - температура, плотность, давление, объем, удельное электрическое сопротивление и другие физические величины: - однозначно определяющие термодинамическое состояние системы; - не учитывающие молекулярное строение тел; и - описывающие их макроскопическое строение.
Уравне́ние состоя́ния — уравнение, связывающее между собой термодинамические (макроскопические) параметры системы, такие, кактемпература, давление, объём, химический потенциал и др. Уравнение состояния можно написать всегда, когда можно применять термодинамическое описание явлений. При этом реальные уравнения состояний реальных веществ могут быть крайне сложными. Уравнение состояния системы не содержится в постулатах термодинамики и не может быть выведено из неё. Оно должно быть взято со стороны (из опыта или из модели, созданной в рамках статистической физики).
Вопрос35.Изопроцессы в газах.
Из уравнения Менделеева - Клапейрона следуют законы, по которым изменяется состояние газов, когда один из параметров – температура, давление или объём остаются неизменным. В большинстве случаев при переходе газа из одного состояния в другое меняются все его параметры – температура, объём и давление. Так происходит, когда газ сжимается под поршнем в цилиндре двигателя внутреннего сгорания, в результате чего температура газа и его давление растут, а объём уменьшается. Однако в некоторых случаях изменения одного из параметров газа относительно малы или вообще отсутствуют. Такие процессы, где один из трёх параметров – температура, давление или объём остаются неизменными, называют изопроцессами, а законы, которые их описывают – газовыми законами. Изотермическим процессом называют изменение состояния газа, при котором его температура остаётся постоянной. Примером такого процесса может служить накачивание воздухом автомобильных шин. Однако изотермическим такой процесс можно считать, если сравнивать состояние воздуха перед тем, как он оказался в насосе, с его состоянием в шине после того, как температура шины и окружающего воздуха стали равными. Любые медленные процессы, происходящие с малым объёмом газа, окружённым большой массой газа, жидкости или твёрдого тела, имеющей постоянную температуру, можно считать изотермическими. Из уравнения состояния идеального газа (24.4) следует, что при изотермическом процессе произведение давления данной массы газа на его объём есть величина постоянная. Этот закон, называемый законом Бойля-Мариотта, был открыт английским учёным Р. Бойлем и французским физиком Э. Мариоттом и записывается в следующем виде:

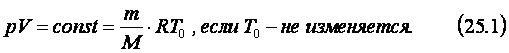


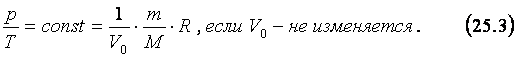
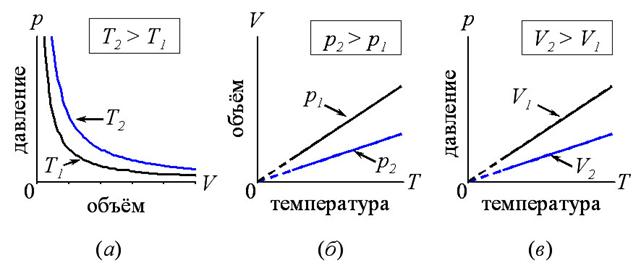
Рис. 25. а, б, в – изотермы, изобары и изохоры идеального газа, соответственно.
Адиабати́ческий,
или адиаба́тный
проце́сс (от др.-греч. ἀδιάβατος —
«непроходимый») — термодинамический
процесс в
макроскопической системе, при котором
система не обменивается тепловой
энергией с
окружающим пространством . Серьёзное
исследование адиабатических процессов
началось в XVIII веке[1].
Адиабатический процесс является частным
случаем политропного
процесса,
так как при нём теплоёмкость газа
равна нулю и, следовательно, постоянна[2].
Адиабатические процессы обратимы только
тогда, когда в каждый момент времени
система остаётся равновесной (например,
изменение состояния происходит достаточно
медленно) и изменения энтропии не
происходит. Некоторые авторы (в
частности, Л. Д. Ландау)
называли адиабатическими
только квазистатические адиабатические
процессы[3].
Адиабатический процесс для идеального
газа описывается
уравнением Пуассона.![]() Линия,
изображающая адиабатный процесс на
термодинамической диаграмме,
называется адиабатой.
Линия,
изображающая адиабатный процесс на
термодинамической диаграмме,
называется адиабатой.
