
- •Образ природы в неклассическом естествознании: тепловое излучение тел. Законы Вина и Стефана – Больцмана. Гипотеза Планка. Квантово – волновой дуализм света.
- •Образ природы в неклассическом естествознании: явление внешнего фотоэффекта.
- •Образ природы в неклассическом естествознании: гипотеза де Бройля. Соотношения неопределенностей.
- •Образ природы в неклассическом естествознании: квантовая механика. Уравнение Шредингера. Физический смысл волновой функции.
- •Образ природы в неклассическом естествознании: физика атома. Опыт э. Резерфорда. Квантовые числа, определяющие состояние электрона в атоме.
- •Образ природы в неклассическом естествознании: четыре фундаментальных взаимодействия в природе. Классификация элементарных частиц.
- •Квантовая физика в современных технологиях: ядерная энергетика. Дефект массы, энергия связи. Устойчивость ядер. Реакции деления (ядерный реактор, атомная бомба) и термоядерного синтеза.
- •Квантовая физика в современных технологиях: полупроводники.
- •Квантовая физика в современных технологиях: лазеры.
- •10 . Неклассические концепции в химии: Тепловой эффект и химическое равновесие реакции.
- •I. Тепловой эффект реакции.
- •II. Химическое равновесие реакции.
- •11. Неклассические концепции в химии: Скорость химической реакции.
- •12. Методы описания многочастичных систем, термодинамика, понятие о равновесном состоянии, уравнение состояния идеального газа. Статические распределения.
- •13. Основные положения классической термодинамики. Первое и второе начала термодинамики. Понятие об обратимых и необратимых процессах.
- •14. Второе начало термодинамики и энтропия. Энтропия, как мера беспорядка в системе. Формула Бельцмана.
- •15. Второе начало термодинамики и эволюционная парадигма. Открытые термодинамические системы. Понятия потока и градиента.
- •16. Основы неравновесной термодинамики. Градиент, поток, Флуктуация. Поведение различных систем при возникновении флуктуаций.
- •17. Понятие самоорганизации. Ячейки Бенара, диссипативные структуры, точка бифуркации. Бифуркционная диаграмма открытой сильнонеравновесной системы.
- •18. Самоорганизация и энтропия. Принцип Пригожина – Гленсдорфа.
- •19. Характерные признаки самоорганизации. Эволюционно – синергетическая парадигма.
- •20. Классическая наука о Вселенной. Возраст и размеры Вселенной. Закон Хаббла. Современная космологическая модель Вселенной.
- •21. Эволюция звёзд. Образование планетных систем. Гипотезы дальнейшего развития Вселенной. Эволюция Земли.
- •22. Эволюционные идеи в химии. Три основных направления исследований.
- •23. Эволюционные идеи в биологии. Концепции происхождения жизни на Земле.
- •24. Термодинамика и энергетика живых систем.
- •25. Концепция структурных уровней организации жизни: краткая характеристика каждого из уровней.
- •Молекулярно-генетический уровень.
- •27. Концепция структурных уровней организации жизни: клетка.
- •28. Воспроизводство жизни: днк, её состав и свойства.
- •29. Воспроизводство жизни: рнк, её состав и свойства.
- •30. Воспроизводство жизни: три стадии процесса воспроизводства. Ген. Основные направления развития генной инженерии.
- •31. Человек и природа: учение о биосфере.
- •32. Современный экологический кризис, его основные симптомы. Учение в.И. Вернадского о ноосфере.
I. Тепловой эффект реакции.
Герман Гесс, русский химик (1802–1850).
Закон Гесса: Тепловой эффект Q химической реакции зависит от состояния исходных веществ и продуктов реакции, но не зависит от промежуточных стадий реакции.
![]()
Qi — теплоты образования конечных и исходных веществ;
ri — стехиометрические коэффициенты реакции.
II. Химическое равновесие реакции.
Химическое равновесие может быть смещено как в сторону прямой, так и в сторону обратной реакции.
Принцип подвижного равновесия Ле Шателье (французский ученый 1850–1936 г.):
Внешнее воздействие на систему, находящуюся в состоянии химического равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
Пример: при повышении температуры равновесие смещается в сторону реакции, идущей с поглощением тепла.
11. Неклассические концепции в химии: Скорость химической реакции.
Факторы, определяющие скорость реакции:
Природа реагирующих веществ.
Площадь поверхности реагирования.
Для веществ в твердом состоянии скорость реакции прямо пропорциональна поверхности реагирующих веществ.
Концентрация веществ.
Закон действующих масс: скорость реакции жидких и газообразных веществ пропорциональна произведению их концентраций.
Температура.
Правило Вант-Гоффа: при повышении температуры на 10оС скорость реакции возрастает в 2- 4 раза.
Более
точно: формула Аррениуса:
![]()
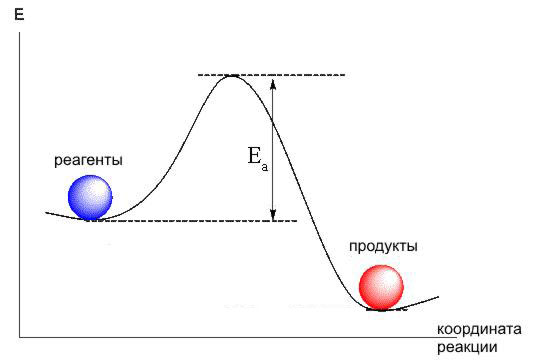
Катализатор.
Катализатор – активатор молекул реагента исходных химических веществ.
Катализ открыл в 1812 г. русский химик Кирхгоф К.С.
гетерогенный катализ – жидкие или газообразные реагенты на поверхности твердого катализатора;
гомогенный катализ - газы или жидкости;
электрокатализ - на поверхности электрода;
фотокатализ – под действием излучения.
Синтез аммиака: катализатор – железо; температура ~ 450°С, давление 30-100 МПа.
![]()
Учет каталитического действия среды есть одно из проявлений неклассического подхода в химии.
12. Методы описания многочастичных систем, термодинамика, понятие о равновесном состоянии, уравнение состояния идеального газа. Статические распределения.
 Метод
описания многочастичных систем
Метод
описания многочастичных систем
Термодинамический метод
Термодинамика - теория описания процессов в молекулярной системе с помощью макропараметров. Классическая термодинамика изучает только равновесные состояния и процессы. Термодинамическое равновесие – состояние системы, когда во всех ее частях значения макропараметров одинаковы. Связь макропараметров системы называется уравнением состояния.
Уравнение состояния идеального газа Менделеева –Клапейрона
![]()
Классическая термодинамика представляет собой теорию динамического типа.
Статистический метод
Молекулярная физика - теория описания процессов в молекулярной системе на основе их молекулярного строения.
Макросостояние системы определяется статистическими распределениями микропараметров.
Распределение Максвелла молекул газа по их скоростям:
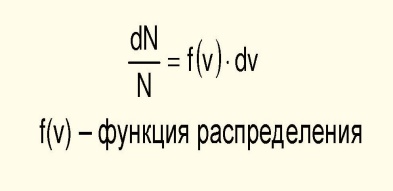
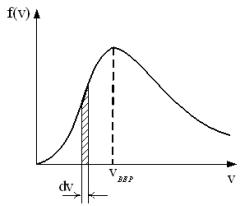
Молекулярная физика представляет собой теорию статистического типа.
