
- •1 Волновые процессы. Продольные и поперечные волны.
- •2.Уравнение бегущей волны, фазовая скорость и волновое уравнение
- •3. Принцип суперпозиции. Групповая скорость.
- •4.Оптика. Основные законы геометрической оптики
- •5.Полное отражение.Световоды.
- •7. Электомагнитные волны. Опыт Герца.
- •8.Дифференциальное уравнение электромагнитных волн.
- •10.Получение и использование эмв. Шкала эмв
- •11.Интерференция света. Условие интерференционного максимума и минимума
- •14. Интерференция света в тонких плёнках (вывод формулы).
- •16 Применение интерференции. Просветление оптики. Измерение чистоты оптики.
- •17.Дифракция Света
- •18. Метод зон Френеля. Зонная пластинка
- •19.Дифракция Френеля на круглом отверстии и диске.
- •22. Дифракция рентгеновских излучений. Формула Вульфа-Брэнггов. Рассеяние.
- •23. Разрешающая способность оптических приборов.
- •25 Поглощение света. Закон Бугера. Коэффициент поглощения.
- •26.Естественный и поляризованный свет.Закон Малюса
- •29. Искусственная оптическая анизотропия. Вращение плоскости поляризации.
- •30. Теплово́е излуче́ние. Спектральные характеристики теплового излучения
- •31 Законы теплового излучения абсолютно черного тела.
- •32. Функция Кирхгофа по Вину и по Рэлею-Джинсу
- •33. Квантовая гипотеза и формула Планка.
- •34.Внешний фотоэффект.Опыты Столетова. Законы фотоэффекта.
- •37 Давление всета. Опыты Лебедева.
- •38. Корпускулярно-волновая двойственность света. Фотоны. Энергия и импульс.
- •40 Волны де Бройля. Опыты Дэвиссона и Джермера.
- •41.Соотношение неопределённостей Гейзенберга
- •45.Тунельный эффект. Прозрачность потенциального барьера
- •46 Опыты Резерфорда. Спектры атома водорода. Сериальные закономерности.
- •47.Постулаты Бора.Опыт Франка и Герца.
- •48.Теория атома водорода по Бору
- •49.Атом водорода в квантовой механике.Квантовые числа.
- •52 Зонная теория твердых тел. Металлы, диэлектрики и полупроводники в зонной теории.
- •53.Собственная электропроводимость полупроводников
- •55 Состав атомного ядра. Ядерные силы. Энергия связи ядра.
- •56.Радиоактивные превращения.Виды радиоактивного излучения
- •58.Альфа-распад и его закономерности.
- •59.Бета-распад и его закономерности.
- •60.Гамма излучение.Механизмы его поглащения веществом.
- •61 Ядерные реакции и их классификации.
- •62.Ядерные реакции деления.Цепная реакция.Ядерный реактор.
- •63 Термоядерная реакция. Проблемы управления термоядерным синтезом
- •64 Общие сведенья об эч
- •65.Классификация эч
45.Тунельный эффект. Прозрачность потенциального барьера
1.Тунне́льный эффект— преодоление микрочастицей потенциального барьера в случае, когда её полная энергия (остающаяся при туннелировании неизменной) меньше высоты барьера. Туннельный эффект — явление исключительно квантовой природы, невозможное и даже полностью противоречащее классической механике. Явление тунне́льного эффекта лежит в основе многих важных процессов в атомной и молекулярной физике, в физике атомного ядра, твёрдого тела и т. д.
2.Для характеристики величины туннельного эффекта вводится коэффициент прозрачности барьера, равный модулю отношения плотности потока прошедших частиц к плотности потока упавших:
![]()
Для определения потока частиц используется следующая формула:
![]()
где знак * обозначает комплексное сопряжение.
Подставляя в эту формулу волновые функции, указанные выше, получим
![]()
Теперь,
воспользовавшись граничными условиями,
выразим сначала ![]() и
и ![]() через
через ![]() (с
учетом, что
(с
учетом, что ![]() ):
):
![]()
![]()
а
затем ![]() через
:
через
:
![]()
Введем величину
![]()
которая будет порядка единицы. Тогда:
![]()
Для потенциального барьера произвольной формы делаем замену
![]()
где ![]() и
и ![]() находятся
из условия
находятся
из условия
![]()
Тогда для коэффициента прохождения через барьер получаем выражение
![]()
46 Опыты Резерфорда. Спектры атома водорода. Сериальные закономерности.
Опыты Резерфорда Изучая рассеяние альфа-частиц при прохождении через золотую фольгу, Резерфорд пришел к выводу, что весь положительный заряд атомов сосредоточен в их центре в очень массивном и компактном ядре. А отрицательно заряженные частицы (электроны) обращаются вокруг этого ядра. Эта модель коренным образом отличалась от широко распространенной в то время модели атома Томсона, в которой положительный заряд равномерно заполнял весь объем атома, а электроны были вкраплены в него. Несколько позже модель Резерфорда получила название планетарной модели атома В 1912 г. Э.Резерфорд и его сотрудники поставили опыт по рассеянию альфа-частиц в веществе. Результатом опыта Резерфорда явилась ядерная модель атома
Спектры атома водорода При изучении излучения ученым удалось установить общие закономерности в характере спектров и найти ряд эмпирических законов, которым они подчиняются. Было установлено, что спектральные линии всех элементов можно разбить на ряд серий.
В 1885 году Бальмеру удалось найти формулу, описывающую распределение спектральных линий видимого спектра водорода:
![]() если
если
![]() серия
Лаймана;
серия
Лаймана;
![]() серия
Бальмера;
серия
Бальмера;
![]() серия
Пашена;
серия
Пашена;
![]() серия
Брэккета и т.д.
серия
Брэккета и т.д.
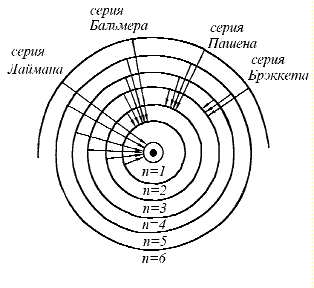
Сериальные закономерности.
Л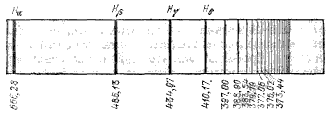 инейчатый
спектр атома представляет собой
совокупность большого числа линий,
разбросанных по всему спектру без
всякого видимого порядка. Однако
внимательное изучение спектров показало,
что расположение линий следует
определенным закономерностям. .
Впервые такая закономерность была
установлена для спектра водорода
инейчатый
спектр атома представляет собой
совокупность большого числа линий,
разбросанных по всему спектру без
всякого видимого порядка. Однако
внимательное изучение спектров показало,
что расположение линий следует
определенным закономерностям. .
Впервые такая закономерность была
установлена для спектра водорода
частоты отдельных линий водорода выражаются простой формулой:
![]()
где n означает частоту света.
R — называемая постоянной Ридберга величина, равная 3,28984•10-15 с-1, и m — целое число
Совокупность этих линий составляет серию Бальмера.
Частоты этих линий могут быть представлены формулами
![]() (серия
Лаймана),
(серия
Лаймана),
![]() (серия
Пашена),
(серия
Пашена),
причем R имеет то же самое числовое значение, что и в формуле Бальмера. Таким образом, все водородные серии можно объединить одной формулой:
г![]() де
n и m — целые числа, причем m³n+1. Спектры
других атомов значительно сложнее, и
распределение их линий в серии не так
просто. Оказалось, однако, что спектральные
линии всех атомов могут быть распределены
в серии. Крайне важно, что сериальные
закономерности для всех атомов могут
быть представлены в форме, подобной
формуле Бальмера, причем постоянная R
имеет почти одно и то же значение для
всех атомов.
де
n и m — целые числа, причем m³n+1. Спектры
других атомов значительно сложнее, и
распределение их линий в серии не так
просто. Оказалось, однако, что спектральные
линии всех атомов могут быть распределены
в серии. Крайне важно, что сериальные
закономерности для всех атомов могут
быть представлены в форме, подобной
формуле Бальмера, причем постоянная R
имеет почти одно и то же значение для
всех атомов.
