
21. Строение атома. Опыты Резерфорда. Закономерности в атомных спектрах водорода.
Строение атома.
А́том (неделимый) — наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств[1]. Атом состоит из атомного ядра и электронов. Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.
Субатомные частицы
Хотя слово атом в первоначальном значении обозначало частицу, которая не делится на меньшие части, согласно научным представлениям он состоит из более мелких частиц, называемых субатомными частицами. Атом состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также нейтроны.
Электрон является самой лёгкой из составляющих атом частиц с массой 9,11·10−31 кг, отрицательным зарядом и размером, слишком малым для измерения современными методами. Протоны обладают положительным зарядом и в 1836 раз тяжелее электрона (1,6726·10−27 кг). Нейтроны не обладают электрическим зарядом и в 1839 раз тяжелее электрона (1,6929·10−27 кг) При этом масса ядра меньше суммы масс составляющих его протонов и нейтронов из-за эффекта дефекта массы. Нейтроны и протоны имеют сравнимый размер, около 2,5·10−15 м, хотя размеры этих частиц определены плохо. Электроны в атомеПри описании электронов в атоме в рамках квантовой механики, обычно рассматривают распределение вероятности в 3n-мерном пространстве для системы n электронов.
Электроны в атоме притягиваются к ядру, между электронами также действует кулоновское взаимодействие. Эти же силы удерживают электроны внутри потенциального барьера, окружающего ядро. Для того, чтобы электрон смог преодолеть притяжение ядра, ему необходимо получить энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
Электронам, как и другим частицам, свойственен корпускулярно-волновой дуализм. Иногда говорят, что электрон движется по орбитали, что неверно. Состояние электронов описывается волновой функцией, квадрат модуля которой характеризует плотность вероятности нахождения частиц в данной точке пространства в данный момент времени, или, в общем случае, оператором плотности. Существует дискретный набор атомных орбиталей, которым соответствуют стационарные чистые состояния электронов в атоме.
Каждой орбитали соответствует свой уровень энергии. Электрон может перейти на уровень с большей энергией, поглотив фотон. При этом он окажется в новом квантовом состоянии с большей энергией. Аналогично, он может перейти на уровень с меньшей энергией, излучив фотон. Энергия фотона при этом будет равна разности энергий электрона на этих уровнях
Опыт РЕЗЕРФОРДА
Используя естественный источник радиоактивного излучения, Резерфорд построил пушку, дававшую направленный и сфокусированный поток частиц. Пушка представляла собой свинцовый ящик с узкой прорезью, внутрь которого был помещен радиоактивный материал. Благодаря этому частицы (в данном случае альфа-частицы, состоящие из двух протонов и двух нейтронов), испускаемые радиоактивным веществом во всех направлениях, кроме одного, поглощались свинцовым экраном, и лишь через прорезь вылетал направленный пучок альфа-частиц. Далее на пути пучка стояло еще несколько свинцовых экранов с узкими прорезями, отсекавших частицы, отклоняющиеся от строго заданного направления. В результате к мишени подлетал идеально сфокусированный пучок альфа-частиц, а сама мишень представляла собой тончайший лист золотой фольги. В нее-то и ударял альфа-луч. После столкновения с атомами фольги альфа-частицы продолжали свой путь и попадали на люминесцентный экран, установленный позади мишени, на котором при попадании на него альфа-частиц регистрировались вспышки. По ним экспериментатор мог судить, в каком количестве и насколько альфа-частицы отклоняются от направления прямолинейного движения в результате столкновений с атомами фольги.
Прежде всего, в экспериментах было замечено, что линии в спектрах расположены не беспорядочно, а сериями. Расстояние между линиями в серии закономерно уменьшается по мере перехода от длинных волн к коротким.
Швейцарский физик Й. Бальмер в 1885 году установил, что длины волн серии в видимой части спектра водорода могут быть представлены формулой:
|
, |
(6.1.1) |
|
где l0 = const, n = 3, 4, 5,…
В спектроскопии принято характеризовать спектральные линии не частотой, а величиной, обратной длине волны:
|
. |
(6.1.2) |
|
Если преобразовать (6.1.1) с учетом (6.1.2), то получим:
|
, |
(6.1.3) |
|
где – постоянная Ридберга, n = 3, 4, 5,…
В физике постоянной Ридберга называют и другую величину: = 3,29·1015c–1.
Формулу Бальмера (6.1.3) можно переписать в виде
|
. |
(6.1.4) |
|
Дальнейшие исследования показали, что в спектре водорода имеется еще несколько серий:
Серия Лаймона , n = 2, 3, 4,…
Серия Пашена ,n = 4, 5, 6,…
Серия Брэкета , n = 5, 6, 7,…
Серия Пфунда , n = 6, 7, 8,…
22.Постулаты бора
Постулаты Бора — основные допущения, сформулированные Нильсом Бором в 1913 году для объяснения закономерности линейчатого спектра атома водорода и водородоподобных ионов (формула Бальмера-Ридберга) и квантового характера испускания и поглощения света. Бор исходил из планетарной модели атома Резерфорда.
Постулаты (на рисунке модель атома бора)
Атом может находиться только в особенных стационарных, или квантовых, состояниях, каждому из которых отвечает определенная энергия. В стационарном состоянии атом не излучает электромагнитных волн.
Э
 лектрон
в атоме,
не теряя энергии, двигается по определённым
дискретным круговым орбитам, для которых
момент
импульса
квантуется:
лектрон
в атоме,
не теряя энергии, двигается по определённым
дискретным круговым орбитам, для которых
момент
импульса
квантуется:
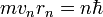 ,
где
,
где
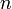 —
натуральные
числа,
а
—
натуральные
числа,
а
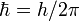 —
постоянная
Планка.
Пребывание электрона на орбите определяет
энергию этих стационарных
состояний.
—
постоянная
Планка.
Пребывание электрона на орбите определяет
энергию этих стационарных
состояний.При переходе электрона с орбиты (энергетический уровень) на орбиту излучается или поглощается квант энергии
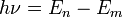 ,
где
,
где
 —
энергетические
уровни,
между которыми осуществляется переход.
При переходе с верхнего уровня на нижний
энергия излучается, при переходе с
нижнего на верхний — поглощается.
—
энергетические
уровни,
между которыми осуществляется переход.
При переходе с верхнего уровня на нижний
энергия излучается, при переходе с
нижнего на верхний — поглощается.
Используя данные постулаты и законы классической механики, Бор предложил модель атома, ныне именуемую Боровской моделью атома[1]. В дальнейшем Зоммерфельд расширил теорию Бора на случай эллиптических орбит. Её называют моделью Бора-Зоммерфельда.
Атом водорода — физическая система, состоящая из атомного ядра, несущего элементарный положительный электрический заряд, и электрона, несущего элементарный отрицательный электрический заряд. В состав атомного ядра может входить протон или протон с одним или несколькими нейтронами, образуя изотопы водорода. Электрон преимущественно находится в тонком концентрическом шаровом слое вокруг атомного ядра, образуя электронную оболочку атома. Наиболее вероятный радиус электронной оболочки атома водорода в стабильном состоянии равен боровскому радиусу a0 = 0,529 Å.
В 1913 году Нильс Бор предложил модель атома водорода, имеющую множество предположений и упрощений, и вывел из неё спектр излучения водорода. Предположения модели не были полностью правильны, но тем не менее приводили к верным значениям энергетических уровней атома.
Водородоподобный атом — атом, содержащий в электронной оболочке один и только один электрон.
Таким атомом, кроме водорода и его тяжёлых изотопов (дейтерия и трития), может быть любой ион, если число потерянных им электронов равно заряду атома - 1. Поскольку у такого иона остаётся только один электрон, его и называют водородоподобным атомом. Электронные спектры таких атомов описываются теорией Бора.
23.Опыт Франка-Герца. Недостатки теории Бора
Изучая методом задерживающего потенциала столкновения электронов с атомами газов (1913), Д. Франк и Г. Герц экспериментально доказали дискретность значений энергии атомов. Принципиальная схема их установки приведена на 1
В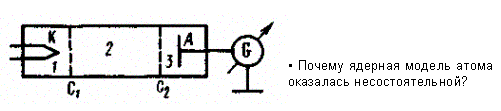 акуумная
трубка, заполненная парами ртути
(давление приблизительно равно 13 Па),
содержала катод (К), две сетки (C1
и С2)
и анод (А). Электроны, эмиттируемые
катодом, ускорялись разностью потенциалов,
приложенной между катодом и сеткой С1.
Между сеткой С2
и анодом приложен небольшой (примерно
0,5 В) задерживающий потенциал.
акуумная
трубка, заполненная парами ртути
(давление приблизительно равно 13 Па),
содержала катод (К), две сетки (C1
и С2)
и анод (А). Электроны, эмиттируемые
катодом, ускорялись разностью потенциалов,
приложенной между катодом и сеткой С1.
Между сеткой С2
и анодом приложен небольшой (примерно
0,5 В) задерживающий потенциал.
Электроны, ускоренные в области 1, попадают в область 2 между сетками, где испытывают соударения с атомами паров ртути. Электроны, которые после соударений имеют достаточную энергию для преодоления задерживающего потенциала в области 3, достигают анода. При неупругих соударениях электронов с атомами ртути последние могут возбуждаться. Согласно воровской теории, каждый из атомов ртути может получить лишь вполне определенную энергию, переходя при этом в одно из возбужденных состояний. Поэтому если в атомах действительно существуют стационарные состояния, то электроны, сталкиваясь с атомами ртути, должны терять энергию дискретно, определенными порциями, равными разности энергий соответствующих стационарных состояний атома.
Из опыта следует (рис. 2), что при увеличении ускоряющего потенциала вплоть до 4,86 В анодный ток возрастает монотонно, его значение проходит через максимум (4,86 В), затем резко уменьшается и возрастает вновь. Дальнейшие максимумы наблюдаются при 2×4,86 и 3×4,86 В.
Б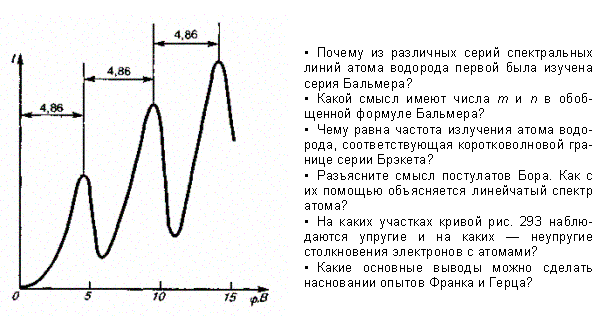 лижайшим
к основному, невозбужденному, состоянию
атома ртути является возбужденное
состояние, отстоящее от основного по
шкале энергий на 4,86 эВ. Пока разность
потенциалов между катодом и сеткой
меньше 4,86 В, электроны, встречая на своем
пути атомы ртути, испытывают с ними
только упругие соударения. При еj
= 4,86
эВ
энергия электрона становится достаточной,
чтобы вызвать неупругий удар, при котором
электрон отдает атому ртути всю
кинетическую энергию, возбуждая переход
одного из электронов атома из нормального
энергетического состояния на возбужденный
энергетический уровень. Электроны,
потерявшие свою кинетическую энергию,
уже не смогут преодолеть тормозящего
поля и достигнуть анода. Этим и объясняется
первое резкое падение анодного тока
при еj
= 4,86 эВ. При значениях энергии, кратных
4,86 эВ, электроны могут испытать с атомами
ртути 2, 3, ... неупругих соударения, потеряв
при этом полностью свою энергию, и не
достигнуть анода, т. е. должно наблюдаться
резкое падение анодного тока. Это
действительно наблюдается на опыте
(рис. 2).
лижайшим
к основному, невозбужденному, состоянию
атома ртути является возбужденное
состояние, отстоящее от основного по
шкале энергий на 4,86 эВ. Пока разность
потенциалов между катодом и сеткой
меньше 4,86 В, электроны, встречая на своем
пути атомы ртути, испытывают с ними
только упругие соударения. При еj
= 4,86
эВ
энергия электрона становится достаточной,
чтобы вызвать неупругий удар, при котором
электрон отдает атому ртути всю
кинетическую энергию, возбуждая переход
одного из электронов атома из нормального
энергетического состояния на возбужденный
энергетический уровень. Электроны,
потерявшие свою кинетическую энергию,
уже не смогут преодолеть тормозящего
поля и достигнуть анода. Этим и объясняется
первое резкое падение анодного тока
при еj
= 4,86 эВ. При значениях энергии, кратных
4,86 эВ, электроны могут испытать с атомами
ртути 2, 3, ... неупругих соударения, потеряв
при этом полностью свою энергию, и не
достигнуть анода, т. е. должно наблюдаться
резкое падение анодного тока. Это
действительно наблюдается на опыте
(рис. 2).
Таким образом, опыты Франка и Герца показали, что электроны при столкновении с атомами ртути передают атомам только определенные порции энергии, причем 4,86 эВ - наименьшая возможная порция энергии (наименьший квант энергии), которая может быть поглощена атомом ртути в основном энергетическом состоянии. Следовательно, идея Бора о существовании в атомах стационарных состояний блестяще выдержала экспериментальную проверку.
Атомы ртути, получившие при соударении с электронами энергию DЕ, переходят в возбужденное состояние и должны возвратиться в основное, излучая при этом, согласно второму постулату Бора (см. (210.2)), световой квант с частотой v = DЕ/h. По известному значению DЕ = 4,86 эВ можно вычислить длину волны излучения: l = hс/DЕ » 255 нм. Таким образом, если теория верна, то атомы ртути, бомбардируемые электронами с энергией 4,86 эВ, должны являться источником ультрафиолетового излучения с l » 255 нм. Опыт действительно обнаруживает одну ультрафиолетовую линию с l » 254 нм. Таким образом, опыты Франка и Герца экспериментально подтвердили не только первый, но и второй постулат Бора. Эти опыты сыграли огромное значение в развитии атомной физики.
Недостатки теории бора. Теория Бора была крупным шагом в развитии атомной физики и явилась важным этапом в создании квантовой механики. Однако эта теория обладает внутренними противоречиями (с одной стороны, применяет законы классической физики, а с другой - основывается на квантовых постулатах). В теории Бора рассмотрены спектры атома водорода и водородоподобных систем и вычислены частоты спектральных линий, однако эта теория не смогла объяснить интенсивности спектральных линий и ответить на вопрос: почему совершаются те или иные переходы? Серьезным недостатком теории Бора была невозможность описания с ее помощью спектра атома гелия - одного из простейших атомов, непосредственно следующего за атомом водорода.
24.Общее уравнение Шредингера. Уравнение Шредингера для стационарных состояний. Движение свободной частицы.
Уравне́ние Шрёдингера — уравнение, описывающее изменение в пространстве и во времени чистого состояния, задаваемого волновой функцией, в гамильтоновых квантовых системах. Играет в квантовой механике такую же важную роль, как уравнение второго закона Ньютона в классической механике. Его можно назвать уравнением движения квантовой частицы. Установлено Эрвином Шрёдингером в 1926 году.
Общий
случай В
квантовой
физике вводится комплекснозначная
функция
![]() ,
описывающая чистое состояние объекта,
которая называется волновой
функцией. В наиболее распространенной
копенгагенской
интерпретации эта функция связана с
вероятностью
обнаружения объекта в одном из чистых
состояний (квадрат модуля волновой
функции представляет собой плотность
вероятности). Поведение гамильтоновой
системы в чистом состоянии полностью
описывается с помощью волновой функции.
,
описывающая чистое состояние объекта,
которая называется волновой
функцией. В наиболее распространенной
копенгагенской
интерпретации эта функция связана с
вероятностью
обнаружения объекта в одном из чистых
состояний (квадрат модуля волновой
функции представляет собой плотность
вероятности). Поведение гамильтоновой
системы в чистом состоянии полностью
описывается с помощью волновой функции.
Отказавшись
от описания движения частицы с помощью
траекторий, получаемых из законов
динамики,
и определив вместо этого волновую
функцию, необходимо ввести в рассмотрение
уравнение, эквивалентное законам Ньютона
и дающее рецепт для нахождения
в
частных физических задачах. Таким
уравнением является уравнение Шрёдингера.
Пусть волновая
функция задана в N-мерном пространстве,
тогда в каждой точке с координатами
![]() ,
в определенный момент времени t
она будет иметь вид
,
в определенный момент времени t
она будет иметь вид
![]() .
В таком случае уравнение Шрёдингера
запишется в виде:
.
В таком случае уравнение Шрёдингера
запишется в виде:
![]()
где
![]() ,
,
![]() —
постоянная
Планка;
—
постоянная
Планка;
![]() —
масса частицы,
—
масса частицы,
![]() —
внешняя по отношению к частице
потенциальная
энергия в точке
,
—
внешняя по отношению к частице
потенциальная
энергия в точке
,
![]() —
оператор
Лапласа (или лапласиан), эквивалентен
квадрату оператора
набла и в n-мерной системе координат
имеет вид:
—
оператор
Лапласа (или лапласиан), эквивалентен
квадрату оператора
набла и в n-мерной системе координат
имеет вид:
![]()
Стационарное уравнение Шрёдингера
Форма
уравнения Шрёдингера показывает, что
относительно времени его решение должно
быть простым, поскольку время входит в
это уравнение лишь через первую
производную в правой части. Действительно,
частное решение для специального случая,
когда
![]() не
является функцией времени, можно записать
в виде:
не
является функцией времени, можно записать
в виде:
![]()
где
функция
![]() должна
удовлетворять уравнению:
должна
удовлетворять уравнению:
![]()
которое получается из уравнения Шрёдингера (1) при подстановке в него указанной выше формулы для (2). Заметим, что это уравнение вообще не содержит времени; в связи с этим оно называется стационарным уравнением Шрёдингера (уравнение Шрёдингера, не содержащее времени).
Выражение
(2)
является лишь частным
решением зависящего от времени
уравнения Шрёдингера (1),
общее решение представляет собой
линейную
комбинацию всех частных решений вида
(2).
Зависимость функции
![]() от
времени проста, но зависимость её от
координаты не всегда имеет элементарный
вид, так как уравнение (3)
при одном выборе вида потенциальной
функции
совершенно
отличается от того же уравнения при
другом выборе этой функции. В
действительности, уравнение (3)
может быть решено аналитически лишь
для небольшого числа частных типов
функции
.
от
времени проста, но зависимость её от
координаты не всегда имеет элементарный
вид, так как уравнение (3)
при одном выборе вида потенциальной
функции
совершенно
отличается от того же уравнения при
другом выборе этой функции. В
действительности, уравнение (3)
может быть решено аналитически лишь
для небольшого числа частных типов
функции
.
Свободная частица - частица, движущаяся в отсутствие внешних полей. Так как на свободную частицу (пусть она движется вдоль оси х) силы не действуют, то потенциальная энергия частицы U(x) = const и ее можно принять равной нулю. Тогда полная энергия частицы совпадает с ее кинетической энергией. В таком случае уравнение Шредингера (217.5) для стационарных состояний примет вид
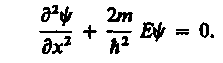 (219.1)
(219.1)
Прямой подстановкой можно убедиться в том, что частным решением уравнения (219.1) является функция y(x) = Aeikx, где A = const и k = const, с собственным значением энергии
![]() (219.2)
(219.2)
Функция y(x) = Aeikx = Ae(i/k)Ö2mEx представляет собой только координатную часть волновой функции Y(х, t). Поэтому зависящая от времени волновая функция, согласно (217.4),
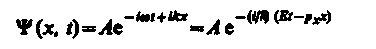 (219.3)
(219.3)
(здесь w = E/ℏ и k = px/ℏ). функция (219.3) представляет собой плоскую монохроматическую волну де Бройля (см. (217.2)).
Из выражения (219.2) следует, что зависимость энергии от импульса
![]()
оказывается обычной для нерелятивистских частиц. Следовательно, энергия свободной частицы может принимать любые значения (так как волновое число k может принимать любые положительные значения), т. е. ее энергетический спектр является непрерывным.
Таким образом, свободная квантовая частица описывается плоской монохроматической волной де Бройля. Этому соответствует не зависящая от времени плотность вероятности обнаружения частицы в данной точке пространства
![]()
т. е. все положения свободной частицы в пространстве являются равновероятными.
25.Волновая функция и ее физический смысл. Свойства волновой функции. Линейный гармонический асциллятор.
Волнова́я
фу́нкция,
или пси-функция ![]() — комплекснозначная
функция,
используемая в квантовой
механике
для описания чистого
состояния системы.
Является коэффициентом разложения
вектора
состояния
по базису (обычно координатному):
— комплекснозначная
функция,
используемая в квантовой
механике
для описания чистого
состояния системы.
Является коэффициентом разложения
вектора
состояния
по базису (обычно координатному):
![]() где
где
![]() —
координатный базисный вектор, а
—
координатный базисный вектор, а
![]() —
волновая функция в координатном
представлении.
—
волновая функция в координатном
представлении.
Физический смысл волновой функции заключается в том, что согласно копенгагенской интерпретации квантовой механики плотность вероятности нахождения частицы в данной точке пространства в данный момент времени считается равной квадрату абсолютного значения волновой функции этого состояния в координатном представлении.
В
координатном представлении волновая
функция
![]() зависит
от координат (или обобщённых координат)
системы. Физический смысл приписывается
квадрату её модуля
зависит
от координат (или обобщённых координат)
системы. Физический смысл приписывается
квадрату её модуля
![]() ,
который интерпретируется как плотность
вероятности
,
который интерпретируется как плотность
вероятности
![]() (для
дискретных спектров — просто
вероятность) обнаружить систему в
положении, описываемом координатами
(для
дискретных спектров — просто
вероятность) обнаружить систему в
положении, описываемом координатами
![]() в
момент времени
в
момент времени
![]() :
:
![]() .
.
Тогда
в заданном квантовом состоянии системы,
описываемом волновой функцией
,
можно рассчитать вероятность
![]() того,
что частица будет обнаружена в любой
области пространства конечного объема
того,
что частица будет обнаружена в любой
области пространства конечного объема
![]() :
:
![]()
![]() .
.
Гармонический
осциллятор
(в классической
механике) — это система,
которая при смещении из положения
равновесия испытывает действие
возвращающей силы
![]() ,
пропорциональной смещению
,
пропорциональной смещению
![]() (согласно
закону
Гука):
(согласно
закону
Гука):
![]()
где
![]() —
положительная константа, описывающая
жёсткость системы.
—
положительная константа, описывающая
жёсткость системы.
Если — единственная сила, действующая на систему, то систему называют простым или консервативным гармоническим осциллятором. Свободные колебания такой системы представляют собой периодическое движение около положения равновесия (гармонические колебания). Частота и амплитуда при этом постоянны, причём частота не зависит от амплитуды.
Если имеется ещё и сила трения (затухание), пропорциональная скорости движения (вязкое трение), то такую систему называют затухающим или диссипативным осциллятором. Если трение не слишком велико, то система совершает почти периодическое движение — синусоидальные колебания с постоянной частотой и экспоненциально убывающей амплитудой. Частота свободных колебаний затухающего осциллятора оказывается несколько ниже, чем у аналогичного осциллятора без трения.
Если осциллятор предоставлен сам себе, то говорят, что он совершает свободные колебания. Если же присутствует внешняя сила (зависящая от времени), то говорят, что осциллятор испытывает вынужденные колебания.
Механическими примерами гармонического осциллятора являются математический маятник (с малыми углами отклонения), груз на пружине, торсионный маятник и акустические системы. Среди других аналогов гармонического осциллятора стоит выделить электрический гармонический осциллятор (см. LC-цепь).
26.Частица в одномерной прямоугольной потенциальной яме
Частица в одномерной прямоугольной «потенциальной яме» c бесконечно высокими «стенками»
Проведем качественный анализ решений уравнения Шредингера применительно к частице в одномерной прямоугольной «потенциальной яме» с бесконечно высокими «стенками». Такая «яма» описывается потенциальной энергией вида (для простоты принимаем, что частица движется вдоль оси х)

где l - ширина «ямы», а энергия отсчитывается от ее дна

Уравнение Шредингера для стационарных состояний в случае одномерной задачи запишется в виде
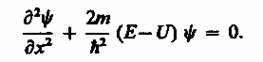 (220.1)
(220.1)
По условию задачи (бесконечно высокие «стенки»), частица не проникает за пределы «ямы», поэтому вероятность ее обнаружения (а следовательно, и волновая функция) за пределами «ямы» равна нулю. На границах «ямы» (при х = 0 и х = l) непрерывная волновая функция также должна обращаться в нуль. Следовательно, граничные условия в данном случае имеют вид
![]() т.
е. стационарное уравнение Шредингера,
описывающее движение частицы в
«потенциальной яме» с бесконечно
высокими «стенками», удовлетворяется
только при собственных значениях ,
зависящих от целого числа n.
Следовательно, энергия En
частицы
в «потенциальной яме» с бесконечно
высокими «стенками» принимает лишь
определенные дискретные значения, т.
е. квантуется. Квантованные значения
энергии En
называются
уровнями энергии, а число л, определяющее
энергетические уровни частицы, называется
главным квантовым числом. Таким образом,
микрочастица в «потенциальной яме» с
бесконечно высокими «стенками» может
находиться только на определенном
энергетическом уровне En,
или,
как говорят, частица находится в квантовом
состоянии n.
т.
е. стационарное уравнение Шредингера,
описывающее движение частицы в
«потенциальной яме» с бесконечно
высокими «стенками», удовлетворяется
только при собственных значениях ,
зависящих от целого числа n.
Следовательно, энергия En
частицы
в «потенциальной яме» с бесконечно
высокими «стенками» принимает лишь
определенные дискретные значения, т.
е. квантуется. Квантованные значения
энергии En
называются
уровнями энергии, а число л, определяющее
энергетические уровни частицы, называется
главным квантовым числом. Таким образом,
микрочастица в «потенциальной яме» с
бесконечно высокими «стенками» может
находиться только на определенном
энергетическом уровне En,
или,
как говорят, частица находится в квантовом
состоянии n.
27.Тунельный эффект. Холодная эмиссия электронов. Атом водорода по теории Шредингера. Квантовые числа.
Тунне́льный эффект, туннели́рование — преодоление микрочастицей потенциального барьера в случае, когда её полная энергия (остающаяся при туннелировании неизменной) меньше высоты барьера. Туннельный эффект — явление исключительно квантовой природы, невозможное и даже полностью противоречащее классической механике. Аналогом туннельного эффекта в волновой оптике может служить проникновение световой волны внутрь отражающей среды (на расстояния порядка длины световой волны) в условиях, когда, с точки зрения геометрической оптики, происходит полное внутреннее отражение. Явление туннелирования лежит в основе многих важных процессов в атомной и молекулярной физике, в физике атомного ядра, твёрдого тела и т. д.
