
Министерство науки и образования Российской Федерации
ГОУ ВПО «Уральский государственный технический университетУПИ»
Коррозия и защита металлов
Методические указания к решению задач
по курсу «Коррозия и защита металлов» для студентов
всех форм обучения металлургических специальностей
Екатеринбург
2004
УДК 669.1
Составитель В.В. Рогачев
Научный редактор доц., канд. техн. наук А.Н. Ватолин
КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ: Методические указания к решению задач по курсу «Коррозия и защита металлов» / В.В. Рогачев. Екатеринбург: УГТУ-УПИ, 2004. __ с.
В методических указаниях изложены краткие сведения о термодинамике и кинетике коррозионных процессов, протекающих как в газовых средах при высоких температурах, так и в растворах электролитов. Рассмотрены типовые задачи и способы их решения.
Библиогр. 6 назв. Рис. 5. Табл. 3. Прил. 4.
Подготовлено кафедрой «Теория металлургических процессов».
ГОУ ВПО «Уральский государственный
технический университетУПИ», 2004
1. Термодинамика газовой коррозии
Термодинамическая возможность протекания любого процесса при постоянных температуре и давлении определяется знаком изменения энергии Гиббса (G) в этом процессе. В соответствии с уравнением изотермы химической реакции
![]() .
(1.1)
.
(1.1)
Поэтому для определения возможности окисления металла газовой смесью заданного состава (нахождение знака G) необходимо сравнить константу равновесия (K) данной реакции окисления с произведением (П) веществ, участвующих в реакции.
Запишем уравнение химической реакции следующим образом:
![]() ,
(1.2)
,
(1.2)
где A, B, C, D - реагирующие вещества; m, n, p, q - стехиометрические коэффициенты.
Константа равновесия реакции (1.2) может быть выражена через равновесные активности реагентов
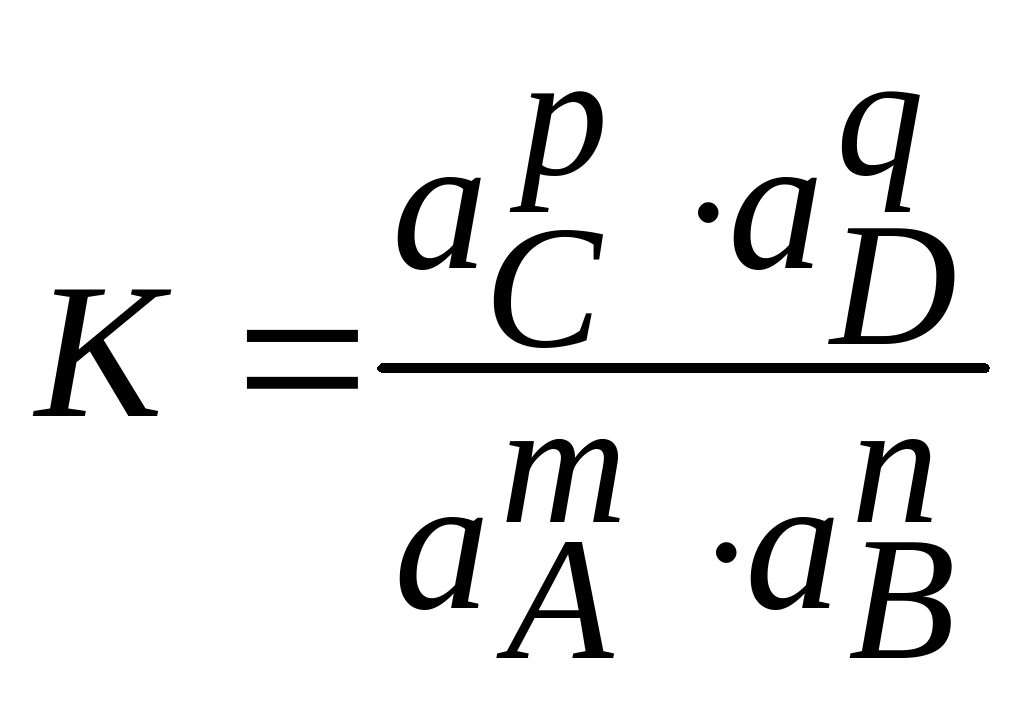 . (1.3)
. (1.3)
Произведение активностей записывается аналогично, с той разницей, что в выражении для П входят фактические (а не равновесные) активности реагентов. Активности чистых конденсированных веществ можно считать равными 1, а активности газов приравнять к их парциальным давлениям (в атмосферах).
Согласно уравнению
(1.1), если
![]() ,
то величина
,
то величина
![]() .
В этом случае химическая реакция может
протекать в прямом направлении (слева
направо). В случае, когда
.
В этом случае химическая реакция может
протекать в прямом направлении (слева
направо). В случае, когда
![]() (
(![]() ),
процесс может протекать только в обратном
направлении (справа налево). Наконец,
при равенстве П
и K
(
),
процесс может протекать только в обратном
направлении (справа налево). Наконец,
при равенстве П
и K
(![]() )
система будет находится в состоянии
равновесия. Последнее соотношение может
быть использовано для определения
максимального содержания окислителя
в газовой фазе, при котором процесс
коррозии невозможен.
)
система будет находится в состоянии
равновесия. Последнее соотношение может
быть использовано для определения
максимального содержания окислителя
в газовой фазе, при котором процесс
коррозии невозможен.
Для расчета константы равновесия химической реакции можно воспользоваться методом ТемкинаШварцмана, в котором используется уравнение следующего вида:
![]() (1.4)
(1.4)
где
![]() - стандартный тепловой эффект реакции,
протекающей при постоянном давлении и
- стандартный тепловой эффект реакции,
протекающей при постоянном давлении и
![]() К;
К;
![]() - изменение стандартной энтропии системы
в ходе данной реакции;
- изменение стандартной энтропии системы
в ходе данной реакции;
![]() ,
,
![]() ,
,
![]() - изменения в ходе процесса температурных
коэффициентов теплоемкостей, зависимости
которых от температуры обычно выражаются
уравнениями типа
- изменения в ходе процесса температурных
коэффициентов теплоемкостей, зависимости
которых от температуры обычно выражаются
уравнениями типа
![]() ;
;
![]() - величины, зависящие от температуры
процесса и определяемые уравнениями:
- величины, зависящие от температуры
процесса и определяемые уравнениями:
![]() ;
(1.5)
;
(1.5)
![]() ;
(1.6)
;
(1.6)
![]() . (1.7)
. (1.7)
Величины табулированы для температур 3003000 К с шагом в 100 К в справочнике [1, c. 92].
Расчет входящих
в уравнение (1.4) величин
![]() (
(![]()
![]() ,
a,
b,
c)
производится по формуле (см. реакцию
(1.2))
,
a,
b,
c)
производится по формуле (см. реакцию
(1.2))
![]() .
(1.8)
.
(1.8)
Например, для реакции
![]() (1.9)
(1.9)
![]() .
.
Значения
![]() ,
,
a,
b,
c
для отдельных веществ приведены в
таблицах термодинамических свойств
[1, 2] и в прил. 1.
,
,
a,
b,
c
для отдельных веществ приведены в
таблицах термодинамических свойств
[1, 2] и в прил. 1.
Следует обратить внимание на ряд характерных ошибок, допускаемых при расчете константы равновесия по уравнению (1.4).
В таблицах
термодинамических свойств значения
![]() приведены в кДж/моль, а значения
приведены в кДж/моль, а значения
![]() и
и
![]() в Дж/мольК,
поэтому взятые из таблиц значения
должны быть переведены в Дж/моль, т.е.
домножены на 1000.
в Дж/мольК,
поэтому взятые из таблиц значения
должны быть переведены в Дж/моль, т.е.
домножены на 1000.
В таблицах приведены
значения
![]() и
и
![]() ,
поэтому в уравнении (1.4) должны быть
подставлены значения
,
поэтому в уравнении (1.4) должны быть
подставлены значения
![]() и
и
![]() .
Аналогично для величин
.
Аналогично для величин
![]() и
и
![]() (если они берутся из таблицы:
(если они берутся из таблицы:
![]() и
и
![]() ).
).
В некоторых
справочниках (например, в [2]), в таблицах
для простых веществ величины
представляют собой теплоты образования
одноатомных газов и вследствие этого
отличаются от нуля. Поэтому для простых
веществ, которые в процессе нагрева от
температуры 298 К до температуры, указанной
в задаче, не испытывают фазовых
превращений, следует принимать
![]() .
.
В ряде случаев
расчет константы равновесия данной
реакции может быть значительно облегчен.
Например, записанную выше реакцию (1.9)
окисления хрома газовой смесью
![]() можно представить в виде разности двух
простейших реакций окисления:
можно представить в виде разности двух
простейших реакций окисления:
![]() (1.10)
(1.10)
и
![]() ,
(1.11)
,
(1.11)
причем стехиометрические коэффициенты в уравнении реакции (1.11) перед вычитанием должны быть утроены. Следовательно, и изменение стандартной энергии Гиббса реакции окисления хрома смесью может быть представлено в виде комбинации стандартных изменений энергии Гиббса реакций (1.10) и (1.11), т.е.
![]() .
(1.12)
.
(1.12)
Значения
![]() для простых реакций окисления могут
быть определены из эмпирических
температурных зависимостей типа
для простых реакций окисления могут
быть определены из эмпирических
температурных зависимостей типа
![]() ,
коэффициенты М
и N
для которых приведены, например, в [3,
6].
,
коэффициенты М
и N
для которых приведены, например, в [3,
6].
Максимальное содержание газа-окислителя, при котором коррозия металла не протекает (т.е. равновесное содержание этого газа при данной температуре), может быть найдено по известному значению константы равновесия. Для этого выразим константу равновесия реакции (1.9) через активности реагирующих веществ
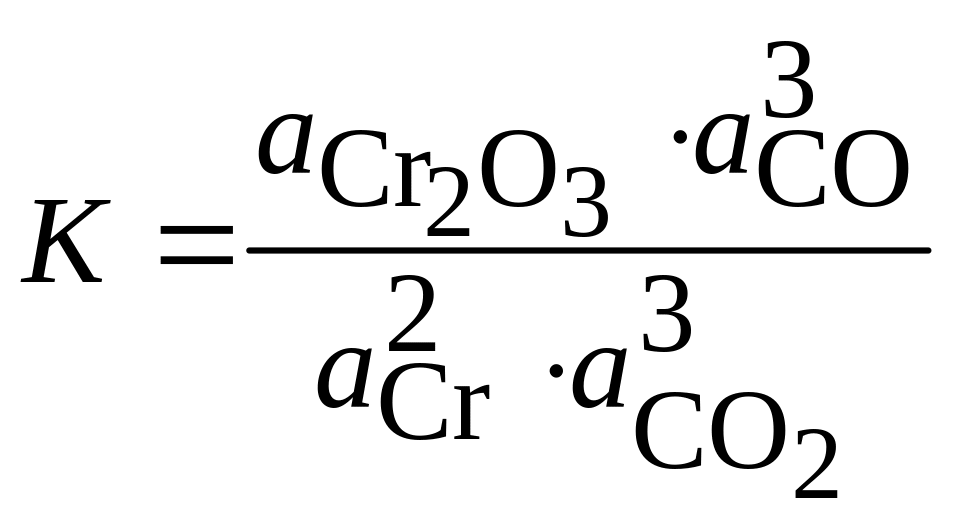 . (1.13)
. (1.13)
Для чистых
конденсированных веществ (Cr
и
![]() )
активности можно принять равными 1. Для
газообразных веществ активности выразим
через общее давление (Р)
в системе и процентное содержание
банного газа (% i)
в смеси:
)
активности можно принять равными 1. Для
газообразных веществ активности выразим
через общее давление (Р)
в системе и процентное содержание
банного газа (% i)
в смеси:
![]() . (1.14)
. (1.14)
Учитывая, что
![]() ,
получим из уравнения (1.13) выражение для
расчета равновесного содержания
газа-окислителя в реакции (1.9)
,
получим из уравнения (1.13) выражение для
расчета равновесного содержания
газа-окислителя в реакции (1.9)
![]() .
(1.15)
.
(1.15)
В данном случае
равновесное содержание
![]() не зависит от общего давления в системе,
однако если реакция окисления протекает
с изменением числа газовых молей, общее
давление также будет влиять на равновесное
содержание газа-окислителя. Например,
для реакции окисления железа кислородом
не зависит от общего давления в системе,
однако если реакция окисления протекает
с изменением числа газовых молей, общее
давление также будет влиять на равновесное
содержание газа-окислителя. Например,
для реакции окисления железа кислородом
![]() ,
,
![]() и
и
![]() . (1.16)
. (1.16)
При повышении
температуры константа равновесия
экзотермической реакции окисления
уменьшается (в соответствии с уравнением
изобары химической реакции), а равновесное
давление газа-окислителя увеличивается.
При некоторой температуре
![]() оно становится равным фактическому
давлению данного газа в атмосфере
оно становится равным фактическому
давлению данного газа в атмосфере
![]() .
При более высокой температуре окисление
металла в данной атмосфере становится
термодинамически невозможным.
.
При более высокой температуре окисление
металла в данной атмосфере становится
термодинамически невозможным.
Температура
может быть определена достаточно просто,
если имеется экспериментальная
зависимость
![]() для данной реакции окисления. Здесь
соответствует случаю, когда
для данной реакции окисления. Здесь
соответствует случаю, когда
![]() .
Если экспериментальных данных по
температурной зависимости
нет, необходимо использовать уравнение
ТемкинаШварцмана.
Поскольку данное уравнение является
трансцендентным, т. е. не может быть
решено непосредственно относительно
температуры, определение
проведем в несколько этапов. Сначала
воспользуемся приближенным уравнением
(в предположении того, что тепловой
эффект реакции окисления и изменение
энтропии в ходе реакции практически не
зависят от температуры)
.
Если экспериментальных данных по
температурной зависимости
нет, необходимо использовать уравнение
ТемкинаШварцмана.
Поскольку данное уравнение является
трансцендентным, т. е. не может быть
решено непосредственно относительно
температуры, определение
проведем в несколько этапов. Сначала
воспользуемся приближенным уравнением
(в предположении того, что тепловой
эффект реакции окисления и изменение
энтропии в ходе реакции практически не
зависят от температуры)
![]() (1.17)
(1.17)
и определим
ориентировочное значение
![]() ,
приняв
.
,
приняв
.
После этого следует
рассчитать константы равновесия данной
реакции по методу ТемкинаШварцмана
при двух температурах, отличающихся от
ориентировочно найденной на 50100
К в меньшую и большую стороны. Для узкого
температурного интервала можно
использовать прямолинейную зависимость
логарифма константы равновесия (![]() )
от обратной температуры (
)
от обратной температуры (![]() ).
Таким образом, для двух температур имеем
систему из двух уравнений с двумя
неизвестными коэффициентами А
и В.
).
Таким образом, для двух температур имеем
систему из двух уравнений с двумя
неизвестными коэффициентами А
и В.
![]() (1.18)
(1.18)
Определив коэффициенты А и В, подставляем их в уравнение
![]() (1.19)
(1.19)
и определяем из него искомую температуру , при которой в атмосфере заданного состава будут находиться в равновесии металл и его оксид. При более высокой температуре оксид металла будет термодинамически неустойчив, следовательно, процесс коррозии будет невозможен.
Пример.
Определить, при какой температуре
становится невозможной коррозия железа
в газовой смеси
![]() (10 объемных %
(10 объемных %
![]() ).
Продуктом взаимодействия является
).
Продуктом взаимодействия является
![]() .
Давление в системе равно одной атмосфере.
.
Давление в системе равно одной атмосфере.
Решение. Запишем уравнение реакции
![]() .
.
Произведение активностей для данной реакции может быть записано следующим образом:
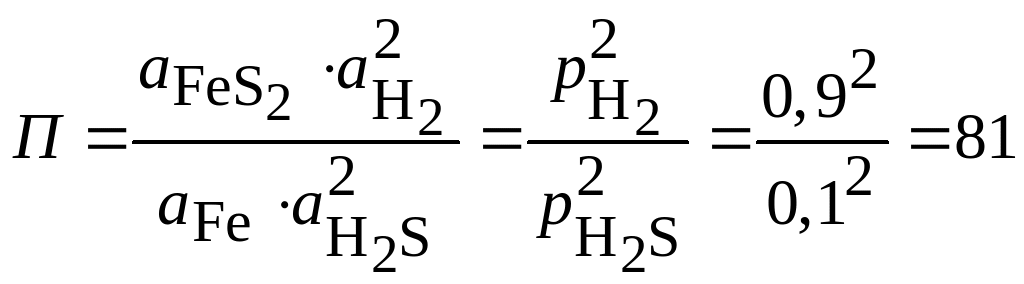 .
.
Коррозия железа
в данной газовой смеси будет невозможен
при
![]() ,
т.е. при
,
т.е. при
![]() .
.
Составим таблицу исходных данных.
Таблица 1.1
Вещество |
, |
|
|
||
|
кДж/моль |
Дж/мольК |
а |
|
|
Fe |
0 |
27,2 |
14,1 |
29,7 |
1,8 |
|
20,6 |
205,7 |
29,4 |
15,4 |
|
|
177,4 |
52,9 |
74,8 |
5,5 |
12,7 |
|
0 |
130,5 |
27,3 |
3,3 |
0,5 |
Изменения термодинамических свойств в ходе реакции определим согласно уравнению (1.8):
![]() ;
;
![]() кДж/моль;
кДж/моль;
![]() Дж/мольК;
Дж/мольК;
![]() ;
;
![]() ;
;
![]() .
.
Определим ориентировочное значение :
![]() .
.
Отсюда
![]() К.
К.
Определим значения для температур 800 и 900 К по уравнению (?.?).
Значение
![]() ,
,
позаимствуем из справочника [1, c.
92].
,
,
позаимствуем из справочника [1, c.
92].
![]() .
.
Аналогично
![]() .
.
Составим систему уравнений типа (1.18):
![]() ;
; ![]() .
.
Отсюда
![]() ,
,
![]() .
Подставляя эти значения и
.
Подставляя эти значения и
![]() в уравнение (1.19), получим
в уравнение (1.19), получим
![]() К.
К.
Выше этой температуры сульфид в атмосфере с 10 % образовываться не будет.
