
- •Ведение. Развитие энергетики в мире.
- •Раздел 1. Техническая термодинамика.
- •1.1. Предмет термодинамики.
- •1.2. Основные термодинамические параметры состояния.
- •1.3. Виды и формы обмена энергией.
- •1.4. Термодинамическая система. Термодинамическое равновесие.
- •1.5. Теплота и работа.
- •1.6. Уравнение состояния идеальных газов.
- •1.7. Газовая постоянная.
- •8. Смесь идеальных газов.
- •9. Первый закон термодинамики.
- •1.10. Обратимые и необратимые процессы.
- •1.11. Аналитическое выражение первого закона термодинамики.
- •1.12. Энтальпия.
- •1.13. Теплоемкость газов. Энтропия.
- •1.14. Удельная (массовая), объемная и молярная теплоемкость.
- •1.15. Теплоемкость при и . Уравнение Майера.
- •1.16. Средняя теплоемкость.
- •1.17. Термодинамические процессы идеальных газов.
- •18. Второй закон термодинамики.
- •1.19. Круговые термодинамические процессы.
- •1.20. Термодинамический кпд и холодильный коэффициент циклов.
- •1.21. Прямой обратимый цикл Карно.
- •1.22. Обратный обратимый цикл Карно.
- •1.23. Реальные газы. Водяной пар.
- •1.24. И диаграммы водяного пара.
- •1.25. Классификация холодильных установок, хладагенты и требования к ним.
- •1.26. Цикл воздушной холодильной установки.
- •1.27. Паровые компрессионные холодильные установки.
- •1.28. Циклы паротурбинных установок. Циклы Ренкина на насыщенном и перегретом паре.
- •Раздел 2. Теплообменные процессы.
- •2.1. Основные виды переноса теплоты.
- •2.1.1. Передача тепла теплопроводностью. Закон Фурье.
- •2.2. Теплопроводность плоской стенки
- •2.2.1. Теплопроводность цилиндрической стенки трубы.
- •2.3. Конвективный теплообмен. Виды движения теплоносителей.
- •2.4. Критериальные уравнения конвективного теплообмена.
- •2.5. Динамический и тепловой пограничные слои.
- •2.6. Лучистый теплообмен. Поглощение, отражение и испускание лучистой энергии.
- •Раздел 3. Теплообменные аппараты.
- •3.1. Классификация теплообменных аппаратов. Теплоносители.
- •3.1.1. Расчет рекуперативных Теплообменных аппаратов.
- •Раздел 4. Традиционные способы выработки тепловой и электрической энергии.
- •4.1. Энергетика и электрогенерирующие станции
- •4.2. Типы тепловых электростанций. Классификация.
- •4.3. Технологический процесс преобразования химической энергии топлива в электроэнергию на тэс
- •4.4. Преимущества и недостатки тэс
- •4.5. Ресурсы, потребляемые аэс, ее продукция, отходы производства
- •4.6. Представление о ядерных реакторах различного типа
- •4.8. Технологические схемы производства электроэнергии на аэс.
- •4.9. Паровые турбины. Устройство паровой турбины
- •4.9.1. Проточная часть и принцип действия турбины
- •4.9.2. Конструкция основных узлов и деталей паровых турбин
- •4.9.3. Типы паровых турбин и область их использования
- •4.9.4. Основные технические требования к паровым турбинам и их характеристики
- •4.10. Гту. Устройство и принцип действия
- •4.11. Пгу. Их классификация. Достоинства и недостатки.
- •4.12. Котельные установки. Общие понятия и определения
- •4.13. Классификация котельных установок.
- •4.14. Каркас и обмуровка котла.
- •4.15. Тепловой и эксергетический балансы котла Общее уравнение теплового баланса
- •4.16. Схемы подачи воздуха и удаления продуктов сгорания
- •4.16.1 Естественная и искусственная тяга. Принцип работы дымовой трубы.
- •4.17. Сепарационные устройства
- •4.18. Пароперегреватели
- •4.19. Водяные экономайзеры ку. Назначение, конструкция, виды
- •4.20. Воздухоподогреватели ку. Назначение, конструкция, виды
- •4.21. Топливо, состав и технические характеристики топлива. Понятие условного топлива, высшей и низшей теплоты сгорания
- •Раздел 5. Теплоснабжение.
- •5.1. Классификация систем теплоснабжения и тепловых нагрузок
- •5.2. Тепловые сети городов
- •5.3. Теплоэлектроцентрали
- •5.4. Преимущества раздельной и комбинированной выработки электроэнергии и тепла
- •Раздел 6. Нагнетатели.
- •6.1. Классификация нагнетателей. Области применения
- •6.2 .Производительность, напор и давление, создаваемые нагнетателем
- •6.3. Мощность и кпд нагнетателей. Совместная работа насоса и сети
- •Раздел 7. Двигатели внутреннего сгорания.
- •7.1. Классификация двигателей внутреннего сгорания
- •7.2. Принцип работы четырехтактного двигателя
- •7.3. Принцип работы двухтактного двигателя
- •7.4. Индикаторная диаграмма
- •7.5. История развития и параметры работы двс
- •7.6. Индикаторные диаграммы двс.
- •Раздел 8. Нетрадиционные и возобновляемые источники энергии.
- •8.1. Нетрадиционные и возобновляемые источники энергии
- •8.2. Прямое преобразование солнечной энергии
- •8.3. Преобразование солнечной в электрический ток
- •8.4. Гидроэнергетика
- •8.5. Основные принципы использования энергии воды
- •8.6. Гидроэлектростанции
- •8.7. Энергия волн. Энергия приливов (приливные электростанции)
- •8.8. Преобразование тепловой энергии океана в механическую
- •8.9. Ветрогенераторы. Устройство, категории, типы. Преимущества и недостатки
- •8.10. Приливные электростанции
- •8.11. Водородная энергетика
- •Принцип работы топливного элемента:
- •Содержание.
- •Раздел 1. Техническая термодинамика.
- •Раздел 2. Теплообменные процессы
- •Раздел 3. Теплообменные аппараты.
- •Раздел 4. Традиционные способы выработки тепловой и электрической энергии.
1.2. Основные термодинамические параметры состояния.
Предметом технической термодинамики является главным образом изучение процессов взаимного преобразования теплоты и работы в различных тепловых машинах.
В тепловых двигателях преобразование теплоты в работу осуществляется с помощью так называемого рабочего тела. Например, в двигателях внутреннего сгорания, а также в газотурбинных установках рассматриваются процессы, в которых рабочим телом является газ. В паровых двигателях рассматриваются процессы, в которых рабочим телом является пар, легко переходящий из парообразного состояния в жидкое и, наоборот, из жидкого в парообразное.
Физическое состояние тела вполне определяется некоторыми величинами, характеризующими данное состояние, которые в термодинамике называют параметрами состояния.
Параметрами состояния может быть целый ряд величин: удельный объем, давление, температура, внутренняя энергия, энтальпия, энтропия, концентрация, изохорно-изотермный потенциал и др.
Однако при отсутствии силовых полей (гравитационного, электромагнитного и др.) состояние однородного тела может быть однозначно определено тремя параметрами, в качестве которых в технической термодинамике принимают удельный объем, абсолютную температуру и давление.
Эти три параметра, называемые обычно основными, не являются, независимыми величинами и, как будет показано далее, связаны между собой вполне определенными математическими зависимостями.
Удельный объем. Удельным объемом однородного вещества называется объем, занимаемый единицей массы данного вещества. В технической термодинамике удельный объем обозначается v и измеряется в м3/кг:
![]()
где
![]() – объем
произвольного количества вещества, м3;
– объем
произвольного количества вещества, м3;
![]() – масса
этого вещества, кг.
– масса
этого вещества, кг.
Плотность тела определяется как масса единицы объема и измеряется в кг/м3:
![]()
Удельный объем есть величина, обратная плотности, т. е.
![]()
![]()
![]()
![]()
Давление. Давление с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенки сосуда, в котором заключен газ, и представляет собой нормальную составляющую силы, действующей на единицу поверхности.
В СИ давление измеряется в ньютонах на квадратный метр (н/м2).
В практических расчетах возможно применение кратных и дольных единиц измерения давления: килоньютон на 1 м2 (кн/м2), меганьютон на 1 м2 (Мн/м2); часто давление измеряется во внесистемных единицах – барах (1 бар = 105 н/м2). Однако необходимо помнить, что во все термодинамические формулы давление должно подставляться в ньютонах на квадратный метр (н/м2).
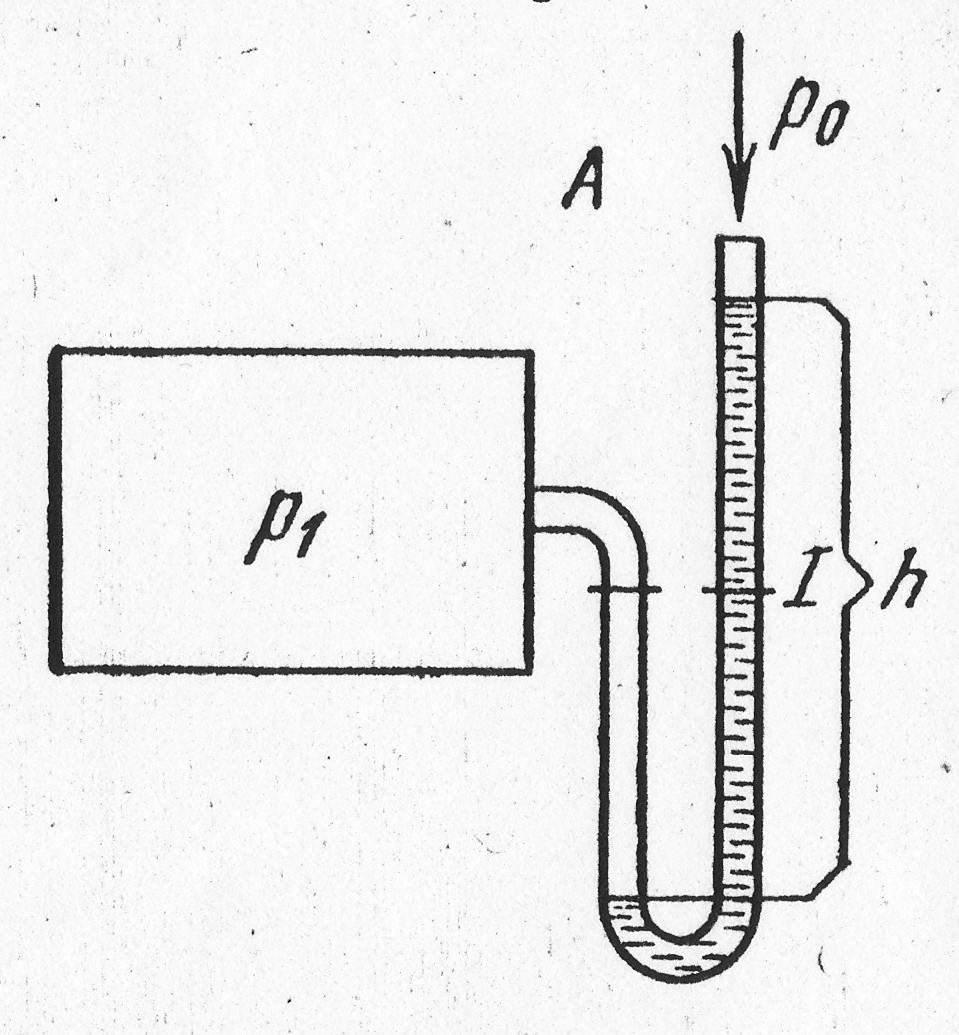
Рис. 1.2.1
Давление
может измеряться столбом жидкости –
ртути, воды, спирта и др., уравновешивающим
давление газа. На рис. 1.2.1 изображен
сосуд с газом. К стенке сосуда припаяна
изогнутая трубка, наполненная
какой-либо жидкостью. Давление в сосуде
![]() а атмосферное
давление
а атмосферное
давление
![]() ,
при этом
,
при этом
![]() .
Под действием разности давлений
.
Под действием разности давлений
![]() жидкость в правом колене поднимется и
уравновесит избыток давления в сосуде.
Отсюда можно написать равенство
жидкость в правом колене поднимется и
уравновесит избыток давления в сосуде.
Отсюда можно написать равенство
![]()
Откуда
![]()
Высота
столба жидкости
![]() прямо
пропорциональна разности давлений
в сосуде и наружной среды и обратно
пропорциональна плотности жидкости.
прямо
пропорциональна разности давлений
в сосуде и наружной среды и обратно
пропорциональна плотности жидкости.
Если разность давлений принять равной 1 бар, то высота при наполнении трубки ртутью равна
![]() мм.рт.ст.
мм.рт.ст.
где
![]() кг/м3
– плотность ртути при 0 °С;
кг/м3
– плотность ртути при 0 °С;
![]() м/сек2
–
ускорение
свободного падения (берется для данной
точки поверхности Земли).
м/сек2
–
ускорение
свободного падения (берется для данной
точки поверхности Земли).
При наполнении трубки водой высота равна
![]() м.
м.
Для измерения давлений применяют барометры и манометры, а для измерения разрежения – вакуумметры. Барометрами измеряют атмосферное давление, а манометрами – давление, превышающее атмосферное. Давление, превышающее атмосферное, называют избыточным.
Термодинамическим параметром состояния является только абсолютное давление. Абсолютным давлением называют давление, отсчитываемое от абсолютного нуля давления или от абсолютного вакуума. При определении абсолютного давления различают два случая:
1) когда давление в сосуде больше атмосферного и 2) когда оно меньше атмосферного. В первом случае абсолютное давление в сосуде равно сумме показаний манометра и барометра (рис. 1.3.1):
![]()
Во втором случае абсолютное давление в сосуде равно показанию барометра минус показание вакуумметра
![]()
Избыточное давление и разрежение не являются параметрами состояния, так как они при одном и том же абсолютном давлении могут принимать различные значения в зависимости от величины атмосферного давления.
Температура. Температура, характеризуя степень нагретости тел, представляет собой меру средней кинетической энергии поступательного движения его молекул, т. е. температура характеризует среднюю интенсивность движения молекул, и чем больше средняя скорость движения молекул, тем выше температура тела. Понятие температуры не может быть применено к одной или нескольким молекулам. Если два тела с различными средними кинетическими энергиями движения молекул привести в соприкосновение, то тело с большей средней кинетической энергией молекул (с большей температурой) будет отдавать энергию телу с меньшей средней кинетической энергией молекул (с меньшей температурой), и этот процесс будет протекать до тех пор, пока средние кинетические энергии молекул обоих тел не сравняются, т. е. не выровняются температуры обоих тел. Такое состояние двух тел называется тепловым равновесием.
Кинетическая
теория материи при тепловом равновесии
связывает среднюю кинетическую энергию
поступательного движения молекул
![]() с абсолютной
температурой идеального газа
с абсолютной
температурой идеального газа
![]() и устанавливает
между этими величинами прямую связь
и устанавливает
между этими величинами прямую связь
![]()
где
![]() – масса
молекулы;
– масса
молекулы;
![]() –
средняя
квадратичная скорость поступательного
движения молекул;
–
средняя
квадратичная скорость поступательного
движения молекул;
– абсолютная температура;
![]() – постоянная
Больцмана, равная 1,38∙10-23
Дж/град.
– постоянная
Больцмана, равная 1,38∙10-23
Дж/град.
Абсолютная
температура всегда величина положительная.
При температуре абсолютного нуля
![]() прекращается
тепловое движение молекул
прекращается
тепловое движение молекул
![]() .
Эта предельная минимальная температура
и является началом для отсчета абсолютных
температур.
.
Эта предельная минимальная температура
и является началом для отсчета абсолютных
температур.
В технике для измерения температур используют различные свойства тел: расширение тел от нагревания в жидкостных термометрах; изменение объема при постоянном давлении или изменение давления при постоянном объеме в газовых термометрах изменение электрического сопротивления проводника при нагревании в термометрах сопротивления; изменение электродвижущей силы в цепи термопары при нагревании или охлаждении ее спая. При измерении высоких температур оптическими пирометрами используются законы излучения твердых тел и методы сравнения раскаленной нити с исследуемым материалом.
ГОСТ 8550–61 предусматривает применение «двух температурных шкал: термодинамической температурной шкалы, основанной, на втором законе термодинамики, и международной практической температурной шкалы, являющейся практическим осуществлением термодинамической температурной шкалы с помощью реперных (опорных) точек и интерполяционных уравнений.
Измерение температур в каждой из этих шкал может производиться как в градусах Кельвина (°К), так и в градусах Цельсия (°С) в зависимости от принятого начала отсчета (положения нуля) по шкале.
В так называемой тройной точке воды, т. е. в точке, где жидкая, парообразная и твердая фазы находятся в устойчивом равновесии, температура в градусах Кельвина равна 273,16 °К (точно), а в градусах Цельсия 0,01 °С.
Следовательно, между температурами, выраженными в градусах Кельвина и градусах Цельсия, имеется следующее соотношение:
T(К) = 273,15 + t С.
Параметром
состояния является абсолютная температура,
измеряемая в градусах Кельвина. Градус
абсолютной шкалы численно равен
градусу шкалы Цельсия, так что
![]()
