
- •Ведение. Развитие энергетики в мире.
- •Раздел 1. Техническая термодинамика.
- •1.1. Предмет термодинамики.
- •1.2. Основные термодинамические параметры состояния.
- •1.3. Виды и формы обмена энергией.
- •1.4. Термодинамическая система. Термодинамическое равновесие.
- •1.5. Теплота и работа.
- •1.6. Уравнение состояния идеальных газов.
- •1.7. Газовая постоянная.
- •8. Смесь идеальных газов.
- •9. Первый закон термодинамики.
- •1.10. Обратимые и необратимые процессы.
- •1.11. Аналитическое выражение первого закона термодинамики.
- •1.12. Энтальпия.
- •1.13. Теплоемкость газов. Энтропия.
- •1.14. Удельная (массовая), объемная и молярная теплоемкость.
- •1.15. Теплоемкость при и . Уравнение Майера.
- •1.16. Средняя теплоемкость.
- •1.17. Термодинамические процессы идеальных газов.
- •18. Второй закон термодинамики.
- •1.19. Круговые термодинамические процессы.
- •1.20. Термодинамический кпд и холодильный коэффициент циклов.
- •1.21. Прямой обратимый цикл Карно.
- •1.22. Обратный обратимый цикл Карно.
- •1.23. Реальные газы. Водяной пар.
- •1.24. И диаграммы водяного пара.
- •1.25. Классификация холодильных установок, хладагенты и требования к ним.
- •1.26. Цикл воздушной холодильной установки.
- •1.27. Паровые компрессионные холодильные установки.
- •1.28. Циклы паротурбинных установок. Циклы Ренкина на насыщенном и перегретом паре.
- •Раздел 2. Теплообменные процессы.
- •2.1. Основные виды переноса теплоты.
- •2.1.1. Передача тепла теплопроводностью. Закон Фурье.
- •2.2. Теплопроводность плоской стенки
- •2.2.1. Теплопроводность цилиндрической стенки трубы.
- •2.3. Конвективный теплообмен. Виды движения теплоносителей.
- •2.4. Критериальные уравнения конвективного теплообмена.
- •2.5. Динамический и тепловой пограничные слои.
- •2.6. Лучистый теплообмен. Поглощение, отражение и испускание лучистой энергии.
- •Раздел 3. Теплообменные аппараты.
- •3.1. Классификация теплообменных аппаратов. Теплоносители.
- •3.1.1. Расчет рекуперативных Теплообменных аппаратов.
- •Раздел 4. Традиционные способы выработки тепловой и электрической энергии.
- •4.1. Энергетика и электрогенерирующие станции
- •4.2. Типы тепловых электростанций. Классификация.
- •4.3. Технологический процесс преобразования химической энергии топлива в электроэнергию на тэс
- •4.4. Преимущества и недостатки тэс
- •4.5. Ресурсы, потребляемые аэс, ее продукция, отходы производства
- •4.6. Представление о ядерных реакторах различного типа
- •4.8. Технологические схемы производства электроэнергии на аэс.
- •4.9. Паровые турбины. Устройство паровой турбины
- •4.9.1. Проточная часть и принцип действия турбины
- •4.9.2. Конструкция основных узлов и деталей паровых турбин
- •4.9.3. Типы паровых турбин и область их использования
- •4.9.4. Основные технические требования к паровым турбинам и их характеристики
- •4.10. Гту. Устройство и принцип действия
- •4.11. Пгу. Их классификация. Достоинства и недостатки.
- •4.12. Котельные установки. Общие понятия и определения
- •4.13. Классификация котельных установок.
- •4.14. Каркас и обмуровка котла.
- •4.15. Тепловой и эксергетический балансы котла Общее уравнение теплового баланса
- •4.16. Схемы подачи воздуха и удаления продуктов сгорания
- •4.16.1 Естественная и искусственная тяга. Принцип работы дымовой трубы.
- •4.17. Сепарационные устройства
- •4.18. Пароперегреватели
- •4.19. Водяные экономайзеры ку. Назначение, конструкция, виды
- •4.20. Воздухоподогреватели ку. Назначение, конструкция, виды
- •4.21. Топливо, состав и технические характеристики топлива. Понятие условного топлива, высшей и низшей теплоты сгорания
- •Раздел 5. Теплоснабжение.
- •5.1. Классификация систем теплоснабжения и тепловых нагрузок
- •5.2. Тепловые сети городов
- •5.3. Теплоэлектроцентрали
- •5.4. Преимущества раздельной и комбинированной выработки электроэнергии и тепла
- •Раздел 6. Нагнетатели.
- •6.1. Классификация нагнетателей. Области применения
- •6.2 .Производительность, напор и давление, создаваемые нагнетателем
- •6.3. Мощность и кпд нагнетателей. Совместная работа насоса и сети
- •Раздел 7. Двигатели внутреннего сгорания.
- •7.1. Классификация двигателей внутреннего сгорания
- •7.2. Принцип работы четырехтактного двигателя
- •7.3. Принцип работы двухтактного двигателя
- •7.4. Индикаторная диаграмма
- •7.5. История развития и параметры работы двс
- •7.6. Индикаторные диаграммы двс.
- •Раздел 8. Нетрадиционные и возобновляемые источники энергии.
- •8.1. Нетрадиционные и возобновляемые источники энергии
- •8.2. Прямое преобразование солнечной энергии
- •8.3. Преобразование солнечной в электрический ток
- •8.4. Гидроэнергетика
- •8.5. Основные принципы использования энергии воды
- •8.6. Гидроэлектростанции
- •8.7. Энергия волн. Энергия приливов (приливные электростанции)
- •8.8. Преобразование тепловой энергии океана в механическую
- •8.9. Ветрогенераторы. Устройство, категории, типы. Преимущества и недостатки
- •8.10. Приливные электростанции
- •8.11. Водородная энергетика
- •Принцип работы топливного элемента:
- •Содержание.
- •Раздел 1. Техническая термодинамика.
- •Раздел 2. Теплообменные процессы
- •Раздел 3. Теплообменные аппараты.
- •Раздел 4. Традиционные способы выработки тепловой и электрической энергии.
1.17. Термодинамические процессы идеальных газов.
К основным процессам, имеющим большое значение, как для теоретических исследований, так и для практических работ в технике, относятся: изохорный, протекающий при постоянном объеме; изобарный, протекающий при постоянном давлении; изотермический,, протекающий при постоянной температуре; адиабатный, протекающий при отсутствии теплообмена с внешней средой.
Кроме того, существует группа процессов, являющихся при определенных условиях обобщающими для основных процессов. Эти процессы называются политропными и характеризуются постоянством теплоемкости в процесса.
Для всех процессов устанавливается общий метод исследований, который заключается в следующем;
выводится
уравнение кривой процесса на
- и
![]() -диаграммах;
-диаграммах;
устанавливается зависимость между основными параметрами рабочего тела в начале и конце процесса;
определяется изменение внутренней энергии по формуле, справедливой для всех процессов идеального газа:
 ,
,
или при постоянной теплоемкости:
![]() ;
;
вычисляется работа изменения объема газа по основной формуле:
 ;
;
определяется удельное количество теплоты, участвующее в процессе, по формуле:
 ;
;
определяется изменение удельной энтальпии в процессе по формуле, справедливой для всех процессов идеального газа:

или для постоянной теплоемкости:
![]() ;
;
определяется
изменение удельной энтропии идеального
газа по формулам:
![]() ,
,
![]() .
.
Рассматриваемые процессы считаются обратимыми.
Изохорный процесс
Процесс,
протекающий при постоянном объеме,
называют изохорным
(![]() ,
или
,
или
![]() ).
Кривая процесса называется изохорой.
).
Кривая процесса называется изохорой.
При постоянном объеме давление газа изменяется прямо пропорционально абсолютным температурам:
![]() .
(1.17.1)
.
(1.17.1)
Внешняя
работа газа при
![]() равна нулю, так как
равна нулю, так как
![]() .
Следовательно,
.
Следовательно,
 .
.
Удельная
располагаемая (полезная) внешняя работа
![]() ,
которая может быть передана внешнему
объекту работы, равна:
,
которая может быть передана внешнему
объекту работы, равна:
 .
.
Если процесс 1-2 осуществляется с увеличением давления, то удельное количество теплоты в нем подводится, при этом увеличиваются внутренняя энергия и температура газа. Если давление в процессе понижается, то удельное количество теплоты отводится, уменьшаются внутренняя энергия и температура газа.
Изменение удельной энтропии в обратимом изохорном процессе определяем из уравнения:
![]() ,
,
Изменение энтропии при постоянной теплоемкости равно
 .
(1.17.2)
.
(1.17.2)
Как
видно из данного уравнения, изохора на
–
диаграмме
представляет собой кривую 1-2
(рис.
1.17.1). Подкасательная к кривой 1–2
в
любой ее точке дает значение истинной
теплоемкости
![]() .
.

Рис. 1.17.1
Изобарный процесс
Процесс,
протекающий при постоянном давлении,
называют изобарным
(![]() ,
или
).
Кривая процесса называется изобарой.
,
или
).
Кривая процесса называется изобарой.
Это соотношение называется законом Гей-Люссака. Для процесса 1-2
![]() .
(1.17.3)
.
(1.17.3)
В изобарном процессе объемы одного и того же количества газа изменяются прямо пропорционально абсолютным температурам.
При расширении газа его температура возрастает, при сжатии – уменьшается.
Удельная работа изменения объема при этом выражается следующим уравнением:
 ,
(1.17.4)
,
(1.17.4)
или
![]() .
(1.17.5)
.
(1.17.5)
Для обратимого изобарного процесса при постоянной теплоемкости изменение удельной энтропии находится по уравнению:
![]() ,
,
Но
при
![]()
![]() ,
поэтому
,
поэтому
![]() .
(1.17.6)
.
(1.17.6)
В
случае изохорного и изобарного процессов
в одном интервале температур
возрастание энтропии будет больше в
изобарном
процессе, так как
![]() всегда
больше
всегда
больше
![]() .
.
Изотермный процесс
Процесс,
протекающий при постоянной температуре,
называют изотермическим
(![]() ,
или
,
или
![]() ).
Кривая процесса называется изотермой
(рис. 18.2).
).
Кривая процесса называется изотермой
(рис. 18.2).
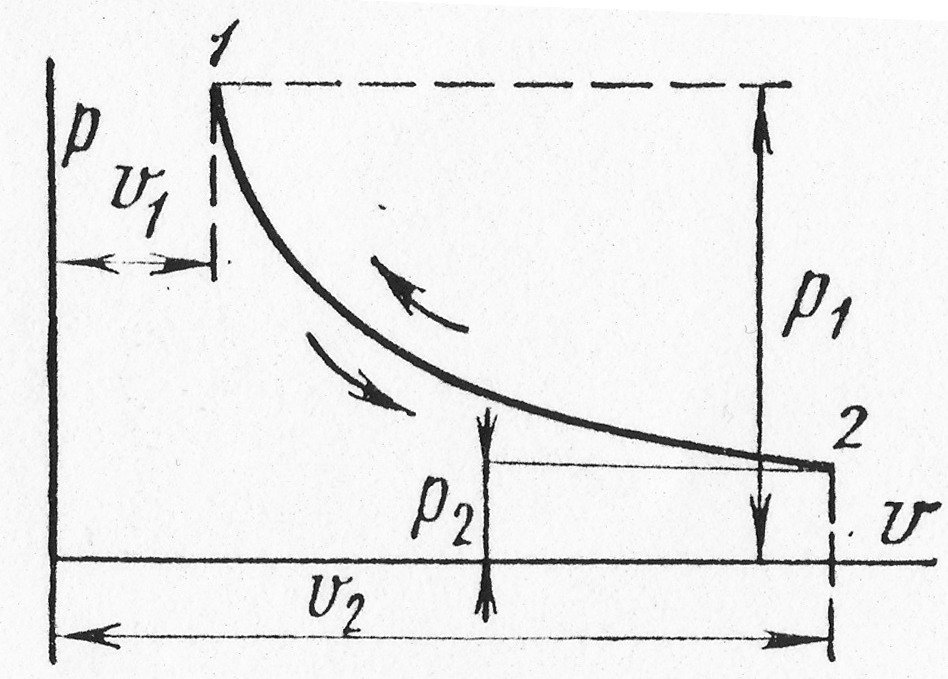
Рис. 1.17.2
![]() и
и
![]() (1.17.7)
(1.17.7)
При постоянной температуре объем газа изменяется обратно пропорционально его давлению (закон Бойля – Мариотта).
На
![]() –
диаграмме изотермный процесс представляет
собой равнобокую гиперболу.
–
диаграмме изотермный процесс представляет
собой равнобокую гиперболу.
Зная уравнение изотермного процесса для идеального газа, можно подсчитать работу процесса.

![]() .
(1.17.8)
.
(1.17.8)
Удельная располагаемая внешняя работа определяется по формуле:
![]() ,
(1.17.9)
,
(1.17.9)
т.
е. в изотермном процессе идеального
газа
![]() ,
или
удельная работа изменения объема,
располагаемая
(полезная) работа и удельное количество
теплоты, полученное телом, равны между
собой.
,
или
удельная работа изменения объема,
располагаемая
(полезная) работа и удельное количество
теплоты, полученное телом, равны между
собой.
![]()
откуда
![]() и
и
![]() (1.17.10)
(1.17.10)
Удельное
количество теплоты, участвующее в
изотермическом процессе, равно
произведению изменения удельной энтропии
![]() на
абсолютную температуру
:
на
абсолютную температуру
:
![]()
Адиабатный процесс
Процесс, протекающий без подвода и отвода теплоты, т. е. при отсутствии теплообмена рабочего тела с окружающей средой, называют адиабатным.
![]() (1.17.11)
(1.17.11)
При адиабатном процессе произведение давления на объем газа в степени есть величина постоянная. Величину называют показателем адиабаты. Рассмотрим зависимость между основными параметрами в адиабатном процессе.
Из уравнения адиабаты следует, что
 и
и

 .
.
Удельная
работа изменения объема
 ,
совершаемая
телом над окружающей средой при
равновесном адиабатном процессе, может
быть вычислена по уравнению адиабаты
,
совершаемая
телом над окружающей средой при
равновесном адиабатном процессе, может
быть вычислена по уравнению адиабаты
![]() .
(1.17.12)
.
(1.17.12)
Из выражения (18.12) могут быть получены следующие формулы:
![]() и
и
![]() .
.
Вычислим располагаемую (полезную) внешнюю работу в адиабатном процессе, равную:
 .
.
Следовательно,
![]() (1.17.13)
(1.17.13)
И
![]() .
.
Политропные процессы
Условились всякий процесс идеального газа, в котором теплоемкость является постоянной величиной, называть политропным процессом, а линию процесса – политропой.
Они протекают при постоянной теплоемкости.
![]() (1.17.14)
(1.17.14)
![]() (1.17.15)
(1.17.15)
Показатель
политропы
![]() принимает
для каждого процесса определенное
числовое значение. Для основных процессов:
изохорных
принимает
для каждого процесса определенное
числовое значение. Для основных процессов:
изохорных
![]() ,
изобарных
,
изобарных
![]() ,
изотермических
,
изотермических
![]() и адиабатных
и адиабатных
![]() .
.
Поскольку уравнение политропы отличается от уравнения адиабаты только величиной показателя , то, очевидно, все соотношения между основными параметрами могут быть представлены формулами, аналогичными адиабатному процессу:
![]()
![]()
![]()
Уравнение удельной работы изменения объема, совершаемой телом при политропном процессе, имеет аналогичный вид с уравнением работы в адиабатном процессе, т. е.
![]() (1.17.16)
(1.17.16)
Для конечного изменения состояния
![]() .
(1.17.17)
.
(1.17.17)
