
- •Типы межатомных связей. Влияние на свойства материалов.
- •3) Металлическая связь
- •4) Связь Ван – дер – Вальса
- •Кристаллические и аморфные материалы. Кристаллическое строение. Основные типы кристаллических решеток.
- •Анизотропия кристалла и изотропия кристаллических тел.
- •Идеальное строение металла. Отклонение в строении реальных (технических) металлах и влияние на их свойства.
- •Дефекты кристаллического строения. Кристалл, зерно.
- •Первичная кристаллизация. Влияние скорости охлаждения на структуру и свойства металлов. Модификация.
- •Зерно в сплавах. Влияние величины зерна на свойства. Причины роста зерна и возможности его измельчения.
- •Природа модифицирования и модификаторы металлических сплавов.
- •Сплавы. Основные понятия и термины.
- •Сплавы. Классификация сплавов. Зависимость структуры сплава от положения компонентов в периодической системе д.И. Менделеева.
- •1. Хим. Соединения:
- •2. Твердые растворы:
- •Диаграммы состояния сплавов. Правило отрезков.
- •Диаграммы состояния двойных сплавов (основные типы). Закономерности н.С. Курнакова.
- •Сплавы. Деформируемые и литейные сплавы. Особенности строения и свойства.
- •Диффузионные и Бездиффузионные превращения в металлических сплавах. Влияния на свойства.
- •Диаграммы состояния сплавов, характеризующие превращение в твердом состоянии.
- •Способы упрочнения сплавов.
- •Полиморфное превращение в сплавах. Влияния превращения на структуру и свойства.
- •Перекристаллизация стали. Влияние на структуру и свойства.
- •Дисперсионное твердение. Сплавы, упрочняемые дисперсионным твердением
- •Деформация упругая и пластическая. Упрочнения металлов при пластической деформации.
- •Рекристаллизация сплавов, влияние на структуру и свойства. Температура рекристаллизации по а.А. Бочвару.
- •Наклеп и рекристаллизация. Влияние на структуру и свойства.
- •Холодная и горячая пластические деформации. Влияние на структуру и свойства металлов и сплавов.
- •Диаграмма состояния «Железо – цементит». Превращения в сплавах на основе железа при нагреве и охлаждении.
- •Классификация сплавов по структуре. Свойства.
- •1. Железо:
- •2. Углерод:
- •Стали. Превращения в сталях при нагреве и охлаждении.
- •Равновесные структуры в сталях. Их свойства и условия получения.
- •Чугуны. Классификация. Марки по гост.
- •Белые чугуны. Состав. Свойства. Применение.
- •Графитизация. Причины. Влияние на структуру и свойства.
- •Влияние кремния, марганца и фосфора на свойства чугуна.
- •Чугуны с графитом. Классификация. Области применения.
- •Чугуны с графитом. Марки.
- •Чугуны марок: сч-20, кч-35-10, вч 60-2.
- •Серые чугуны: применение в промышленности.
- •Ковкий чугун. Способы получения. Структура и свойства.
- •Высокопрочный чугун. Способы получения. Структура и свойства.
- •Отбелённые чугуны. Способы получения. Структура и свойства.
- •1.Стали. Влияние вредных примесей. Классификация. Марки.
- •39.2. Стали. Влияние вредных примесей. Классификация. Марки.
- •Ликвация. Причины. Ликвация серы. Красноломкость.
- •Влияние серы на свойства. Красноломкость.
- •Автоматные стали.
- •Стали марок: Сталь 4, 40, 40х, 40нма.
- •Изотермические превращения аустенита. Влияние превращения на структуру и св-ва. Диаграмма.
- •Отжиг стали. Структура, свойства и назначение в промышленности.
- •Нормализация. Структура, св-ва и назначение в промышленности.
- •Закалка стали.
- •Закалка стали. Выбор температур закалки сталей. Структура и свойства закаленных сталей.:
- •Закаливаемость и прокаливаемость стали.
- •Остаточный аустенит. Влияние на свойства. Обработка стали холодом.
- •Деф. Стальных изделий при закалке и возможность ее уменьшения.
- •Внутренние напряжения в стали и деформация изделий при термической обработке. Причины возникновения, влияние на размеры и форму изделий. Способы уменьшения деформации.
- •Ступенчатая закалка .
- •Отпуск стали. Влияние температуры отпуска на превращения, структуру и свойства стали.
- •Улучшающая термическая обработка деталей машин. Структура, свойства и назначение в промышленности.
- •Отпускная хрупкость. Влияние на свойства стали и способы предупреждения.
- •Механические свойства стали. Зависимость от структуры и термической обработки.
- •Классификация легирующих компонентов.
- •2. Классификация с с: по характеру взаим. Делят на 3 группы:
- •Поверхностное упрочнение стальных изделий.
- •1. Химико-термическая обработка:
- •2. Нитроцементация:
- •Цементация стали. Стали для цементации. Процесс цементации, возможности автоматизации.
- •Цементуемые стали. Обработка, структура, свойства. Назначение в промышленности
- •Стали марок: 15, 15х, 12хн3а. Обработка, структура, свойства. Назначение в промышленности
- •Улучшение и улучшаемые стали. Влияние улучшения на структуру и свойства.
- •Азотирование стальных изделий. Область применения в промышленности
- •Закалка с нагревом твч
- •Способы получения поверхностного слоя высокой твердости в стали 15 и стали 45
- •Стали для пружин и их термическая обработка
- •Углеродистые и легированные инструментальные стали. Термическая обработка, структура, свойства и назначение в промышленности
- •Стали для подшипников качения. Состав, термическая обработка, структура и свойства.
- •Конструкционные хромистые хромоникелевые стали. Термическая обработка, свойства и назначение в промышленности
- •Хромо-никелевые стали устойчивые против коррозии
- •Конструкционные стали повышенной прокаливаемости, прочности коррозии
- •Стали устойчивы к коррозии.
- •Хромистые стали легирующие на уровне 2/8
- •Хромоникелевые стали устойчивые против коррозии.
- •Ползучесть. Стали, устойчивые против ползучести.
- •Быстрорежущие стали
- •Твердые сплавы. Способ получения, состав, назначение. Сплавы для обработки чугуна и стали.
- •Быстрорежущие стали и твердые сплавы. Сравнительная характеристика и область применения.
- •Твердые сплавы вк8 и т15к6
- •Дюралюминий.
- •Литейные алюминиевые сплавы. (силумины). Сравнить со свойствами серых чугунов.
- •Сплавы на основе меди. Латуни. Свойства, структура, применение.
- •Сплавы на основе меди латуни л -80 и лс-59-1.
- •Сплавы на медной основе. Бронзы. Строения. Свойства и применение.
- •1. Алюминиевые бронзы.
- •3. Бериллиевые бронзы.
- •Сплавы на медной основе. Оловянные бронзы. (Cu-Sn)
- •Сплавы на основе титана. Свойства и назначение в промышленности.
- •Сплавы на основе титана
- •Полимеры. Типы межатомных связей. Структура термопластичных и термореактивных полимеров. Реакции образования полимеров.
- •Механические свойства полимеров. Состояние аморфной фазы и её влияние на свойства. Ориентационное упрочнение.
- •Старение полимеров.
- •Пластмассы. Классификация и состав пластических масс.
- •Термопластичные пластмассы. Свойства, область применения (на примере полиэтилена и фторопласта).
- •Термореактивные пластмассы. Свойства, область применения (на примере текстолитов).
- •Газонаполненные пластмассы. Строение. Область применения.
Типы межатомных связей. Влияние на свойства материалов.
Существует 4 вида связей:
1) Ионная связь – присуща химическим соединениям, образованная элементами с резко различающейся валентностью. Так металлы, имея 1, 2 электрона на внешней орбите, которые не прочно связаны с ядром. Вступая в реакцию с неметаллами, металлы отдают электроны и превращаются в ионы. Неметаллы принимают эти электроны, превращаясь в отрицательные ионы => ионная связь обеспечивает электро – статическое притяжение.
Na +Cl2 => NaCl
-1 +7 + -
Ионная связь жесткая и направленная => Все химические соединения прочные, твердые, но очень хрупкие(низкая пластичность). Ионная связь характерна для окислов различных элементов.
2) Ковалентная связь – Устанавливается в результате образования устойчивых соединений путем обобществления электронов группой атомов. Обобществление электронов зависит от валентности элемента и определяется по следующей зависимости: A = 8 – N, где А – число атомов обобществляющих электрон, 8 – устойчивая электронная конфигурация, N – валентность элемента.
Ковалентная связь возникает между атомами соседей, которые обобществляют один из электронов соседа. Ковалентная связь характерна для кристаллических тел. Пример – алмаз- кристаллическая модификация углерода с ковалентной связью. Образование алмаза возникает при обобществлении по одному электрону четырех атомов. Ковалентная связь – жесткая, направленная => прочная. Она характерна для пластмасс.
3) Металлическая связь
Все металлы – кристаллические вещества. Атомы имеют упорядоченное расположение и образуют кристаллическую решетку. Атомы удерживаются в ней за счет металлической связи. Металлическая связь обусловлена строением атома, на внешнем орбите у металла 1-2 электрона, они слабо связаны с ядром. Для металла характерны кристаллические решетки с плотным расположением атомов => Внешние оболочки соприкасаются и пересекаются. Все валентные электроны обобществляются(общие в пределах твердого тела) и образуют электронный газ. Возникают пары атомов превращающихся в разнозаряженных атомов, которые связаны силами электростатического напряжения. Металлическая связь – гибкая, нежесткая. Свойства металлов: высокая прочность, пластичность, электропроводность, теплопроводность.
Металлическая связь характерна всем металлам и их сплавам => Металлы широко применяются в производстве. В металлах можно повысить прочность:
Изменением химического состава
Изменением строением металла в результате термической обработки
4) Связь Ван – дер – Вальса
Она основана на том, что все атомы являются диполями. Это связано с тем, что при сближении атомов происходит поляризация, что приводит к появлению сил притяжения. Диполи возникают при смещении центров отр. Заряженных электронов относительно центров положительно заряженных электронов. Сила ВДВ направленная.
Связь слабая и незаметна, она присутствует в полимерах.
Кристаллические и аморфные материалы. Кристаллическое строение. Основные типы кристаллических решеток.
Твердые вещества существуют в двух состояниях:
1) Аморфное – атомы располагаются хаотично;
2) Кристаллическое – атомы располагаются упорядоченно;
Решетка характеризуется строением элементарной ячейки- состоит из мин. кол-ва атомов, расположенных так, что повторное в пространстве расположение атомов этой ячейки возможно воспроизвести в кристаллическую решетку.
Существует 14 типов кристаллических решеток. Для металлов характерны те которые обеспечивают плотное расположение атомов.
Кристаллическая решетка - Упорядоченное расположение атомов в пространстве, в котором каждый атом имеет одинаковое число соседних атомов, удаленных друг от друга на периодически повторяющихся расстояниях.
Основные типы кристаллических решеток металлов:
П
 ростая
(кубическая решетка)- [ ].
ростая
(кубическая решетка)- [ ].
Параметры: Период решётки
(расстояние между атомами a
=d), d –
диаметр атома. 1/8·8 =1 атом на элемент,
ячейку. а![]() .
.
Условности:
Ребра;
Атомы соприкасаются;
Каждый атом принадлежит 8-ми решеткам;
Для химического соединения данный тип решётки.
2 характерна для тугоплавких мет. a =1,21·d. 1/8·8 +1 =2. Feα, Ti, W, Nb.
|
3 1/8·8 +1/2·6 =4. Характерна для пластичных мет. Cu, Feγ, Au.
|
4 Закаленная сталь Атомная плотность: 8*1/8+6=7 Параметр – C,A Степень тетрагон. –C/A: C не =0, С/A>0
|
5) Гексагональная решетка
Параметр – C,A С/A=1.633 Ячейка этой решетки - прямая призма, в основании которой находится правильный шестиугольник. Три атома находятся внутри ячейки по высоте на половине параметра "с " Zn |

 )
Кубич. объемно-центрир. решетка-
[•]
)
Кубич. объемно-центрир. решетка-
[•] )
Кубическая гранецентрированная
решетка- [X]
)
Кубическая гранецентрированная
решетка- [X]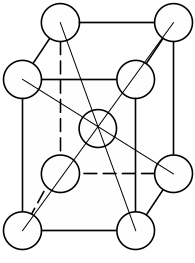 )
Тетрагональная решетка
)
Тетрагональная решетка