
- •Открытие Периодического закона
- •Периодическая система химических элементов
- •Строение атома
- •Квантово-механическое состояние электрона в атоме
- •Квантово-механическое описание электрона в атоме
- •2. Положение электрона в атоме неопределенно. Это означает, что невозможно одновременно точно определить и скорость электрона, и его координаты в пространстве.
- •4.2 Квантовые числа
- •4.3 Атомные орбитали
- •Формирование электронной оболочки атома. Электронные конфигурации
- •5.1 Формирование электронной оболочки атома.
- •5.2 Основные закономерности заполнения электронами уровней, подуровней и орбиталей в электронной оболочке атома
- •I Принцип минимума энергии: в устойчивом состоянии электроны находятся на наиболее низких энергетических уровнях и подуровнях.
- •III Принцип Паули: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
- •IV Правило Хунда: при формировании электронного подуровня электроны заполняют максимальное число свободных орбиталей так, чтобы число неспаренных электронов было наибольшим.
- •5.3 Электронные конфигурации атомов и Периодическая система.
- •5.3.1 Элементы первого периода (h, He)
- •5 .3.2 Элементы второго периода (Li – Ne)
- •5.3.3 Элементы III периода (Na – Ar)
- •Элементы IV периода (k – Kr)
- •5.3.5 Элементы V, VI и VII периодов
5.3 Электронные конфигурации атомов и Периодическая система.
Электронная конфигурация атома – это распределение всех электронов атомов по уровням, подуровням и орбиталям.
Существуют 2 способа описания электронной конфигурации:
1 – электронные формулы,
2– электроно-графические конфигурации.
Для атома характерно основное состояние (с минимумом энергии) или состояние покоя и возбужденное.
5.3.1 Элементы первого периода (h, He)
Порядковый номер элемента в периодической таблице равен заряду ядра атома Z, а следовательно, и общему числу электронов в атоме.
Наиболее устойчивое (невозбуждённое) состояние электрона в атоме соответствует минимально возможному значению энергии данного электрона. Любое другое состояние является возбуждённым; из него электрон самопроизвольно переходит в состояние с более низкой энергией.
В невозбуждённом атоме водорода (Z = 1) единственный электрон находится на самом низком из возможных энергетических уровней: n = 1. В этом случае орбитальное квантовое число может принимать только одно значение l = 0. Следовательно, первый энергетический уровень образован единственной s-орбиталью, на которой и находится электрон.
Э![]() лектронно-графическая
схема атома водорода:
лектронно-графическая
схема атома водорода:
Электронная формула атома водорода: 1s1.
В атоме гелия (Z = 2) второй электрон также находится на 1s орбитали. Электронная формула атома гелия: 1s2.
Электронно-графическая схема атома гелия:
5 .3.2 Элементы второго периода (Li – Ne)
У следующего за гелием элемента – лития (Z = 3) – третий электрон уже не может разместиться на первом энергетическом уровне, так как на одной орбитали не может находиться более двух электронов. Поэтому третий электрон должен располагаться на втором энергетическом уровне n = 2 .
При n = 2 орбитальное квантовое число может принимать два значения: l = 0; 1. Таким образом, второй энергетический уровень образован орбиталями двух типов: одной s-орбиталью и тремя p-орбиталями.
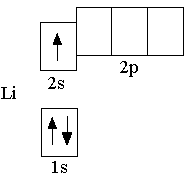
Заполнение орбиталей электронами происходит таким образом, что сначала заполняется более низкая по энергии орбиталь. Поэтому третий электрон в невозбужденном атоме лития располагается на 2s-орбитали, так как 2s-орбиталь имеет более низкую энергию, чем 2p-орбиталь. Полная электронная формула атома лития: 1s22s1. Ниже показана полная электронно-графическая схема невозбуждённого атома лития:
Для понимания химических свойств элемента достаточно рассмотреть электронные формулы и электронно-графические схемы, на которых показаны только валентные электроны (т.е. электроны, участвующие в образовании химических связей). Такие электронные формулы и электронно-графические схемы называют сокращёнными. Для элементов второго периода валентными являются электроны и орбитали внешнего энергетического уровня. Сокращённая электронная формула атома лития: 2s1.
Ниже показана сокращённая электронно-графическая схема атома лития.
2s1.
|
Иногда, чтобы подчеркнуть наличие в атоме не заполненных электронами орбиталей, сокращённую электронную формулу записывают так: Li 2s12p0.
Сокращённая электронно-графическая схема и сокращённая электронная формула следующего за литием атома бериллия (Z = 4) выглядят следующим образом:
Be
2s2
Элементы, в атомах которых электронами заполняются s-орбитали, называются s-элементами (т.е. H, He, Li, Be – это s-элементы). Следует отметить, что все s-элементы, за исключением водорода и гелия, являются металлами.
Следующие за бериллием элементы второго периода – бор, углерод, азот, кислород, фтор, неон – являются p-элементами: у них заполняются электронами p-орбитали. Ниже представлены сокращённые электронно-графические схемы и сокращённые электронные формулы этих элементов.
B 2s22p1
|
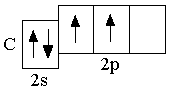
C 2s22p2
|
N 2s22p3
|
O 2s22p4
|
F 2s22p5
|
N
|
Устойчивому состоянию атома соответствует такое распределение электронов в пределах подуровня, при котором абсолютное значение суммарного спина максимально (правило Хунда). Поэтому при заполнении p-орбиталей атомов углерода и азота каждый электрон заполняет свободную орбиталь, а не спаривается с другим электроном.
Правило Хунда не запрещает другого распределения электронов в пределах подуровня. Оно лишь утверждает, что максимальное абсолютное значение суммарного спина соответствует невозбуждённому состоянию; любое другое распределение электронов в пределах подуровня соответствует возбуждённому состоянию.
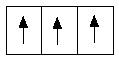
![]()
абсолютное значение абсолютное значение
суммарного спина: суммарного спина:
| +1/2 +1/2 +1/2 | = 3/2; | +1/2 – 1/2 + 1/2 | = 1/2;
максимальное значение; не является максимальным;
(возбуждённое состояние); (невозбуждённое состояние).



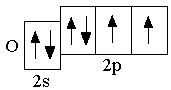

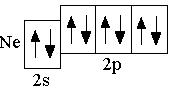 e
2s22p6
e
2s22p6