
- •О главление
- •Введение
- •Глава 1 химико-технологический процесс и его содержание
- •§ 1.1. Классификация химических реакций, лежащих в основе промышленных химико-технологических процессов
- •§ 1.2. Стехиометрия химических реакций
- •§ 1.3. Технологические критерии эффективности химико-технологического процесса
- •Вопросы и упражнения для повторения и самостоятельной работы
- •Глава 2 термодинамические расчеты химико-технологических процессов
- •§ 2.1. Равновесие химических реакций
- •§ 2.2. Способы смещения равновесия
- •§ 2.3. Зависимость константы равновесия от температуры
- •§ 2.4. Расчет равновесия по термодинамическим данным
- •Вопросы и упражнения для повторения и самостоятельной работы
- •Глава 3 использование законов химической кинетики при выборе технологического режима и моделировании химических процессов
- •§ 3.1. Скорость гомогенных химических реакций
- •§ 3.2. Зависимость скорости химических реакций от концентрации реагентов. Кинетические уравнения
- •§ 3.3. Способы изменения скорости простых и сложных реакций
- •Вопросы и упражнения для повторения и самостоятельной работы
- •Глава 4 общие сведения о химических реакторах
- •§ 4.1. Моделирование химических реакторов и протекающих в них химических процессов
- •§ 4.2. Структура математической модели химического реактора
- •§ 4.3. Уравнение материального баланса для элементарного объема проточного химического реактора
- •§ 4.4. Классификация химических реакторов и режимов их работы
- •Вопросы и упражнения для повторения и самостоятельной работы
- •Глава 5 химические реакторы с идеальной структурой потока в изотермическом режиме
- •§ 5.1. Реактор идеального смешения
- •§ 5.2. Реактор идеального вытеснения
- •§ 5.3. Сравнение эффективности проточных реакторов идеального смешения и идеального вытеснения
- •§ 5.4. Каскад реакторов идеального смешения
- •Вопросы и упражнения для повторения и самостоятельной работы
- •Глава 6 теплоперенос в химических реакторах
- •§ 6.1. Уравнение теплового баланса. Тепловые режимы химических реакторов
- •§ 6.2. Проточный реактор идеального смешения в неизотермическом режиме
- •§ 6.3. Тепловая устойчивость химических реакторов
- •§ 6.4. Оптимальный температурный режим и способы его осуществления в промышленных реакторах
- •Вопросы и упражнения для повторения и самостоятельной работы
- •Глава 7 гетерогенные процессы
- •§ 7.1. Общие особенности
- •§ 7.2. Диффузионные стадии
- •§ 7.3. Гетерогенные некаталитические процессы в системе «газ – твердое вещество»
- •§ 7.4. Гетерогенные процессы в системе «газ – жидкость»
- •Вопросы и упражнения для повторения и самостоятельной работы
- •Глава 8 гетерогенно-каталитические процессы
- •§ 8.1. Общие представления о катализе
- •§ 8.2. Технологические характеристики твердых катализаторов
- •§ 8.3. Основные стадии и кинетические особенности гетерогенно-каталитических процессов
- •Вопросы и упражнения для повторения и самостоятельной работы
- •Список литературы
- •Общая химическая технология Химические процессы и реакторы
§ 1.2. Стехиометрия химических реакций
Для описания химических реакций, лежащих в основе промышленных химико-технологических процессов, используют основные законы химии – законы стехиометрии, химического равновесия, химической кинетики. В гл. 2 и 3 рассмотрены основные принципы использования законов химической термодинамики и химической кинетики в технологии. В этом параграфе кратко изложены основы использования законов стехиометрии.
Стехиометрия – это учение о соотношениях масс или объемов реагирующих веществ. В основе стехиометрии лежат законы Авогадро, Гей-Люссака, а также сохранения массы, эквивалентов, постоянства состава, кратных соотношений.
Соотношения, в которых вещества вступают в реакцию, называют стехиометрическими. Законы стехиометрии в химии могут быть использованы в расчетах, связанных с формулами веществ, а также с нахождением теоретически возможных масс получающихся продуктов реакции.
Стехиометрическое уравнение реакции отвечает законам сохранения. Оно может быть записано как в привычном виде (слева – реагенты, справа – продукты)
аА + bВ = rR + sS, (I)
так и в соответствии с алгебраическими правилами в виде
–аА – bВ + rR + sS = 0 (II)
или еще в более общем виде
 . (1.1)
. (1.1)
В такой записи знак стехиометрического коэффициента ji позволяет определить, является ли данное вещество реагентом (тогда стехиометрический коэффициент отрицателен: ji < 0) или продуктом реакции (тогда ji > 0).
Если реакция сложная и состоит из п независимых последовательных или параллельных стадий, то стехиометрия реакции может быть выражена системой из п уравнений типа уравнения (1.1):
 ;
;
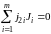 ; (1.2)
; (1.2)
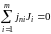 .
.
В соответствии с алгебраическими правилами каждое из этих уравнений может быть умножено на любую константу (кроме нуля) и смысл этих уравнений не изменится.
Если при стехиометрических расчетах количество вещества выражают в молях, то они сводятся к сравнительно простым стехиометрическим балансам. Например, если протекает реакция
2А + В 2R, (III)
то в соответствии с законами стехиометрии всегда на каждые 2 моль вступившего в реакцию вещества А одновременно вступит в реакцию 1 моль вещества В и образуется 2 моль продукта R.
Если исходные количества участников реакции (I) составляют nA,0, nB,0 и nR,0, а текущие количества пА, пB и nR, то для любого момента времени будут справедливы как стехиометрические соотношения
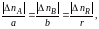
так и другие вытекающие из них соотношения, называемые стехиометрическими балансами, например
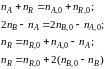
и др.
Следует иметь в виду, что для стехиометрических расчетов и составления стехиометрических балансов не имеет значения, является реакция обратимой или необратимой. Стехиометрический расчет ведется в предположении, что реакция может пройти до конца.
Стехиометрические балансы позволяют решить задачу о количестве независимых реакций в случае протекания сложных многостадийных реакций. При анализе механизма протекания таких реакций важно выделить независимые реакции, которые не могут быть получены простым алгебраическим суммированием двух или большего количества отдельных стадий.
