
- •1. Периодический закон и периодическая система химических элементов д.И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
- •2. Общие способы получения металлов. Практическое значение электролиза (на примере электролиза солей бескислородных кислот).
- •1. Строение атомов химических элементов и закономерности в изменении и свойств на примере: а) элементов одного периода; б) элементов главной подгруппы.
- •2. Предельные углеводороды, общая формула и химическое строение гомологов данного ряда. Свойства и применение метана.
- •1. Виды химической связи: ионная, ковалентная (полярная, неполярная): простые и кратные связи в органических соединениях.
- •2. Непредельные углеводороды, общая формула и химическое строение гомологов данного ряда. Свойства и применение этилена.
- •1. Классификация химических реакций в неорганической и органической химии.
- •Циклопарафины, их химическое строение, свойства, нахождение в природе, практическое значение.
- •1. Обратимость реакций. Химическое равновесие и способы его смешения: изменение концентрации реагирующих веществ, температуры, давления.
- •2. Диеновые углеводороды, их химическое строение, свойства, получение и практическое значение. Натуральный и синтетические каучуки.
- •Периодический закон и периодическая система химических элементов д.И.Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
- •2. Ароматические углеводороды. Бензол, структурная формула, свойства и получение. Применение бензола и его гомологи.
- •1. Основные положения теории химического строения органических веществ a.M.Бутлерова. Химическое строение как порядок соединения и взаимного влияния атомов в молекулах.
- •2. Ароматические углеводороды. Бензол, структурная формула, свойства и получение. Применение бензола и его гомологи.
- •Изомерия органических соединений и ее виды.
- •1. Металлы, их положение в периодической системе химических элементов д.И. Менделеева, строение их атомов, металлическая связь Общие химические свойств металлов.
- •2. Природные источники углеводородов: нефть, природный газ и их практическое использование.
- •Периодический закон и периодическая система химических элементов д.И.Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
- •Строение атомов химических элементов и закономерности в изменении и свойств на примере: а) элементов одного периода; б) элементов главной подгруппы.
- •Виды химической связи: ионная, ковалентная (полярная, неполярная): простые и кратные связи в органических соединениях.
- •Металлы, их положение в периодической системе химических элементов д.И. Менделеева, строение их атомов, металлическая связь. Общие химические свойства металлов.
2. Общие способы получения металлов. Практическое значение электролиза (на примере электролиза солей бескислородных кислот).
Металлы широко применяются в современной технике, авиа-, авто-, судостроении и других отраслях хозяйства. Однако далеко не все металлы встречаются в природе в свободном состоянии. Самым распространенным металлом в земной коре является алюминий. В свободном состоянии в природе встречаются наименее активные металлы: золото, платина, серебро, медь, ртуть, олово. Большинство остальных металлов, в том числе и перечисленные, встречаются и в виде различных соединений. Природные минералы и горные породы, содержащие металлы и пригодные для их промышленного получения, называются рудами. По составу большинство руд представляют собой оксиды (Fe2O3 – красный железняк; Al2O3 – корунд и др.) или соли (FeS2 пирит; CaSO4*2H2O – гипс, Na3AlF6 – криолит и др.).
Получение металлов из руд – основная задача металлоргии.
Основной принцип получения металлов из природных соединений – их востановление из руд: Men++ne- - Me0.
Востановление металлов происходит разными способами.
1) Для восстановления металлов из их оксидов используют:
а) углерод
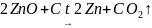
б) оксид углерода (II)

в) водород

г) металлы. Востановление металов из их соединений другими металлыми называют металлотермией. В качестве востановителей используют алюминий, магний, кальций, натрий.

2) Металлы можно получить из раствора солей, образующихся при обработке руд, содержащих оксиды металлов. Из раствора соли металла или с помошью электрического тока. Таким образом получают более 25% добываемой меди, а также золото, серебро, цинк и другие металлы.
Например, руды, содержащие оксид меди (II), обрабатывают раствором кислоты и получают растворимую соль – сульфат меди (II):

Затем из раствора выделяют свободную медь вытеснением железными опилками или электролизом:

3) Для получения главным оразом легких металлов (Na, Kи других щелочных металлов, Al, Mg и т.д.) широко используют электролиз.
Электролизом называют окислительно-востановительныую реакцию, протекающую при прохождении электрического тока через раствор или расплав электролита. При этом отрицательный электрод – катод выступает в качестве востановителя, он забирает электроны. Положительный электрод – анод, наоборот, представляет собой окислитель, он забирает электроны. Так, если в расплав хлорида натрия поместить электроды и пропустить электрический ток, то на катоде выделиться натрий, а на аиоде – хлор.




Суммарный процесс электролиза может быть выражен схемой:

Таким образом, при электролизе расплава хлориида натрия одновременно получают натрий и газообразный хлор.
Чтобы показатьпродукты электролиза, можно провести еще один пример электролиза расплава солей, хлорида калия или бромида натрия:

расплав
на
катоде:  ;
;
на
аноде:
 ,
,

суммарное уравнение электролиза:

Практическое
значение электролиза очень большое.
Так, электролизом раствора хлорида
натрия в промышленности получают хлор
и гидроксид натрия. Электролизом получают
алюминий и все щелочные металлы. С его
помощью очищают медь, никель и другие
металлы (рафинирование). В этом случае
используют анод, изготовленный из
соответствующего металла. В процессе
электролиза анод растворяется, а на
катоде оседает более чистый металл.
Билет № 2
