
- •1. Периодический закон и периодическая система химических элементов д.И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
- •2. Общие способы получения металлов. Практическое значение электролиза (на примере электролиза солей бескислородных кислот).
- •1. Строение атомов химических элементов и закономерности в изменении и свойств на примере: а) элементов одного периода; б) элементов главной подгруппы.
- •2. Предельные углеводороды, общая формула и химическое строение гомологов данного ряда. Свойства и применение метана.
- •1. Виды химической связи: ионная, ковалентная (полярная, неполярная): простые и кратные связи в органических соединениях.
- •2. Непредельные углеводороды, общая формула и химическое строение гомологов данного ряда. Свойства и применение этилена.
- •1. Классификация химических реакций в неорганической и органической химии.
- •Циклопарафины, их химическое строение, свойства, нахождение в природе, практическое значение.
- •1. Обратимость реакций. Химическое равновесие и способы его смешения: изменение концентрации реагирующих веществ, температуры, давления.
- •2. Диеновые углеводороды, их химическое строение, свойства, получение и практическое значение. Натуральный и синтетические каучуки.
- •Периодический закон и периодическая система химических элементов д.И.Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
- •2. Ароматические углеводороды. Бензол, структурная формула, свойства и получение. Применение бензола и его гомологи.
- •1. Основные положения теории химического строения органических веществ a.M.Бутлерова. Химическое строение как порядок соединения и взаимного влияния атомов в молекулах.
- •2. Ароматические углеводороды. Бензол, структурная формула, свойства и получение. Применение бензола и его гомологи.
- •Изомерия органических соединений и ее виды.
- •1. Металлы, их положение в периодической системе химических элементов д.И. Менделеева, строение их атомов, металлическая связь Общие химические свойств металлов.
- •2. Природные источники углеводородов: нефть, природный газ и их практическое использование.
- •Периодический закон и периодическая система химических элементов д.И.Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
- •Строение атомов химических элементов и закономерности в изменении и свойств на примере: а) элементов одного периода; б) элементов главной подгруппы.
- •Виды химической связи: ионная, ковалентная (полярная, неполярная): простые и кратные связи в органических соединениях.
- •Металлы, их положение в периодической системе химических элементов д.И. Менделеева, строение их атомов, металлическая связь. Общие химические свойства металлов.
1. Металлы, их положение в периодической системе химических элементов д.И. Менделеева, строение их атомов, металлическая связь Общие химические свойств металлов.
В Периодической системе элементов, которые в виде простых веществ проявляют свойства металлов, находятся в I, II, III (кроме бора) группах, в побочных подгруппах всех групп. Металлы по численности превосходят неметаллы.
Известно, что от периода к периоду число металлов, составляющих главные подгруппы, увеличивается. Это связано с тем, что от периода к периоду радиус атома, как правило, увеличивается, поэтому внешние электроны становятся более свободными. Это в значительной мере и определяет, будет элемент металлом или нет. Например, во втором периоде имеется только два металла - литий и бериллий; в состав третьего периода входит три металла - натрий, магний и алюминий. эту закономерность среди элементов главных подгрупп можно продолжить.
Особенностью строения атомов металлов является небольшое число электронов во внешнем электронном слое, как правило, не превышающие трех. Все элементы побочных подгрупп - металлы, они имеют на внешнем слое, как правило, 1-2 электрона, это во многом определяет их свойства.
Атомы металлов, имеющие обычно большие радиусы и малое число электронов во внешнем электроном слое, находятся в главных подгруппах I и II групп. Они наиболее активны, т.е. их атомы легко отдают электроны и являются хорошими восстановителями. В качестве примера можно привести схемы строения (электронные формулы) некоторых металлов.
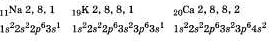
От строения атомов металлов легко перейти к характеристике металлической связи. Содержание понятия "металлическая связь".
Итак, строение атомов металлов определяет их свойства как восстановителей. Вспомните, что восстановители - это элементы (или вещества, в которые входят эти элементы), повышающие свою степень окисления в процессе реакции. Это происходит вследствие отдачи электронов окислителям.
В ходе рассказа о восстановительных свойствах металлов ученик может каждый раз при рассмотрении взаимодействия металлов с другими веществами объяснять реакцию с точки зрения окисления-восстановления; как сделать это в заключение рассмотренных химических свойств металлов.
Восстановительные свойства металла проявляются в реакциях: а) с неметаллами; б) с кислотами; в) с водой; г) с солями.
а) Многие металлы реагируют с галогенами, кислородом, серой и другими простыми веществами неметаллами. В качестве примера можно привести ряд уравнений химических реакций:
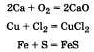
б) Металлы, стоящие в ряду напряжений до водорода, реагируют с растворами соляной и серной кислот с выделением водорода. В этих реакциях металлы выступают как восстановители, а ион водорода как окислитель:
![]()
в) Реакция с водой, приводящая к образованию щелочи, характерна для щелочных металлов, кальция, бария и других металлов, основания которых растворимы в воде:
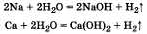
г) В реакцию замещения с солями металлы вступают в соответствии с рядом напряжений. Например, железо замещает медь в ее солях:
![]()
Обратите внимание, что в этих реакциях восстановителем является вступающий в реакцию металл (в приведенном примере это Fe), а окислителем - катион, который входит в состав соли (Cu2+).
В заключение важно подчеркнуть, что описанные реакции металлов, как с простыми, так и со сложными веществами относятся к окислительно-восстановительным. Их сущность можно выразить в общем виде:
![]()
