- •19.Донорно-акцепторная связь
- •20.Направленность ковалентных связей и форма молекул.
- •21Физические свойства кристаллов с ковалентной связью.
- •23 Особенности структуры и физические свойства металлических кристаллов.
- •24. Cилы ван-дер-Ваальса
- •Ориентационное взаимодействие
- •Индукционное взаимодействие
- •Дисперсионное взаимодействие
- •Межмолекулярное отталкивание
19.Донорно-акцепторная связь
Донорно-акцепторная связь (координационная связь, семиполярная связь) — химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободного уровня другого атома (акцептора). Донорно-акцепторная связь образуется часто при комплексообразовании за счет свободной пары электронов, принадлежавшей (до образования связи) только одному атому (донору). Донорно-акцепторная связь отличается от обычной ковалентной только происхождением связевых электронов. Реакция аммиака с кислотой состоит в присоединении протона, отдаваемого кислотой, к неподеленным электронам азота:

В ионе NH4+ все четыре связи азота с водородом равноценны, хотя отличаются происхождением. Донорами могут быть атомы азота, кислорода, фосфора, серы и др. Роль акцепторов могут выполнять протон, а также атомы с незаполненным октетом, напр. атомы элементов III группы таблицы Д. И. Менделеева, а также атомы-комплексообразователи, имеющие незаполненные энергетические ячейки в валентном электронном слое. Донорно-акцепторная связь называется иначе семиполярной (полуполярной), так как на атоме-доноре возникает эффективный положительный заряд, а на атоме-акцепторе — эффективный отрицательный заряд. Изображают эту связь стрелкой, направленной от донора к акцептору.
20.Направленность ковалентных связей и форма молекул.
Для объяснения и прогнозирования взаимного направления ковалентных связей
используют модель гибридизации.
Гибридизация атомных орбиталей и электронных облаков - предполагаемое
выравнивание атомных орбиталей по энергии, а электронных облаков по форме при
образовании атомом ковалентных связей.
Чаще всего встречается три типа гибридизации: sp-, sp2
и sp3-гибридизация. Например:
sp-гибридизация - в молекулах C2H2, BeH2, CO2 (линейное строение);
sp2-гибридизация - в молекулах C2H4, C6H6, BF3 (плоская треугольная форма);
sp3-гибридизация - в молекулах CCl4, SiH4, CH4 (тетраэдрическая форма); NH3 (пирамидальная форма);
Гибридизация орбиталей.
Гибридизация орбиталей - это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
1. sp3- Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые "гибридные" орбитали, угол между осями которых равен 109°28'.
|
|
|
Молекулы, в которых осуществляется sp3- гибридизация, имеют тетраэдрическую геометрию (CH4, NH3).
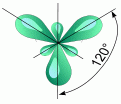
2. sp2- Гибридизация. Одна s- орбиталь и две p- орбитали превращаются в три одинаковые "гибридные" орбитали, угол между осями которых равен 120°.
|
|
|
Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется - связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется - связь. Три sp2- орбитали могут образовывать три - связи (BF3, AlCl3). Еще одна связь (- связь) может образоваться, если на p- орбитали, не участвующей в гибридизации, находится электрон (этилен C2H4).
Молекулы, в которых осуществляется sp2- гибридизация, имеют плоскую геометрию.
3. sp- Гибридизация. Одна s- орбиталь и одна p- орбиталь превращаются в две одинаковые "гибридные" орбитали, угол между осями которых равен 180°.
|
|
|
Две sp- орбитали могут образовывать две - связи (BeH2, ZnCl2). Еще две p- связи могут образоваться, если на двух p- орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2H2).
Молекулы, в которых осуществляется sp- гибридизация, имеют линейную геометрию.
Направленность - это важнейшее свойство связи, определяющее геометрию молекул, пространственную структуру. Причина направленности связи заключается в том, что перекрывание орбиталей, образующих химическую связь, происходит в направлении их наибольшей плотности. Так как форма АО и плотность разная, то связь имеет разное направление:
s-облако - сфера, образует легко связи по всем направлениям;
p-облако - ⌠гантели■, направлены по трем координатным осям, рх, ру, рz образуют связи вдоль трех координатных осей. Рассмотрим примеры построения молекул.
Наиболее простые
случаи образования связи в двухатомных
молекулах, когда оба атомы одновалентны
(линейные молекулы, угол валентный -
180°). В этих случаях электронная плотность
симметрично распределена или оттянута
к более электроотрицательному атому
(рис. 3.4).

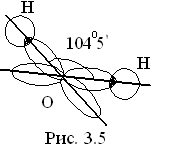
Рис. 3.4
Молекулы типа А2В, например Н2О. У атома кислорода валентными являются 2 неспаренных р-электрона. Два р-облака обычно располагаются в пространстве под углом 90°. Но в молекуле воды валентный угол 104°5' (рис. 3.5). Это объясняется полярностью связи О - Н, т. е. общее электронное облако оттянуто к более электроотрицательному атому О. На атомах водорода появляется положительный заряд и они начинают отталкиваться, увеличивая валентный угол. Объяснение этому явлению также можно дать пользуясь теорией гибридизации (см. дальше). Молекулы типа А2В имеют угловую форму. Так, элементы-аналоги кислорода образуют угловые молекулы, но так как связь Э - Н в этом ряду становится менее полярной, то и валентный угол приближается к 90° (см. рис. 3.6, а).
Молекула |
|
Валентный угол, град. |
Н2О |
|
104,5 |
Н2S |
|
92 |
Н2Se |
|
91 |
Н2Te |
|
90 |
Молекулы типа А3В, например NH3, PH3. Связь в этих молекулах осуществляется тремя неспаренными р-электронными облаками, расположенными под углом 120° по трем координатным осям.
 Рис.
3.6
Рис.
3.6
Форма молекулы - пирамида, построенная на треугольном основании. Но и как в случае с молекулой воды, вследствие полярности связи валентный угол отличается от 120° (рис. 3.6, б).
Сложнее происходит образование химической связи у элементов подгруппы бериллия, бора, углерода. Здесь участие в образовании связи принимают и s- и р-электроны. И хотя исходные электронные облака имеют различную форму и энергию, полученные в молекуле связи оказываются равноценными и по длине, и по энергии. Возникает вопрос, каким образом неравноценные по исходному состоянию электроны образуют равноценные химические связи? Ответ на этот вопрос дает теория гибридизации, разработанная Слейтером и Полингом.
(Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с их собственной. Исключение составляют s-электронные облака, поскольку их сферическая форма делает все направления равноценными. Для p- и d-электронных облаков перекрывание осуществляется вдоль оси, по которой они вытянуты, а образующаяся при этом связь называется s-связью. -Связь имеет осевую симметрию, и оба атома могут вращаться вдоль линии связи, т.е. той воображаемой линии, которая проходит через ядра химически связанных атомов.
После образования между двумя атомами -связи для остальных электронных облаков той же формы и с тем же главным квантовым числом * остается только возможность бокового перекрывания по обе стороны от линии связи. В результате образуется p-связь. Она менее прочна, чем -связь: перекрывание происходит диффузными боковыми частями орбиталей. Каждая кратная связь (например, двойная или тройная) всегда содержит только одну -связь. Число -связей, которые образует центральный атом в сложных молекулах или ионах, определяет для него значение координационного числа. Например, в молекуле NH3 и ионе NH4+ для атома азота оно равно трем и четырем. Образование -связей фиксирует пространственное положение атомов относительно друг друга, поэтому число -связей и углы между линиями связи, которые называются валентными углами, определяют пространственную геометрическую конфигурацию молекул.
При оценке степени перекрывания электронных облаков следует учитывать знаки волновых функций * электронов. При перекрывании облаков с одинаковыми знаками волновых функций электронная плотность в пространстве между ядрами возрастает. В этом случае происходит положительное перекрывание, приводящее к взаимному притяжению ядер. Если знаки волновых функций противоположны, то плотность электронного облака уменьшается (отрицательное перекрывание), что приводит к взаимному отталкиванию ядер.)