
- •Получение
- •Химические свойства
- •Токсичные свойства
- •Физические свойства
- •Метиламин
- •Олеиновая кислота(c17h33cooh)
- •Свойства
- •Нахождение в природе
- •Применение
- •Химические свойства.
- •Яблочная кислота
- •В природе
- •Роль в метаболизме
- •Применение
- •Отримання
- •[Ред.]Властивості
- •Використання
- •Пировиноградная кислота
- •Получение
- •Биологическая роль
- •Щавелевая кислота
- •Применение
- •Другие реакции
- •Применение и получение
- •Источники
- •Получение
- •Химические свойства
- •Соединения включения
- •Применение метана
- •Физиологическое действие
- •Хроническое действие метана
- •Метан и экология
- •Получение
- •В промышленности
- •Химические свойства
- •Применение
- •Лабораторное применение
- •Безопасность Пожароопасность
- •Токсичность
- •Экология
- •Ацетальдегид
- •Физические свойства
- •Получение
- •Реакционная способность
- •Реакция конденсации
- •Производные ацеталя
- •Применение
- •Биохимия
- •Безопасность
- •Врожденная непереносимость алкоголя
- •Ацетилен
- •Получение
- •Брожение
- •Промышленное производство спирта из биологического сырья
- •Гидролизное производство
- •Гидратация этилена
- •Очистка этанола
- •Абсолютный спирт
- •Химические свойства
- •Применение Топливо
- •Химическая промышленность
- •Медицина
- •Парфюмерия и косметика
- •Пищевая промышленность
- •Формальдегид
- •Применение
- •Пропилен
- •Физические свойства
- •Химические свойства
- •Горение на воздухе
- •Полимеризация
- •Окисление кислородом воздуха в пропиленоксид
- •Получение
- •В промышленности
- •Применение
- •Янтарная кислота(Бурштиновая кислота)
- •Биохимическая роль
- •Применение
Медицина
по своему действию этиловый спирт можно отнести к антисептикам;
как обеззараживающее и подсушивающее средство, наружно;
подсушивающие и дубящие свойства 96%-го этилового спирта используются для обработки операционного поля или в некоторых методиках обработки рук хирурга;
растворитель для лекарственных средств, для приготовления настоек, экстрактов из растительного сырья и др.;
консервант настоек и экстрактов (минимальная концентрация 18 %);
пеногаситель при подаче кислорода, искусственной вентиляции легких;
в согревающих компрессах;
для физического охлаждения при лихорадке (для растирания)[3];
компонент общей анестезии в ситуации дефицита медикаментозных средств;
как пеногаситель при отеке легких в виде ингаляции 33 % раствора;
этанол является противоядием при отравлении некоторыми токсичными спиртами, такими как метанол и этиленгликоль. Его действие обусловлено тем, что ферменталкогольдегидрогеназа, при наличии нескольких субстратов (например, метанол и этанол) осуществляет лишь конкурентное окисление, благодаря чему после своевременного (почти немедленного, вслед за метанолом/этиленгликолем) приёма этанола уменьшается текущая концентрация токсичных метаболитов (для метанола — формальдегида и муравьиной кислоты, для этиленгликоля — щавелевой кислоты)[4].
Парфюмерия и косметика
Является универсальным растворителем различных веществ и основным компонентом духов, одеколонов, аэрозолей и т. п. Входит в состав разнообразных средств, включая даже такие как зубные пасты, шампуни, средства для душа, и т. д.
Пищевая промышленность
Наряду с водой, является основным компонентом спиртных напитков (водка, виски, джин, пиво и др.). Также в небольших количествах содержится в ряде напитков, получаемых брожением, но не причисляемых к алкогольным (кефир, квас, кумыс, безалкогольное пиво и др.). Содержание этанола в свежем кефире ничтожно (0,12 %), но в долго стоявшем, особенно в тёплом месте, может достичь 1 %. В кумысе содержится 1—3 % этанола (в крепком до 4,5 %), в квасе — от 0,5 до 1,2% [5].
Растворитель для пищевых ароматизаторов. Может быть использован как консервант для хлебобулочных изделий, а также в кондитерской промышленности.[6]
Зарегистрирован в качестве пищевой добавки E1510[7].
Энергетическая ценность этанола — 7,1 ккал/г.
Формальдегид
Формальдегид (от лат. formīca «муравей») — бесцветный газ с резким запахом, хорошо растворимый в воде, спиртах и полярных растворителях. Ирритант, токсичен.
Формальдегид — первый член гомологического ряда алифатических альдегидов, альдегид муравьиной кислоты.
Химические свойства
Из-за низкой электронной плотности на атоме углерода формальдегид легко вступает в реакции даже со слабыми нуклеофилами. Этим, в частности, объясняется тот факт, что в водных растворах формальдегид находится в гидратированной форме.
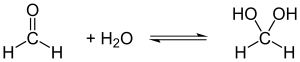
.
Формальдегид вступает во все реакции, характерные для алифатических альдегидов. В частности, в реакции с нуклеофилами и восстановительными реагентами.
Получение
Основной промышленный метод получения формальдегида — окисление метанола:
2CH3OH + O2 → 2HCHO + 2H2O
Окисление метанола в формальдегид проводится с использованием серебряного катализатора при температуре 650 °C и атмосферном давлении. Это хорошо освоенный технологический процесс, и 80 % формальдегида получается именно по этому методу. Недавно разработан более перспективный способ, основанный на использовании железо-молибденовых катализаторов. При этом реакция проводится при 300 °C. В обоих процессах степень превращения составляет 99 %[1].
Процесс дегидрирования метанола, осуществлённый на цинк-медных катализаторах при 600 °C, пока не получил широкого развития, однако он является очень перспективным, поскольку позволяет получать формальдегид, не содержащий воды.
Существует также промышленный способ получения формальдегида окислением метана:
CH4 + O2 → HCHO + H2O
Процесс проводят при температуре 450 °C и давлении 1—2 МПа, в качестве катализатора применяется фосфат алюминия AlPO4.
Безопасность и токсические свойства
Категория взрывоопасности IIB по ГОСТ Р 51330.11-99 , группа взрывоопасности Т2 по ГОСТ Р 51330.5-99 . Концентрационные пределы воспламенения 7-73 % об.; температура самовоспламенения — 435 °C.
Формальдегид образуется в организме путём окисления метанола.
Обладает токсичностью, негативно воздействует на генетический материал, репродуктивные органы, дыхательные пути, глаза, кожный покров. Оказывает сильное действие на центральную нервную систему.
Предельно допустимые концентрации (ПДК) формальдегида:[2] [3] [4]
ПДКр.з. = 0,5 мг/м³
ПДКм.р. = 0,035 мг/м³
ПДКс.с. = 0,003 мг/м³
ПДКв. = 0,05 мг/л
Смертельная доза 35 % водного раствора формальдегида (формалина) составляет 10—50 г.
