
- •Получение
- •Химические свойства
- •Токсичные свойства
- •Физические свойства
- •Метиламин
- •Олеиновая кислота(c17h33cooh)
- •Свойства
- •Нахождение в природе
- •Применение
- •Химические свойства.
- •Яблочная кислота
- •В природе
- •Роль в метаболизме
- •Применение
- •Отримання
- •[Ред.]Властивості
- •Використання
- •Пировиноградная кислота
- •Получение
- •Биологическая роль
- •Щавелевая кислота
- •Применение
- •Другие реакции
- •Применение и получение
- •Источники
- •Получение
- •Химические свойства
- •Соединения включения
- •Применение метана
- •Физиологическое действие
- •Хроническое действие метана
- •Метан и экология
- •Получение
- •В промышленности
- •Химические свойства
- •Применение
- •Лабораторное применение
- •Безопасность Пожароопасность
- •Токсичность
- •Экология
- •Ацетальдегид
- •Физические свойства
- •Получение
- •Реакционная способность
- •Реакция конденсации
- •Производные ацеталя
- •Применение
- •Биохимия
- •Безопасность
- •Врожденная непереносимость алкоголя
- •Ацетилен
- •Получение
- •Брожение
- •Промышленное производство спирта из биологического сырья
- •Гидролизное производство
- •Гидратация этилена
- •Очистка этанола
- •Абсолютный спирт
- •Химические свойства
- •Применение Топливо
- •Химическая промышленность
- •Медицина
- •Парфюмерия и косметика
- •Пищевая промышленность
- •Формальдегид
- •Применение
- •Пропилен
- •Физические свойства
- •Химические свойства
- •Горение на воздухе
- •Полимеризация
- •Окисление кислородом воздуха в пропиленоксид
- •Получение
- •В промышленности
- •Применение
- •Янтарная кислота(Бурштиновая кислота)
- •Биохимическая роль
- •Применение
В промышленности
Обычно пропилен выделяют из газов нефтепереработки (при крекинге сырой нефти в кипящем слое (процесс фирмы BASF), пиролизе бензиновых фракций) или попутных газов, а также из газов коксования угля. Существует несколько видов пиролиза пропилена: пиролиз в трубчатых печах, пиролиз в реакторе с кварцевым теплоносителем (процесс фирмы Phillips Petroleum Co.), пиролиз в реакторе с коксовым теплоносителем (процесс фирмы Farbewerke Hoechst), пиролиз в реакторе с песком в качестве теплоносителя (процесс фирмы Lurgi), пиролиз в трубчатой печи (процесс фирмы Kellogg), процесс Лавровского — Бродского, автотермический пиролиз по Бартоломе. В промышленности пропилен получают также дегидрированием алканов в присутствии катализатора (Сr2О3, Аl2О3).
Промышленным способом получения пропилена наряду с крекингом служит дегидратация пропанола над оксидом алюминия:
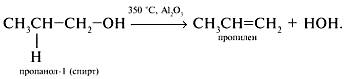
Применение
Для производства оксида пропилена, получения изопропилового спирта и ацетона, для синтеза альдегидов, для получения акриловой кислоты и акрилонитрила, полипропилена, пластмасс, каучуков, моющих средств, компонентов моторных топлив, растворителей.
Янтарная кислота(Бурштиновая кислота)
Химическая формула |
НООС-СН2-СН2-СООН |
Янтарная кислота (бутандиовая кислота, этан-1,2-дикарбоновая кислота) — двухосновная предельная карбоновая кислота. Бесцветные кристаллы, растворимые в воде и спирте. Содержится в небольших количествах во многих растениях, янтаре. Стимулирует рост и повышает урожай растений, ускоряет развитие кукурузы. В промышленности янтарную кислоту получают главным образом гидрированием малеинового ангидрида.
Впервые получена в XVII веке перегонкой янтаря. Соли и эфиры янтарной кислоты называются сукцинатами (лат. succinum — янтарь).
Биохимическая роль
Янтарная кислота участвует в процессе клеточного дыхания кислорододышащих организмов (см. Цикл трикарбоновых кислот).
Летальные дозы (LD50): орально — 2,26 г/кг (крысы), внутривенно — 1,4 г/кг (мыши)[2].
Применение
Янтарную кислоту используют для получения пластмасс, смол, лекарственных препаратов (в частности, хинолитина), для синтетических целей, а также в аналитической химии.
В пищевой промышленности используется в качестве пищевой добавки E363.
В медицине янтарная кислота применяется, в частности, как одно из средств для борьбы с похмельным синдромом[источник?].
Химические свойства.
Янтарная кислота содержится
в небольшом кол-ве в буром
угле,
прир. смолах, в янтаре (отсюда
название). Найдена во мн.
растениях.
Конденсация янтарной кислоты или
ее эфиров с кетонами и альдегидами в
присут. оснований приводит
к алкилиденянтарным к-там (см. Штоббе
конденсация);
при взаимод. с аммиаком и аминами образуются сукцинимид и
его N-замещенные производные; с ароматич.
соед. в условиях р-ции Фриделя-Крафтса
-4-арил-4-кетомасляная к-та (р-ция
сукциноилирования).
При окислении янтарной кислоты Н2О2 в
зависимости от условий образуются
пероксиянтарная (СН2СОООН)2,
оксоянтарная или малоновая к-ты либо
смесь ацетальдегида,
малоновой и малеиновой к-т,
при окислении КМnО4 -
щавелевая к-та или смесь малоновой и
винной к-т, при окислении NaClO4 -
3-гидроксипропионовая к-та,
Каталитич. восстановление янтарной кислоты в
зависимости от катализатора и
условий р-ции приводит к
1,4-бутандиолу,![]() бутиролактону, ТГФ или
к смеси этих соед., гидрирование в
1,4-бутандиоле - к
бутиролактону, ТГФ или
к смеси этих соед., гидрирование в
1,4-бутандиоле - к![]() гидроксимасляной
к-те.
При 235 °С янтарная кислота отщепляет воду,
давая янтарный
ангидрид,
при фотохим. распаде mpem-бутилпероксиэфиров
- этилен.
Я нтарная кислота вступает
в р-ции замещения по активным метиленовым
группам. Нагревание с бромом в
закрытом сосуде при
100 °С дает с количеств. выходом
2,3-дибромянтарную к-ту.
Янтарную кислоту получают
в качестве побочного продукта при
произ-ве адипиновой к-ты, а также выделяют
из смеси к-т, образующихся
при окисленииуглеводородов С4 -
С10.
Янтарная кислота может
быть получена окислением фурфурола пероксидом
водорода, гидрированием малеинового
ангидрида с
последующей гидратацией.
Известен пром. способ выделения
янтарной кислоты из
отходов янтаря.
Соли янтарной кислоты образуются
при окислении 1,4-бутандиола
р-ром Na2O2 или
гидроксимасляной
к-те.
При 235 °С янтарная кислота отщепляет воду,
давая янтарный
ангидрид,
при фотохим. распаде mpem-бутилпероксиэфиров
- этилен.
Я нтарная кислота вступает
в р-ции замещения по активным метиленовым
группам. Нагревание с бромом в
закрытом сосуде при
100 °С дает с количеств. выходом
2,3-дибромянтарную к-ту.
Янтарную кислоту получают
в качестве побочного продукта при
произ-ве адипиновой к-ты, а также выделяют
из смеси к-т, образующихся
при окисленииуглеводородов С4 -
С10.
Янтарная кислота может
быть получена окислением фурфурола пероксидом
водорода, гидрированием малеинового
ангидрида с
последующей гидратацией.
Известен пром. способ выделения
янтарной кислоты из
отходов янтаря.
Соли янтарной кислоты образуются
при окислении 1,4-бутандиола
р-ром Na2O2 или![]() гидроксимасляной
к-ты гидроксидами щел.-зем. металлов в
присут. Pd.
Применяют янтарную кислоту для
получения алкидных
смол, сукцинатов, фотоматериалов, красителей,
лек. в-в. Эфиры янтарной кислоты используют
в пищ. и парфюм. пром-сти. Так, диэтилсукцинат
-ароматизатор для пищ. продуктов,
компонент парфюм. композиций (запах
цветов); обладает также св-вамипластификатора.
Моно- и диамиды янтарной кислоты с
ароматич. и гетероциклич. аминами применяют
в произ-ве нек-рых красителей и инсектицидов.
Для
янтарной кислоты ПДК
в воде водоемов
0,01 мг/л.
гидроксимасляной
к-ты гидроксидами щел.-зем. металлов в
присут. Pd.
Применяют янтарную кислоту для
получения алкидных
смол, сукцинатов, фотоматериалов, красителей,
лек. в-в. Эфиры янтарной кислоты используют
в пищ. и парфюм. пром-сти. Так, диэтилсукцинат
-ароматизатор для пищ. продуктов,
компонент парфюм. композиций (запах
цветов); обладает также св-вамипластификатора.
Моно- и диамиды янтарной кислоты с
ароматич. и гетероциклич. аминами применяют
в произ-ве нек-рых красителей и инсектицидов.
Для
янтарной кислоты ПДК
в воде водоемов
0,01 мг/л.
Лит.: Kirk-Othmer encyclopedia, 3 ed., v. 21, N. Y., 1983, p. 848-6
