
Энтропия
По мере превращения энергии системы теряют разность энергетических уровней и утрачивают способность совершать работу.
Энтропия (от греч. превращение) - мера утраты способности системы совершать работу, мера рассеяния энергии: S = Q/T, Q = S*T.
Больцман исследовал эти процессы, дал понятие энтропии.
S = K*ln W, K-постоянная Больцмана, равна 1,38 * 10-23 Дж/К.
Количество способов комбинации элементов системы, с помощью которых может быть реализовано данное состояние – термодинамическая вероятность W, следует отличать ее от математической вероятности - среднее значение частоты появлений событий при испытании P.
Термодинамическая вероятность показывает возможность расположения частиц в системе, которое может реализовать данное состояние. Например, в системе 6 молекул: 6 слева и ни одной справа, далее справа может быть 1 молекула, может быть справа 2 молекулы, а остальные слева, что показывает, в каком состоянии находится термодинамическая система. Число размещений молекул 26 = 64– термодинамическая вероятность. Положение молекул 6 слева, 0 справа - единственное состояние системы, 5 слева и 1 справа – шесть возможностей, 4 слева и 2 справа -15 размещений, 3 слева и 3 справа -20 размещений, далее изменяется все в такой же последовательности.
Математическая вероятность этих состояний 1/64 = 0,016. Такое состояние с математической точки зрения маловероятно, самой большой вероятностью будет обладать распределение 3 и 3.
Если в какой-то части термодинамической системы сконцентрировано много свободной энергии, такая система – неравновесная, энтропия такой системы буде мала, энергия будет перемещаться из области большей концентрации в область меньшей, то есть движение энергии будет упорядочено. Вероятность существования такой системы очень мала, ибо система стремится к беспорядку, стремится стать равновесной. То есть система стремится к тому, чтобы в двух ее частях энергия распределилась равномерно. Вероятность существования такой системы будет значительно больше, а энтропия равновесной системы будет велика, ибо перемещение частиц в такой системе подчиняется лишь тепловому Броуновскому движению. При этом нет определенного направления движения частиц, исходя из этого, система будет беспорядочной.
Второй закон показывает ограниченность превращения энергии в работу, ибо не вся внутренняя энергия может быть превращена в работу, КПД<1, A/Q=1-T1/T2, T1>T2.
Если возьмем температуру тела внутри человека 310 К, а снаружи 303 К, возможность совершения работы за счет тепловой энергий 2 %, но мы используем для совершения работы химическую энергию, что позволяется увеличить КПД = A/∆F ≤ 1.
Соотношение биологического процесса и КПД в %: гликолиз 36, окислительное фосфорилирование 55, фотосинтез 75, сокращение мышц 40, свечение бактерий до 96.
Живые организмы, совершая работу, не приходят в состояние термодинамического равновесия. Закрытые системы подчиняются закону увеличения энтропии, а живые организмы – открытые термодинамические системы, стремятся к минимуму энтропии. Совершая непрерывную работу, они постоянно расходуют энергию, но при этом живой организм удерживает разницу энергетических уровней. Наша деятельность направлена на поддержание градиента, что возможно благодаря поступлению в нашу систему веществ из окружающей среды, которые имеют большой запас свободной энергии. Поэтому понятие энтропии для живых организмов было заменено понятием потока энтропии.
Поступление питательных веществ в организм рассматривается как поток отрицательной энтропии, ибо в ходе обмена веществ происходит уменьшение свободной энергии и запасании энергии в живом организме (продукты, которые мы получаем, являются строго упорядоченными, а то, что выделяем – продукты беспорядочные). Энергия, которая уходит в ходе совершения работы, представляет собой поток положительной энтропии. Поток отрицательной энтропии возникает в процессе ассимиляции, а положительной - в процесс диссимиляции, что позволяет нам поддерживать стационарное равновесие.
Термодинамическое равновесие |
Стационарное равновесие |
Пример: закрытый сосуд, часть объема которого занимает жидкость, а часть пар
Отсутствие потока веществ в систему и из среды
Не нужна трата свободной энергии для поддержания равновесия
Свободная энергия и работоспособность системы = 0
Энтропия в системе равна максимальному значению
Отсутствие градиента в системе |
Пример: горящая свеча, горящая керосинка, живой организм
Постоянный приток веществ в систему и удаление продуктов реакции
Нужна постоянная трата свободной энергии для поддержания равновесия
Свободная энергия и работоспособность системы постоянны и неравны 0
Энтропия постоянна и неравна максимальному значению
Наличие постоянного градиента в системе |
Наш организм стремится к созданию постоянной величины энтропии, но эмоциональная нагрузка и заболевания приводят к нарушению потоков энтропии, что выводит нас из состояния равновесия. Организм работает на то, чтобы при выходе из стационарного состояния вернутся к нормальному состоянию, при этом переходы могут быть различными.
Экспоненциальное приближение отображает кривая А – оптимальное состояние, здесь происходит медленное возвращение к стационарному состоянию, но реакции в организме могут быть разнообразными. Кривая Б показывает возможность с избыточным отклонением, а кривая В переход к сложному старту, когда энергетические ресурсы уменьшены.
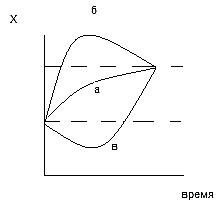
Второй закон затрагивает и состояние информации в живых объектах, ибо согласно второму закону в системе есть стремление переходить к беспорядку – универсальный закон. В организме происходят сложные реакции синтеза и восстановление структур, которые погибают. Информация на восстановление заложена в азотистых основаниях, что позволяет заменить структуры, заменить отмершие клетки и продолжить жизнь. Если способность утратится, то организм погибнет, ибо неумолимо будет действовать второй закон термодинамики, а именно будет осуществляться переход к беспорядку.
Законы термодинамики имеют приложение к биологическим объектам.
