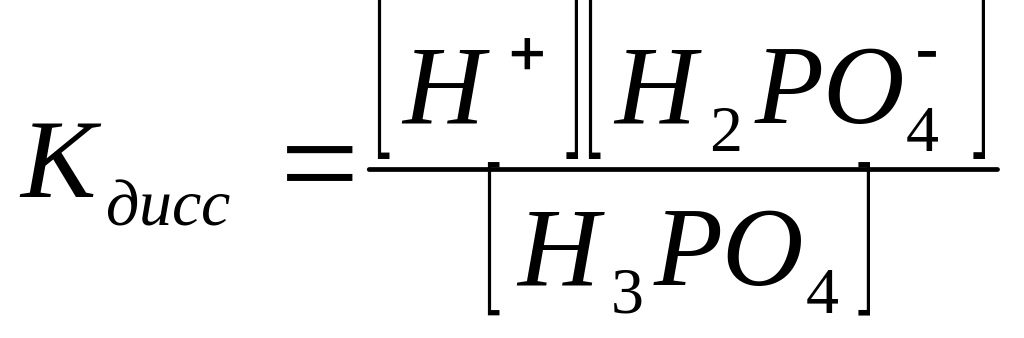khimia
.docОсновные понятия и законы химии. Классы химических соединений
Дать определение одного моль (1 моль = 6,02*10^23).
Это количество вещества, которое содержит столько структурных единиц (атомов, молекул, ионов, …), сколько содержится атомов в 12 граммах изотопа С12.
Сформулировать закон постоянства состава.
Все вещества имеют постоянный количественный и качественный состав, независимо от места их нахождения и способа получения. Для веществ немолекулярной структуры это не всегда так.
Следствия из закона Авогадро.
1-ое: 1 моль любого газа при постоянных условиях всегда имеет один и тот же объём;
2-ое: при нормальных условиях (Т=273,15 К, Р=101,3 кПа) 1 моль любого газа всегда занимает объём V=22,4 л/моль.
Моль является мерой.
количества вещества.
Какие из указанных оснований являются амфотерными.
Сr(OH)3;
Какие из перечисленных соединений относятся к пероксидам.
K2O2;
Какова молекулярная формула соединения азота с кислородом, если плотность газа по водороду равна 15.
NO;
Соединения какого класса относятся к бинарным.
оксиды;
Простое вещество (в отличие от сложного).
это вещество которое состоит из атомов одного и того же элемента.
Периодический закон и строение атома
Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня, орбитальное квантовое число которого L=2 .
5;
Какие из указанных кислот могут образовать кислотные соли.
H2SO4;
Формула высшего оксида элемента с электронной конфигурацией атома 1S22S22P63S23P63d54S1
RО3 (CrO3);
В периоде слева направо возрастает.
Электроотрицательность атома, кислотные свойства высших оксидов элементов, высшая степень окисления элемента;
Масса 0,2 моль гидроксида калия равна.
11,2 г;
Как изменяется значения первых потенциалов ионизации в ряду элементов Li, Be, B, C, N, O, F, Ne .
изменяются не регулярно, но имеют тенденцию к возрастанию;
Дать современную формулировку периодического закона.
свойства химических элементов и их соединений находятся в периодической зависимости от заряда ядер атомов элементов.
Выберите правильное утверждение.
элементы побочных групп меньше отличаются друг от друга по свойствам, чем элементы главных подгрупп;
В главной подгруппе каждой группы сверху вниз уменьшается.
энергия сродства;
Основные классы неорганических соединений.
Простые: состоят из атомов одного элемента (H2, O2, Ag, Au,Fe), инертные газы - одноатомные.
Сложные: бинарные (состоят из атомов 2-х элементов AlCl3, H2O).
4 класса: оксиды, кислоты, основания, соли;
Для одного и того же элемента
катионный радиус < атомного радиус < анионного радиус;
Электронная орбиталь.
это часть околоядерного пространства, в которой вероятность нахождения электрона достаточно велик;.
Дать формулировку закона постоянства состава.
все вещества имеют постоянный качественный и количественный состав независимо от способа их нахождения и способа получения;
Какие из указанных гидроксидов могут образовать основные соли.
Ca(OH)2;
В главной подгруппе каждой группы сверху вниз увеличивается.
радиус атомов;
0,5 моль серной кислоты соответствует масса.
49 г.;
Какова максимальная валентность атома азота.
5;
Атому элемента ванадий соответствует электронная конфигурация.
1S22S22P63S23P63d34S2;
Химическая связь
В соединении KBr связь:
ионная;
Какой из перечисленных ионов обладает большим поляризующим действием:
Al3+;
В каком из перечисленных соединений существует ковалентная полярная связь:
НJ;
Поляризация (степень ковалентности) ионной связи тем больше чем…
больше заряд катиона и меньше его размер;
При более высокой температуре распадается на атомы молекула
H2O;
С точки зрения метода молекулярных орбиталей могут ли существовать молекулы Li2 и Be2?
Li2 – может, Be2 – нет;
В молекуле NaCl связь
ионная;
В молекуле HBr связь
ковалентная полярная;
На каком из перечисленных соединений существует ковалентная неполярная связь
H2;
В каких молекулах имеется π-связь
CO2;
Ионную кристаллическую решётку имеет
СаСl2;
Как по методу молекулярных орбиталей определяется кратность связи в молекуле
по разнице заполненных связывающих и разрыхляющих орбиталей;
Какая связь может быть межмолекулярной
водородная;
Элементы химической термодинамики
Состояние истинного равновесия в системе характеризуется
минимальным значением G;
В каких из следующих случаев реакция осуществима при любых температурах
ΔН<0 и ΔS>0;
Как соотносятся тепловые эффекты прямой и обратной реакции
|Qпр|=|Qобр|;
При ΔН<0, ΔS<0 процесс будет самопроизвольно протекать
при низкой температуре;
Возможность самопроизвольного протекания реакции при высокой температуре определяет
энтропийный фактор;
Реакция является ЭКЗОтермической, если…
ΔH < 0 или Q>0;
В каком из следующих случаев реакция неосуществима при любых температурах
ΔH > 0 и ΔS < 0;
Сформулировать 1,2-е следствие из закона Гесса
1-ое: Тепловой эффект прямой и обратной реакции равен по величине, но противоположны по знаку.
2-ое: Тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ, при этом учитываются стихиометрические коэффициенты.
При ΔH>0, ΔS<0 процесс будет самопроизвольно проходить при
не будет протекать при любой t;
Реакция является ЭНДОтермической, если…
Q<0 или ΔH>0;
Состояние истинного равновесия в системе характеризуется…
ΔG=0 или ΔН-ТΔS=0;
Химическая кинетика
С ростом температуры…
растёт скорость только эндотермической реакций;
Величина энергии активации …
определяется природой реагирующих веществ и зависят от присутствия катализатора;
Ингибитор
замедляет прямую и обратную реакции в одинаковой степени;
Положительный катализатор
одинаково ускоряет прямую и обратную реакции;
При повышении внешнего давления в 4 раза, скорость прямой реакции CO(г)+Cl2(г)=CCl2O(г)
увеличится в 16 раз;
Равновесие реакции (реакция с P и CL, саму реакцию не видно) сместится вправо при
повышении давления;
Константа скорости химической реакции не зависит от…
концентрации реагирующих веществ;
Растворы
Понижение температуры замерзания идеального раствора по сравнению с чистым растворителем определяется
моляльной концентрацией растворённого неэлектролита и природой растворителя;
Для 2-х веществ (не электролитов) X и Y соотношение молярных масс М(Х)/М(Y)=1,8; 5 грамм каждого растворили в 200 г воды. При постепенном понижении температуры: наблюдали следующий порядок замерзания (сравнивали с чистой водой)
1-й замёрзла вода, 2-м раствор Х, 3-м раствор Y;
Степень электролитической диссоциации. Сильные и слабые электролиты (примеры)
Электролитическая диссоциация - процесс распада электролита на ионы при его растворении в воде или расплавлении.
Сильные электролиты – электролиты, степень диссоциации которые в растворах равна единице (т. е. диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты.
Слабые электролиты – степень диссоциации меньше единицы (т. е диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот, основания p -, d - и f-элементов.
Повышение температуры кипения идеального раствора по сравнению с чистым растворителем зависит от…
концентрации растворённого неэлектролита и природы растворителя;
Формулировка и аналитическое выражение закона Вант-Гоффа для осмотического давления
осмотическое давление раствора равно тому газовому давлению, которое оказывало бы растворенное веществo, если бы находясь при той же температуре в газообразном состоянии оно занимало объём равный объёму раствора;
Привести аналитическое выражение закона разбавления Освальда
Напишите выражение или дайте формулировку 1-го, 2-го закона Рауля:
давление пара растворителя над раствором прямопропорционально мольной доле растворителя;
повышение температуры кипения и понижение температуры затвердевания раствора пропорциональны концентрации растворённого вещества и не зависят от его природы;
Как соотносятся температуры кипения 10%-ых (по массе) растворов CH3OH(t1) и C2H5OH(t2).
t1>t2;
Чему равен рН-фактор щелочного раствора?
9;
Значения каких концентрации совпадает для растворов соляной кислоты
молярность и нормальность;
Какой раствор можно считать идеальным?
концентрированный раствор сахара;
Чему равна нормальность (эквивалентная концентрация) 0,1% молярного раствора серной кислоты
0,2
Как соотносятся температура кристаллизации 0,1%-ных (по массе) растворов глюкозы (Т1; М-180) и альбумина (Т2; М-68000):
Т1<Т2;
Выразить константу диссоциации по первой ступени для ортофосфорной кислоты:
Напишите выражение (или дайте определение) для массовой доли, молярной концентрации, моляльной концентрации и мольной доли растворенного вещества.
Массовая доля
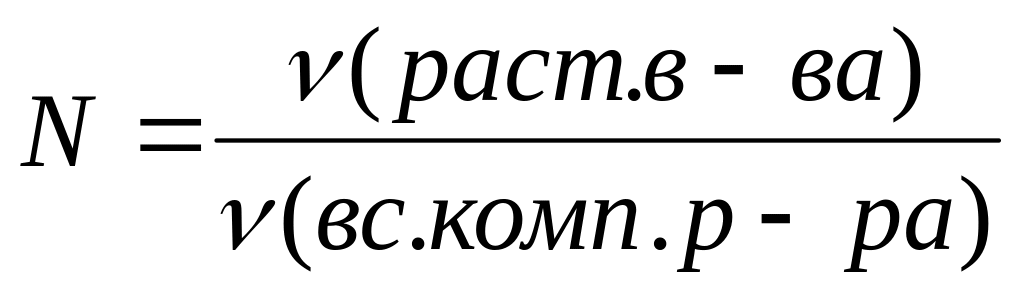
Молярная концентрация

Моляльная концентрация

Эквивалентная или нормальная концентрация
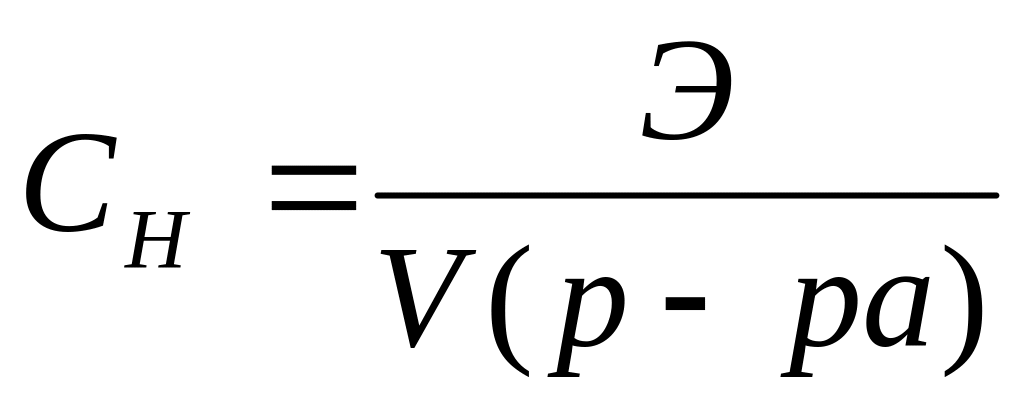 ,
,