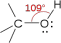- •Билет №1
- •1. Периодический закон и периодическая система химических элементов д.И.Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
- •2. Предельные углеводороды, общая формула и химическое строение гомологов данного ряда. Свойства и применение метана.
- •Гомологический ряд алканов:
- •Билет №2
- •2. Непредельные углеводороды, общая формула и химическое строение гомологов данного ряда. Свойства и применение этилена.
- •Гомологический ряд алкенов:
- •Билет№ 3
- •Циклопарафины, их химическое строение, свойства, нахождение в природе, практическое значение.
- •Гомологический ряд алканов:
- •Гидрирование.
- •Галогенирование.
- •Дегидрирование.
- •Задача.
- •Билет №4
- •Классификация химических реакций в неорганической и органической химии.
- •Диеновые углеводороды, их химическое строение, свойства, получение и практическое значение. Натуральный и синтетический каучуки.
- •Полимеризация.
- •Каучук и его свойства. Вулканизация каучука
- •Билет №5
- •Обратимость реакций. Химическое равновесие и способы его смещения: изменение концентрации реагирующих веществ, температуры, давления.
- •Получение.
- •Применение.
- •Билет №6
- •Условия, влияющие на скорость реакций.
- •Ароматические углеводороды. Бензол, структурная формула, свойства и получение. Применение бензола и его гомологов.
- •Бромирование.
- •Нитрование.
- •Гидрирование.
- •Билет №7
- •Основные положения теории химического строения органических веществ а.М.Бутлерова. Химическое строение как порядок соединения и взаимного влияния атомов в молекулах.
- •Реакции ионного обмена в водных растворах. Условия их необратимости.
- •Задача.
- •Билет №8
- •Изомерия органических соединений и ее виды.
- •Существует несколько видов изомерии:
- •Классификация неорганических соединений.
- •Опыт и задача.
- •Билет №9
- •Металлы, их положение в периодической системе химических элементов д.И.Менделеева, строение их атомов, металлическая связь. Общие химические свойства металлов.
- •Природные источники углеводородов: нефть, природный газ и их практическое значение.
- •Задача.
- •Билет №10
- •Строение и особенности химической связи в спиртах
- •3.Опыт. Проведение реакций, подтверждающих важнейшие химические свойства глицерина.
- •Билет №11
- •Фенол, его строение, свойства, получение и применение.
- •Задача.
- •Билет №12
- •Электрохимический ряд напряжений металлов. Вытеснение металлов из растворов солей другими металлами.
- •А льдегиды, их химическое строение и свойства. Получение, применение муравьиного и уксусного альдегида.
- •3. Задача.
Задача.
Сколько нитробензола образуется при взаимодействии бензола массой 15,6г и 200г раствора азотной кислоты?
15,6г 200г xг
C6H6 + HNO3 = C6H5NO2 + H2O
1 моль 1 моль 1 моль
78г/моль 63г/моль 123г/моль
78г 63г 123г
ν=
ν(C6H6)
= 
ν(C6H5NO2)
= 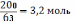
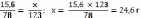
Ответ: образуется 24,6 г нитробензола.
Билет №10
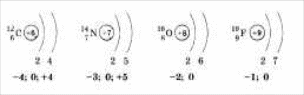
Неметаллы, их положение в периодической системе химических элементов Д.И.Менделеева, строение их атомов. Окислительно-восстановительные свойства неметаллов на примере элементов подгруппы кислорода.
Неметаллы располагаются в главных подгруппах выше диагонали (т. е. в верхнем правом углу). К неметаллам относятся также водород Н и инертные газы.
Для
общей характеристики неметаллов
необходимо обратить внимание на строение
их атомов. Приведем строение атомов
углерода С, азота N, кислорода О, фтора
F. По мере увеличения порядковых номеров
атомов элементов и накопления электронов
на внешнем слое у неметаллов одного
периода усиливается способность
принимать электроны от других атомов
на свой внешний слой, т. е. неметаллические
свойства элементов в периодах
увеличиваются.
 Простые
вещества — неметаллы могут иметь как
атомное (Si, В), так и молекулярное (Н2,
N2,
Br2)
строение. Поэтому среди неметаллов есть
газы (О2,
С12),
жидкости (Вг2),
твердые вещества (С, I2).
Большинство неметаллов не электропроводны,
имеют низкую теплопроводность, а твердые
вещества непластичны.
Переходя к характеристике химических
свойств, необходимо отметить, что более
типичным для неметаллов является процесс
принятия электронов. В этом отличие
химических свойств неметаллов от
химических свойств металлов. Это
положение можно подтвердить взаимодействием
неметаллов с простыми веществами.
Неметаллы могут проявлять свойства как
окислителей, так и восстановителей.
Приведем примеры.
Простые
вещества — неметаллы могут иметь как
атомное (Si, В), так и молекулярное (Н2,
N2,
Br2)
строение. Поэтому среди неметаллов есть
газы (О2,
С12),
жидкости (Вг2),
твердые вещества (С, I2).
Большинство неметаллов не электропроводны,
имеют низкую теплопроводность, а твердые
вещества непластичны.
Переходя к характеристике химических
свойств, необходимо отметить, что более
типичным для неметаллов является процесс
принятия электронов. В этом отличие
химических свойств неметаллов от
химических свойств металлов. Это
положение можно подтвердить взаимодействием
неметаллов с простыми веществами.
Неметаллы могут проявлять свойства как
окислителей, так и восстановителей.
Приведем примеры.
 2.
Предельные одноатомные спирты, их
строение, свойства. Получение и применение
этилового спирта.
2.
Предельные одноатомные спирты, их
строение, свойства. Получение и применение
этилового спирта.
Спиртами называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп –OH), соединенных с углеводородным радикалом.
Предельные одноатомные спирты содержат только одну гидроксильную группу.
Общая формула R-OH
CH3-OH метанол
C2H5-OH этанол
C3H7-OH пропанол
Строение и особенности химической связи в спиртах
Спирты геометрически подобны молекуле воды. Угол R−O−H в молекуле метанола равен 109°.
|
|
Подобно воде, спирты имеют существенно более высокие температуры плавления и кипения, чем можно было бы предполагать на основании физических свойств родственных соединений.
Это объясняется наличием в спиртах водородных связей.
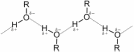
Метанол и этанол неограниченно смешиваются с водой и имеют довольно высокие плотности и температуры кипения, а высшие спирты практически не растворяются в воде.
Атом водорода гидроксильной группы очень подвижен и может замещаться атомом металла. Спрты являются слабыми кислотами, а также слабыми основаниями.
Взаимодействие с щелочными металлами.
C2H5-OH + Na → C2H5-ONa + H2 ↑
этилат натрия
Взаимодействие с кислотами.
CH3COOH + C2H5OH → CH3COO C2H5 + H2O
этиловый эфир
уксусной кислоты
Взаимодействие с галогеноводородами.
C2H5OH + HCl→ C2H5Cl + H2O
хлорэтан
Реакция дегидратации.
C2H5OH→ C2H4 + H2O
этилен
Окисление спиртов.
C2H5OH + CuO → CH3COH + Cu + H2O
этаналь
Горение спиртов.
C2H5OH + O2 → CO2 + H2O
На современном производстве этанол получают гидратацией этилена при помощи водяного пара:
C2H4 + H2O → C2H5OH
Наиболее старейший способ – сбраживание сахаристых веществ, содержащих глюкозу:
C6H12O6 → 2C2H5OH + 2CO2↑
Спирты - хорошие растворители. Они широко применяются в медицине, пищевой и лакокрасочной промышленности. Этанол в смеси с бензином может использоваться в качестве горючего для двигателей внутреннего сгорания.