
15. Энтропия. Т-s диаграмма. Физический смысл энтропии.
Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
![]() ,
,
где ![]() —
приращение энтропии;
—
приращение энтропии; ![]() —
минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса;
—
минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса;
Удельная энтропия отношение энтропии тела к его массе. Удельная энтропия s является справочной величиной. Удельную энтропию можно применять совместно с одним из основных параметров для графического изображения процессов. Аналогично тому, как мы строили изменение объема в зависимости от изменения температуры, мы можем изобразить некоторый процесс изменения энтропии и температуры в Т-S координатах. В этом случае любая точка на графической плоскости соответствует определенному состоянию рабочего тела, а линия от точки 1 до точки 2 отображает некий термодинамический процесс. Особенностью Т-S координат является то, что площадь под линией процесса соответствует количеству энергии отданной или полученной рабочим телом.

Т – S диаграмма цикла Карн
Пусть
имеем 2 тепловые обратимые машины с
общим холодильником, но с различными
нагревателями. Температура
холодильника ![]() меньше
температуры нагревателей
меньше
температуры нагревателей ![]() и
и ![]() ,
кроме того
,
кроме того ![]() Сравним
коэффициенты полезного действия машин
Сравним
коэффициенты полезного действия машин
![]() и
и ![]()
Т.к.
,
то ![]() ,
т.е. чем больше температура нагревателя
машины при общем холодильнике, тем выше
КПД.
,
т.е. чем больше температура нагревателя
машины при общем холодильнике, тем выше
КПД.
Рассмотрим
как изменяется значение энтропии
рабочего тела за один цикл. Пусть
температуры первой машины ![]() и
второй
и
второй ![]() больше
температуры холодильника, и пусть за
каждый цикл подводится одинаковое
количество теплоты. Рассмотрим для
какой машины будет больше изменение
энтропии
больше
температуры холодильника, и пусть за
каждый цикл подводится одинаковое
количество теплоты. Рассмотрим для
какой машины будет больше изменение
энтропии ![]()
![]()
где ![]() -
энтропия начального состояния,
-
энтропия начального состояния, ![]() -
энтропия конечного состояния; Т -
температура, при которой происходит
теплообмен. Энтропия нагревателя убывает
на величину
-
энтропия конечного состояния; Т -
температура, при которой происходит
теплообмен. Энтропия нагревателя убывает
на величину
![]()
а энтропия холодильника возрастает на величину
![]()
Так
как Q и
для
обеих машин одинаковы, то ![]() тоже
одинаковы.
тоже
одинаковы.
Изменение энтропии нагревателей (вследствие различия их температур различны
![]()
Таким, образом, изменение энтропии первой машины меньше, чем второй.
![]()
Следовательно, большему изменению энтропии рабочего тела за цикл соответствует меньший коэффициент полезного действия машины. Так как изменение энтропии холодильника одинаковое, то начальное значение энтропии больше для рабочего тела второй машины.
При этом, заведомо можно сказать, что КПД второй машины меньше. Таким образом, чем больше энтропия, тем меньше коэффициент полезного действия.
16. Математическое выражение второго закона термодинамики.
Проведем
ряд бесконечно близких адиабат,
пересекающих линии прямого а и
обратного b переходов
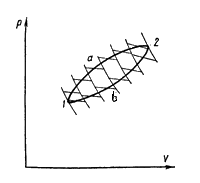 Эти линии разобьются на ряд бесконечно
малых отрезков. Через середину каждого
отрезка проведем изотермы. Тогда каждую
из линий а и b можно
считать состоящей из ряда бесконечно
близких изотерм. Таким образом,
рассматриваемый произвольный цикл
представляется совокупностью циклов
Карно с переменными температурами
нагревателей и холодильников для каждого
элементарного цикла.
Эти линии разобьются на ряд бесконечно
малых отрезков. Через середину каждого
отрезка проведем изотермы. Тогда каждую
из линий а и b можно
считать состоящей из ряда бесконечно
близких изотерм. Таким образом,
рассматриваемый произвольный цикл
представляется совокупностью циклов
Карно с переменными температурами
нагревателей и холодильников для каждого
элементарного цикла.
Обозначим
температуры, соответствующие изотермам
расширения Т1, Т2,
… Тn,
а температуры изотерм на стадии сжатия
– ![]() .
Количества теплоты, получаемые системой
в процессе расширения на соответствующих
участках элементарных циклов Карно,
обозначим
.
Количества теплоты, получаемые системой
в процессе расширения на соответствующих
участках элементарных циклов Карно,
обозначим ![]() ,
а количества теплоты, отдаваемые системой
на стадии сжатия –
,
а количества теплоты, отдаваемые системой
на стадии сжатия – ![]() .
.
Количества теплоты ΔQi и ΔQ'i (i = 1, 2, … n) система получала соответственно при температурах Ti и отдавала при температурах T'i. Это, следовательно, теплоты изотермических процессов.
На
основании равенства
![]() для каждого элементарного цикла Карно
справедливо
для каждого элементарного цикла Карно
справедливо
|
(4.46) |
Суммирование правых и левых частей полученного равенства приводит к результату:
|
(4.47) |
Полученное соотношение означает, что суммы приведенных теплот перехода системы из состояния 1 в состояние 2 по пути а и по пути b равны друг другу. Следовательно, сумма приведенных теплот не зависит от пути перехода системы из одного состояния в другое, поэтому она представляет собой изменение функции состояния, которая и была названа Клаузиусом энтропией. Эту функцию обозначают буквой S, а ее изменение – ΔS. Таким образом,
|
(4.48) |
Следовательно, на основании проведенного обобщения для любого кругового равновесного процесса на основании можно записать:
|
(4.49) |
|
(4.50) |
Это означает, что изменение энтропии системы, совершившей равновесный круговой процесс, равно нулю. Значит, энтропия есть однозначная функция состояния системы. Уравнение (4.50) является математической формулой записи второго начала термодинамики для обратимых процессов.
17. Метод исследований термодинамических процессов.
Как сказано выше первый закон т/д устанавливает взаимосвязь между количеством теплоты, внутренней энергией и работой. При этом, количество теплоты подводимое к телу или отводимое от тела зависит от характера процесса. К основным т/д процессам относятся: изохорный, изотермический, изобарный и адиабатный. Для всех этих процессов устанавливается общий метод исследования, который заключается в следующем:
выводится уравнение процесса кривой Pυ и TS – диаграммах;
устанавливается зависимость между основными параметрами рабочего тела в начале и конце процесса;
определяется изменение внутренней энергии по формуле, справедливой для всех процессов идеального газа:
u = сvм|0t2·t2 - сvм|0t1·t1. (4.1)
или при постоянной теплоемкости U=m·сv·(t2 -t1); (4.2) вычисляется работа: L = P·(V2 – V1); (4.3)
определяется количество теплоты, участвующее в процессе:
q = cx·(t2- t1); (4.4)
определяется изменение энтальпии по формуле, справедливой для всех процессов идеального газа:
i = (i2 – i1) = сpм|0t2·t2 – сpм|0t1·t1, (4.5)
или при постоянной теплоемкости: i=сp·(t2 –t1); (4.6) определяется изменение энтропии:
s=cv·ln(T2/T1)+R·ln(υ 2/υ 1) ; (4.7) s=cp·ln(T2/T1)-R·ln(P2/P1) ; (4.8) s = cv·ln(T2/T1) + cp·ln(υ 2/υ 1) . (4.9)
Все процессы рассматриваются как обратимые.
18. Дать определение основным термодинамическим процессам. Как графически они изображаются на PV и TS диаграммах? Физический смысл площади под кривой в PV и TS диаграммах.
Величины, характеризующие физическое состояние рабочего тела, называются термодинамическими параметрами состояния. Основные параметры состояния рабочего тела: удельный объем, давление и температура.
Удельный объем V — первый параметр— представляет собой объем единицы массы вещества, обычно 1 кг. Второй термодинамический параметр— давление (абсолютное) р — есть сила, приходящаяся на единицу площади поверхности, окружающей газ. Давление по международной
системе (СИ) измеряется в паскалях (Па), килопаскалях (кПа) и мега-паскалях (МПа), но встречается еще применение в качестве единицы давления килограмм-сила на квадратный сантиметр (кгс/см2). Соотношение между этими единицами: 1 кгс/см2 = =98 000 Па=98 кПа^0,1 МПа. Третий параметр — температура (абсолютная) Т — характеризует степень нагре-тости тела и измеряется в Кельвинах (К)- Между абсолютной температурой Т и температурой измеряемой по стоградусной шкале, существует зависимость: Г=<-(-273.
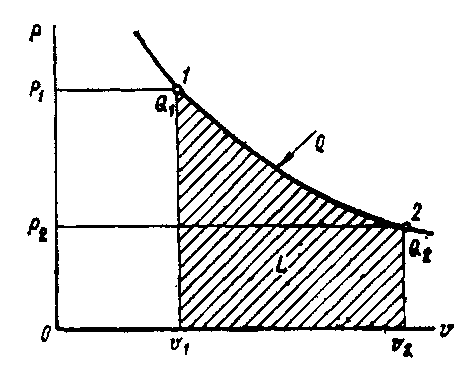
Графическое изображение процесса изменения состояния рабочего тела в координатах р—V.
19. Реальные газы. Основные понятия. Уравнение Ван-дер-Ваальса и Майера-Боголюбова.
Для описания термодинамических свойств реальных газов используются различныеуравнения состояния. При малых плотностях наличие межмолекулярного взаимодействия учитывается вириальным уравнением состояния реального газа:
pV = RT[1 + B(T)/v + C(T)/v2 + ...],
где p — давление, v — мольный объем, Т — абсолютная температура, R — газовая постоянная, В(Т), С(Т) и т. д. — вириальные коэффициенты, зависящие от температуры и характеризующие парные, тройные и т. д. взаимодействия частиц в газе. Качественно верно описывает основные отличия реального газа от идеального уравнение Ван-дер-Ваальса, учитывающее существование сил притяжения между молекулами, действие которых приводит к уменьшению давления газа, и сил отталкивания, препятствующих безграничному сжатию газа.
(p+a/Vm 2)(Vm - b) = RT,
где: R — газовая постоянная,
a и b — экспериментальные константы, учитывающие отклонение свойств реального газа от свойств идеального газа.
Член a/V2 имеет размерность давления и учитывает притяжение между молекулами газа за счет ван-дер-ваальсовых сил. Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т. е. рвн = a/Vm2, где а — постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения, Vm — молярный объем.
20. 21.Водяной пар. Основные понятия и определения.
Известно, что любое вещество в зависимости от внешних условий (давления и температуры) может находиться в газообразном, жидком и твердом агрегатных состояниях, или фазах, а также одновременно находиться в двух или трех состояниях.
Переход вещества из одного агрегатного состояния в другое называется фазовым переходом, или фазовым превращением. Вещество в разных агрегатных состояниях имеет различные свойства, в частности плотность. Это различие объясняется характером межмолекулярного взаимодействия.
Переход вещества из твердого состояния в жидкое называется плавлением, из жидкого в газообразное — испарением, из твердого в газообразное — сублимацией. Обратные процессы соответственно называются затвердеванием, или кристаллизацией,конденсацией и де-сублимацией.
Процесс получения пара из жидкости может осуществляться испарением и кипением.Испарением называется парообразование, происходящее только со свободной поверхности жидкости и при любой температуре.
Кипением называется бурное парообразование по всей массе жидкости, которое происходит при сообщении жидкости через стенку сосуда определенного количества теплоты. При этом образовавшиеся у стенок сосуда и внутри жидкости пузырьки пара, увеличиваясь в объеме, поднимаются на поверхность жидкости.
Процесс парообразования начинается при достижении жидкостью температуры кипения, которая называется температурой насыщения tн и на протяжении всего процесса остается неизменной. Температура кипения, или температура насыщения, tн зависит от природы вещества и давления, причем с повышением давления tн увеличивается. Давление, соответствующее tн называется давлением насыщения рн.
Насыщенным паром называют пар, который образовался в процессе кипения и находится в динамическом равновесии с жидкостью. Насыщенный пар по своему состоянию бывает сухим насыщенным и влажным насыщенным.
Сухой насыщенный пар представляет собой пар, не содержащий капель жидкости и имеющий температуру насыщения (t=tн) при данном давлении.
Влажный насыщенный пар – это равновесная смесь, состоящая из капель жидкости, находящейся при температуре кипения, и сухого насыщенного пара.
Отношение массы сухого насыщенного пара mс.п. к массе влажного насыщенного параmв.п. называется степенью сухости х влажного пара, то есть
|
|
Очевидно, что для жидкости х=0, для сухого насыщенного пара х=1.
Если к сухому насыщенному пару продолжать подводить теплоту, то его температура увеличится. Пар, температура которого при данном давлении больше, чем температура насыщения (t>tн), называется перегретым. Другими словами говоря перегретый пар – это пар, находящийся при температуре, превышающей температуру кипения жидкости при давлении, равном давлению перегретого пара. Величина превышения температурой пара температуры кипения жидкости называется степенью перегрева пара.
Водяной пар является реальным рабочим телом и может находиться в трёх состояниях: влажного насыщения, сухого насыщения и в перегретом состоянии. Для технических нужд водяной пар получают в паровых котлах (парогенераторах), где специально поддерживается постоянное давление.
22. Истечение и дросселирование газов. Уравнение первого закона термодинамики для движущегося потока.
Поток молекул в этом направлении
![]()
Тогда суммарный поток из области / в область 2
![]()
Для
воздуха при 20° С![]()
где F — в см2, P1 и Рг — в мм рт. ст.
ДРОССЕЛИРОВАНИЕ ГАЗА - понижение давления в потоке газа при прохождении его через дроссель — местное гидродинамическое сопротивление сопровождающееся изменением температуры; наблюдается в условиях, когда поток не совершает внешней полезной работы и отсутствует теплообмену с окружающей средой. Характеризуется коэффициентом Джоуля-Томсона (предел отношения изменения температуры газа к изменению его давления в изоэнтальпийном процессе).
23. Что называется соплом и диффузором? Сопло Лаваля.
Сопло́ — канал переменного поперечного сечения, предназначенный для разгона жидкостей или газов до определенной скорости и придания потоку требуемого направления.
Принцип действия сопла основан на непрерывном увеличении скорости жидкости или газа в направлении течения от входного до выходного сечения. Для обеспечения течения жидкости (газа) необходим перепад давления с превышением его на входном сечении.
диффузор (— часть канала (трубы), в которой происходят замедление (расширение) потока и увеличение давления. При скоростях, не превышающих скорости звука, площадь поперечного сечения Д. вдоль потока возрастает, а при сверхзвуковых скоростях уменьшается.
Сопло́ Лава́ля — техническое приспособление, разгоняющее проходящий по нему газовый поток до сверхзвуковых скоростей. Широко используется на некоторых типах паровых турбин и является важной частью современных ракетных двигателей и сверхзвуковых реактивных авиационных двигателей.
Сопло представляет собой канал, суженный в середине. В простейшем случае такое сопло может состоять из пары усечённых конусов, сопряжённых узкими концами.
24. Уравнение Вулиаса. Скорость истечения и расход.
25. Исследование процесса истечения. Комбинированные сопла.
26. Циклы ДВС: Отто, Дизеля, Тринклера.
Цикл Отто — термодинамический цикл, описывающий рабочий процесс двигателя внутреннего сгорания с воспламенением сжатой смеси от постороннего источника энергии, цикл бензинового двигателя. Назван в честь немецкого инженера Николауса Отто.
Идеальный цикл Отто состоит из четырёх процессов:
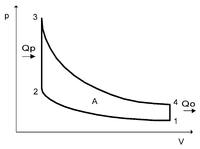
![]()
p-V диаграмма цикла Отто
1—2 адиабатное сжатие рабочего тела;
2—3 изохорный подвод теплоты к рабочему телу;
3—4 адиабатное расширение рабочего тела;
4—1 изохорное охлаждение рабочего тела.
КПД
цикла Отто ![]() ,
где
,
где ![]() —
степень сжатия,
—
степень сжатия,
![]() —
показатель адиабаты.
—
показатель адиабаты.
Идеальный цикл лишь приблизительно описывает процессы, происходящие в реальном двигателе, но для технических расчётов в большинстве случаев точность такого приближения удовлетворительна
Цикл Дизеля — термодинамический цикл, описывающий рабочий процесс двигателя внутреннего сгорания с воспламенением впрыскиваемого топлива от разогретого рабочего тела, цикл дизельного двигателя. Идеальный цикл Дизеля состоит из четырёх процессов:
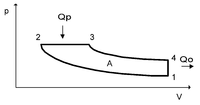
p-V диаграмма цикла Дизеля
1—2 адиабатное сжатие рабочего тела;
2—3 изобарный подвод теплоты к рабочему телу;
3—4 адиабатное расширение рабочего тела;
4—1 изохорное охлаждение рабочего тела.
КПД
цикла Дизеля 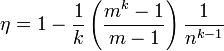 ,
где
—
степень сжатия,
,
где
—
степень сжатия,
![]() —
коэффициент
предварительного расширения,
—
коэффициент
предварительного расширения,
— показатель адиабаты.
Цикл Тринклера (англ. Seiliger cycle, англ. Sabathe cycle) — термодинамический цикл, описывающий рабочий процесс дизельного двигателя со смешанным сгоранием. Объединяет в себе цикл Отто и цикл Дизеля. Носит имя своего изобретателя Густава Тринклера.
Идеальный цикл Тринклера состоит из процессов:
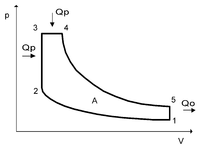
p-V диаграмма цикла Тринклера
1—2 В рабочем цилиндре воздух адиабатически сжимается за счет инерции маховика, сидящего на валу двигателя, нагреваясь при этом до температуры, обеспечивающей воспламенение топливно-воздушной смеси.
2—3 Сгорание части топлива в небольшом объеме форкамеры (V=const).
3—4 Догорание оставшегося топлива в рабочем цилиндре (P=const).
4—5 Адиабатическое расширение продуктов сгорания.
5—1 Удаление выхлопных газов (V=const).
Жидкое топливо, введенное в форкамеру при сравнительно невысоком давлении, распыляется струей сжатого воздуха, поступающего из основного цилиндра. Вместе с тем цикл со смешанным сгоранием частично сохраняет преимущества цикла Дизеля перед циклом Отто — часть процесса сгорания осуществляется при постоянном давлении.
Термический КПД цикла
Тринклера ![]() ,
,
где — степень сжатия,
![]() —
степень
предварительного расширения,
—
степень
предварительного расширения,
![]() —
степень
повышения давления при изохорном
процессе сгорания,
—
степень
повышения давления при изохорном
процессе сгорания,
— показатель адиабаты.
27. Циклы ГТУ.
Схема и цикл ГТУ с подводом тепла при постоянном давлении
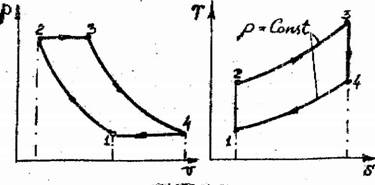
Рис. 16,2
1- изобарный отвод теплоты с продуктами 2- адиабатное сжатие воздуха в компрессоре; 4- адиабатное расширение рабочего тела в турбине; 3- изобарный подвод тепла; сгорания в атмосферу.

 .
. .
.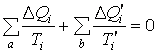 ,
,