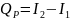- •Закон термодинамики
- •Закон Гесса 1840г. Тепловой эффект химической реакции равен теплоте образования исходных веществ минус теплота образования продуктов реакции.
- •Промерзание связанных пород приоткрытой разработке месторождений.
- •Технологические основы замораживания пород.
- •П роходки горизонтальных выработок с замораживанием пород проходят по следующим схемам:
- •Процессы сушки горной массы и виды воды в горной массе.
- •Условия протекания процессов сушки.
- •Тепловое расширение неоднородных твердых тел.
Лекция №1
Термодинамика – наука о закономерностях превращения энергии.
В ее основе 2 закона
Закон позволяет оценить количественную сторонупроцессов превращения энергии
Закон оценить качественную сторону физических и химических процессов.
ТДС –термодинамической системой называется макроскопическое тело условно выделенное из окружающей среды при помощи оболочки или перегородки.
ГОМОГЕННАЯ СИСТЕМА хим.соствав и физ.свойства одинаковы во всех ее частях, или монотонно изменяются от точки к точке. Все чистые минералы, расплавы горных пород.
ГЕТЕРОГЕННАЯ СИСТЕМА состоит из двух и более гомогенных областей или фаз. Все горные породы.
ФАЗОЙ называется однородная по химическому составу и физическим свойствам часть термодинамической системы отделенная от других фаз с иными свойствами границами раздела.
КОМПОНЕНТЫ –химически индивидуальные вещества, которые могут быть выделены из системы и существовать вне ее. Состояние горных пород определяется их параметрами.
ИНТЕНСИВНЫЕ ПАРАМЕТРЫ не зависят от количества вещества (температура и давление).
ЭКСТЕНСИВНЫЕ ПАРАМЕТРЫ зависят от количества вещества (объем, теплоемкость)
Если
экстенсивные параметры разделить на
массу, то они приобретают смысл
интенсивных (удельный объем, удельная
теплоемкость
 ).
).
ТЕМПЕРАТУРА – физическая величина характеризующая состояние термодинамического равновесия системы. В системе СИ [K].
ДАВЛЕНИЕ –сила действует по нормали к поверхности тела и деленная на единицу площади этой поверхности (Па). 1 Паскаль давления вызванная силой 1 Н на поверхность площади 0,01 м2 Па = Н/м2.
Давление бывает абсолютное и избыточное.
Рабс=Ризб+Ратм
Компрессоры и насосы дают избыточное давление.
Удельный объем – объем занимаемый единицей массы вещества
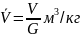 G
– масса вещества
G
– масса вещества
Плотность – обратная величина
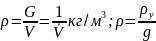
Если заданы 2 параметра любой ТДС, то можно определить все ее основные параметры:


Объем породы
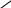
Уравнение состояния чистого вещества связывает все его параметры:

Закон термодинамики
Если нагреть объем породы ее температура повышается, изменяется внутренняя энергия и совершается внешняя работа.
ВНУТРЕНЯЯ ЭНЕРГИЯ U (Дж) – экстенсивный параметр складывается из энергии поступательного и вращательного движения молекул. Энергия внутри молекулярных колебаний энергии сил взаимодействия между молекулами
Удельная энергия
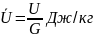
F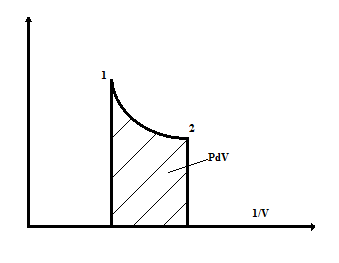 – поверхность выделенного объема.
– поверхность выделенного объема.
dV – изменение объема
dx – перемещениекаждой точки поверхности выделенного объема
А – внешняя работа, которая в данном случае представляет работу расширения


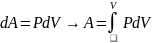
Работа расширения совершается только при изменении объема породы.
При подводе тепла к породе повышается температура, увеличивается объем, внутренняя энергия увеличивается и совершается работа расширения.
По закону сохранения энергии можем записать:
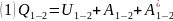

Математическое выражение первого закона термодинамики.
Если разделить на массу вещества, то получим удельный объем (поток)
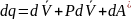
ЭНТАЛЬПИЯ, ЭНТРОПИЯ.
ЭНТАЛЬПИЯ – экстенсивный параметр

Называется сумма полной внутренней энергии и произведения давления в системе на ее объем.
Удельная массовая энтальпия, Дж/кг

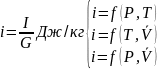

Возьмем обратимый процесс
CaO+CO2CaCO
Разность между подведенным количеством энергии в прямом направлении (Q1) и отведенным в обратном направлении (Q2) = энергии затрачиваемой на внешнюю работу, отсюда можно найти:


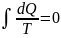
Подынтегральное выражение Клаузиус заменил на:
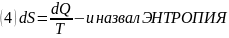
В обратимых процессах изменение энтропии системы = 0
Удельная
энтропия:
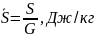
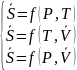
При
нагревании системы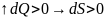 При
остывании системы
При
остывании системы

Проинтегрируем (4)
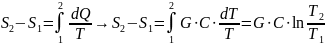
C ,Дж/мК – удельная теплоемкость горной породы.
Это выражение изменения горной породы при постоянной теплоемкости горной породы.
Лекция №2.1
Объединенный закон термодинамики.
Термодинамические процессы. Цикл Карно.
Чтобы оценить качественную сторону физических и химических процессов применяют ВТОРОЙ И ОБЪЕДИНЕННЫЙ ЗАКОНЫ термодинамики.
Рассмотрим необратимый процесс в изолированной термодинамической системе (нет теплообмена с окружающей средой).
Для такой системы dQ=0;dU=0 PdV. Пусть система состоит из двух частей имеющих температуру T1 и T2, причем T1> T2, т.е. тепло переходит от первой части к второй.
Тогда энтропия первой части уменьшается на величину:
 ,
а второй части увеличится на величину:
,
а второй части увеличится на величину:
По закону сохранения энергии ощее изменение энтропии равно:
 т.к.
т.к.
 >
>
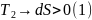
Т.е. энтропия в необратимом процессе изолированной системы всегда возрастает.
Если система не изолирована, то уравнение (1) принимает вид:

Вывод:
энтропия любых процессов не может
уменьшаться. Для обратимых процессов
она постоянная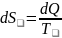 ,
а для необратимых процессов она
возрастает
,
а для необратимых процессов она
возрастает
Изолированная система |
Неизолированная система |
Обратимый процесс |
|
dS=0 |
dS=dQ/T |
Необратимый процесс |
|
dS>0 |
dS>dQ/T |
dS≥ 0 |
dS≥dQ/T |
Второй закон термодинамики.
В 1850г.Клаузиус сформулировал 2 закон термодинамики: теплота не может сама собой переходить от более холодного тела к более нагретому.
dS>dQ/T; dS≥dQ/T
Без внешнего воздействия процессы могут протекать только в том случае, когда их энтропия постоянна (обратимые процессы знак =) или возрастает (необратимые процессы >).
T dS>dQ подставим в уравнение первого закона термодинамики и получим уравнение объединенного закона термодинамики:
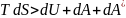 или
или
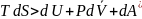
Для ед. массы в-ва уравнение будет иметь следующий вид:
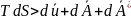 или
или
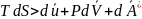
Термодинамические процессы.
Термодинамический процесс – это совокупность изменяющихся параметров и как следствие состояний термодинамической системы.
Процессы бывают равновесные и не равновесные.
Равновесные процессы – процессы, при которых системы переходят последовательно из одного состояния равновесия в другое.
Состояние равновесия термодинамической системы – это такое состояние, при котором система принимает минимальное значение общей энергии. В этом состоянии все параметры системы остаются постоянными.
Равновесие бывает:
УСТОЙЧИВОЕ, когда после внешнего воздействия система возвращается в исходное положение.
НЕУСТОЙЧИВОЕ, когда система переходит в новое состояние устойчивого равновесия.
ОТНОСИТЕЛЬНО УСТОЙЧИВОЕ (метастабильное состояние) термодинамическая система может находиться в этом состоянии длительное время и небольшие внешние воздействия приводят к со переходу в новое метастабильное состояние.
При равновесии изомерной системы:
S=Smax; dS=0; d2S<0
При равновесии неизомерной системы происходит ее взаимодействие с окружающей средой. Рассмотрим 4 типа такого взаимодействия:
Объем и энтропия системы постоянны, т.е. V=const, S=const => dV=0; dS=0
Согласно объединенному закону термодинамики, имеем:
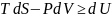
Критерием
равновесия системы в этом случае
является условие
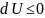 ,
а состояние равновесия соответствует
случаю, когда U=Umin;
dU=0;
d2U>0
,
а состояние равновесия соответствует
случаю, когда U=Umin;
dU=0;
d2U>0
Давление и энтропия системы постоянны, т.е. Р=const; S=const; => dP=0; dS=0
Согласно определению энтальпии и объединенному закону термодинамики имеем:
I=U+PV
или dI=dU+PdV+VdP
или dI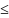 TdS+VdP
TdS+VdP
Критерием
равновесия системы в этом случае
является условие
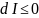 ,
а состояние равновесия соответствует
случаю, когда I=Imin;
dI=0;
d2I>0
,
а состояние равновесия соответствует
случаю, когда I=Imin;
dI=0;
d2I>0
Объем и температура системы постоянны, т.е. V=const; T=const =>dV=0; dT=0
Т.к.

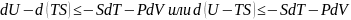
Функция U-TS называется свободной энергией или изохорно – изотермическим потенциалом:
F=
U-TS,
тогда

Критерием
равновесия системы в этом случае
является условие
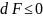 ,
а состояние равновесия соответствует
случаю, когда F=Fmin;
dF=0;
d2F>0
,
а состояние равновесия соответствует
случаю, когда F=Fmin;
dF=0;
d2F>0
Давление и температура системы постоянны, т.е. Р=const; T=const=>dР=0; dT=0
Согласно определению энтальпии и второму закону термодинамики имеем:
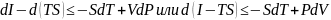
 ,
тогда
,
тогда
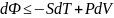
Критерием
равновесия системы в этом случае
является условие
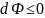 ,
а состояние равновесия соответствует
случаю, когда Ф=Фmin;
dФ=0;
d2Ф>0
,
а состояние равновесия соответствует
случаю, когда Ф=Фmin;
dФ=0;
d2Ф>0
Вывод: характеристическими функциями термодинамической системы, характеризующими их равновесие с окружающей средой являются, внутренняя энергия, энтальпия, свободная энергия F и изобарно-изотермический потенциал Ф.
Неравновесные термодинамические процессы.
Неравновесные процессы – это такие процессы, коротые не сопровождаются состоянием равновесия. Для них характерно то, что разные части системы имеют различные теродинамические параметры.
Практически многие из термодинамических процессов с определенным приближением можно считать равновесными.
Если при равновесном процессе температура постоянна, то этот процесс называется изотермическим.(плавление, испарение, сублимация горных пород).
Если при равновесном процессе давление постоянно, то процесс называется изобарным (подземная газификация углей).
Если при равновесном процессе объем постоянен, то процесс называется изохорным (термическое и электротермическое дробление горных пород).
Если при равновесном процессе отсутствует теплообмен с окружающей средой, то процесс называется адиабатным.
Процесс при переходе системы из точки 1 в точку 2 назовем прямым, из точки 2 в точку 1 – обратным. Если при обратном процесс система возвращается в исходное состояние, по той же прямой, то такой процесс называется обратимым. Если не выполняется условие, то такой процесс называется необратимым.
Лекция №2.2
Термодинамическая вероятность.
Макроскопическое состояние системы определяется термодинамическими параметрами состояния. Для его определения достаточно знать 2 любых параметра.
Макроскопическое состояние определяется совокупностью параметров состояния всех молекул системы (скорость, частота колебаний молекул и др).
Термодинамической вероятностью называется число микроскопических состояний с помощью которых можно реализовать заданное состояние макроскопической системы.
Чем больше термодинамическая вероятность и энтропия, тем более устойчивой является термодинамическая система. Больцман установил зависимость между термодинамической вероятностью и энтропией:

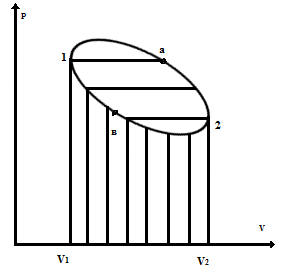
Цикл Карно. Работа цикла.
При
расширении термодинамической системы
она совершает работу над окружающей
средой. Чтобы вернуть систему в исходное
состояние 1 из состояния 2 ее необходимо
сжать,т.е. совершин\ть работу за счет
внешнего источника:

Работа при расширении системы равна работе с обратным знаком.
…
Расширение
осуществляется по пути 1→а→2, сжатие
по пути 2→в→1. Площадь
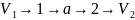 характеризует работу при расширении,
а площадь
характеризует работу при расширении,
а площадь
 характеризует работу при сжатии.
характеризует работу при сжатии.
Разность между работами расширения и сжатия называется работой цикла.
1 Если кривая расширения находится над кривой сжатия, то работа цикла положительная, т.е. работа осуществляется за счет подведения тепла из вне (все тепловые двигатели).
2 Если кривая расширения ниже кривой сжатия, то в результате цикла работабудет отрицательной и от системы будет отводится тепло ( все холодильные установки).
1 824
Карно разработал Теорию тепловых
двигателей, в основе которой лежит цикл
теплового двигателя или цикл Карно,
который осуществляет рабочим телом
между горячим и холодным источником
тепла.
824
Карно разработал Теорию тепловых
двигателей, в основе которой лежит цикл
теплового двигателя или цикл Карно,
который осуществляет рабочим телом
между горячим и холодным источником
тепла.
Рабочим телом называется вещество за счет изменения состояния которого получают (затрачив) работу.
По первому закону Термодинамики:
 не
зависит
от пути процесса, а зависит от параметров
начального и конечного состояний
системы, то dU=0,
после интегрирования получаем:
не
зависит
от пути процесса, а зависит от параметров
начального и конечного состояний
системы, то dU=0,
после интегрирования получаем:
Цикл Карно состоит из 2 изотерм и 2 адиабат. Рабочее тело (газ) в точке 1 имеет температуру Т1, удельный объем V1 и давление Р1. К нему подводится тепло от горячего источника, температура источника больше температуры Т1. Газ расширяется и совершает работу , двигает поршень в цилиндре дыигателя.
При расширении газа его температура уменьшается, поэтому на всем участке 1-2 к нему подводится тепло от внешнего источника. Прощесс изотермический, т.е. температура постоянна.
На участке 2-3 газ расширяется по адиабате без подведения тепла из вне. Работа осуществляется только за счет внутренней энергии газа.Для адиабатического процесса по первому закону термодинамики имеем:

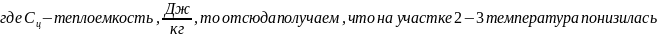

В
точке 3 температура газа равна Т2. При
этом происходит сжатие газа и от газа
отводится тепло к холодному источнику,
причем
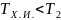
Сжатие газа на участве 3-4 и отвод тепла осуществляется по изотерме,т.е. Т2=const. В точке 4 отвод тепла прекращается и дальнейшее сжатие газа осуществляется по адиабате, пока он не вернется в исходное состояние 1.
Работа
газа при расширении изображается
площадью
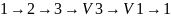 ,
работа сжатия газа площадью
,
работа сжатия газа площадью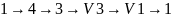 ,
полезная работа цикла отдаваемая
потребителю 1-2-3-4-1
,
полезная работа цикла отдаваемая
потребителю 1-2-3-4-1
В изотермическом процессе 1-2 температура газа ниже температуры горячего источника на малую величину dT,а в процессе 3-4 температура газа выше температуры холодного источника на такую же бесконечно малую величинуdT, т.е. рассмотренный цикл является обратимым процессом.
Лекция№3
Фазовые переходы
Фазовый переход – это переход вещества из одной фазы в другую.
Минералы и горные породы в различных фазных состояниях имеют различные физические свойства, например плотность. Это объясняется различием их структур и различием малекулярных взаимодействий в кристаллической решетке. Теплотой фазового перехода называется количество тепла выделившегося или поглотившегося при агрегатных превращениях минералов и пород. Температура фазного перехода не постоянна и зависит от внешнего давления ( в минералах).
Правило физ Гиббса
Устанавливает взаимосвязь между степенями свободы системы числом компонентов и фаз:

Для
однокомпонентной системы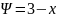 ,
такая
система может существовать только при
одном условии и параметры которой могут
характеризоваться
3 точкой.
,
такая
система может существовать только при
одном условии и параметры которой могут
характеризоваться
3 точкой.
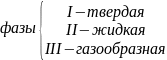
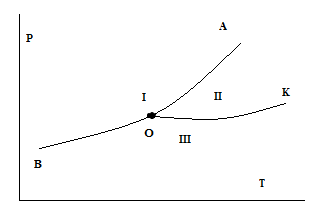
О – тройная (вещества в трех агрегатных состояниях, например: вода при 00С.
Линии:
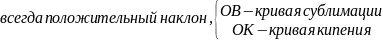
т.е. давление растет и температурный фазный переход растет
ОА – кривая плавления имеет положительный и отрицательный наклоны, т.е. с ростом давления температура может и возрастать и понижаться.
В минералах фазные переходы происходят при t=200-9000C, при этом падает их упругость и уменьшается прочность, что способствует новой эффективности их разрушения.
Фазовые переходы бывают I иII родов:
I род: идет поглощение или выделение теплоты перехода и скачкообразное изменение внутренней энергии, энтропии и удельного объема. Величина скачка внутренней энергии:

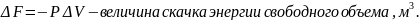
Фазовые переходы I рода в минералах обратимые.
II род: идет скачкообразное изменение макроскопических свойств минералов (теплоемкость, коэффициент теплового расширения). При этом изменяется расположение атомов в кристаллической решетке.
В горных породах изменения температуры сопровождаются фазными переходами, как I рода так и II рода.
Основные уравнения термодинамики физических (или фазных) переходов.
Энергия
Гиббса или изобарно – изотермический
потенциал, Дж:
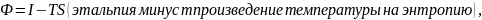 разделим
на массу, получим химический потенциал,
Дж/кг.
разделим
на массу, получим химический потенциал,
Дж/кг. /
/
Если химические потенциалы двух фаз однокомпонентной системы различны, то это приводит к переходу фазы с наибольшим потенциалом в фазу с наименьшим, пока в системе не установится фазовое равновесие. При фазном равновесии химические потенциалы равны:
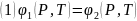
При
изменении температуры и давления фаз
на
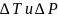 получится:
получится:

Функции, стоящие в левой и правой части разложим в ряд Маклорена и учитывая уравнение (1), получим
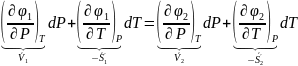 тогда
тогда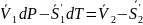
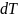 преобразуем и получим уравнение
Клапейрона - Клазиуса
преобразуем и получим уравнение
Клапейрона - Клазиуса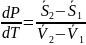
В данном виде не может по нему действовать влияние теплоты фазного перехода на характер величины изменения давления перехода при изменении температуры.
Уравнение
удельной энтальпии: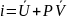
Удельная энтальпия в дифференциальном виде:
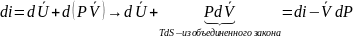
Для изобарных процессов имеем:
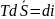
Т.к.
при фазном переходе температура системы
не меняется, то интегрирование дает:


Уравнение
Клайперона – Клазиуса:
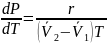
Примеры фазных переходов:
Жидкость в пар:
 -
уд.объем
жидкости на линии кипения,м3/кг;
-
уд.объем
жидкости на линии кипения,м3/кг;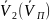 -
уд.объем
пара на линии кипения,
м3/кг;
Р-равновесное
давление в точках фазного перехода,
Па, тогда уравнение Клайперона:
-
уд.объем
пара на линии кипения,
м3/кг;
Р-равновесное
давление в точках фазного перехода,
Па, тогда уравнение Клайперона:
 ,
с
ростом температуры давление в фазном
переходе жидкость – пар всегда
увеличивается, т.е.
,
с
ростом температуры давление в фазном
переходе жидкость – пар всегда
увеличивается, т.е.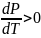 ,
,
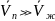 ,
,
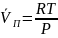 –из
уравнения Клайперона
–из
уравнения Клайперона
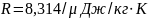 ,
,
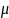 -
вес атома вещества. Интегрируем:
-
вес атома вещества. Интегрируем:
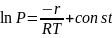

Твердое тело в жидкость:
 -
уд.объем
жидкости на линии плавления,м3/кг;
-
уд.объем
жидкости на линии плавления,м3/кг; -
уд.объем
тв.тела на линии плавления,
м3/кг;
Р-равновесное
давление в точках фазного перехода,
Па, тогда уравнение Клайперона:
-
уд.объем
тв.тела на линии плавления,
м3/кг;
Р-равновесное
давление в точках фазного перехода,
Па, тогда уравнение Клайперона:
 ,
т.к.
,
т.к.
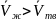 ,
то
с ростом давления, температура фазного
перехода твердое тело –жидкость
возрастает и наоборот.
,
то
с ростом давления, температура фазного
перехода твердое тело –жидкость
возрастает и наоборот.Твердое тело –пар:
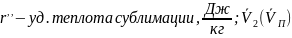 -
уд.объем
пара на линии сублимации,м3/кг;
-
уд.объем
тв.тела на линии сублимации,
м3/кг;
Р-равновесное
давление в точках фазного перехода,
Па, тогда уравнение Клайперона:
-
уд.объем
пара на линии сублимации,м3/кг;
-
уд.объем
тв.тела на линии сублимации,
м3/кг;
Р-равновесное
давление в точках фазного перехода,
Па, тогда уравнение Клайперона:
 ,
т.к.
,
т.к.
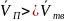 ,
,
Фазовые переходы при неодинаковом давлении фаз.
Рассмотрим
двухфазную систему находящуюся в
равновесии при давлении Р0, равенство
химических потенциалов для нее:
Если
температура постоянна, то система может
перейти в новое равновесное состояние,
когда давление в первой фазе изменится
на
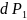 ,
а
во второй фазе на
,
а
во второй фазе на
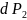
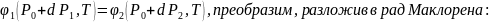
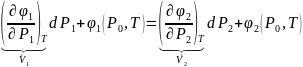 ,
,
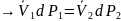 ,
преобразуем полученное уравнение
Пайтинга:
,
преобразуем полученное уравнение
Пайтинга: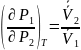 ,
следовательно
физический смысл уравнения: давление
в одной из фаз приводит к увеличению
давления во второй фазе, причем в первой
фазе больше или меньше чем во второй
фазе во столько раз, во сколько удельный
объем, второй фазы больше или меньше
чем в первой.
,
следовательно
физический смысл уравнения: давление
в одной из фаз приводит к увеличению
давления во второй фазе, причем в первой
фазе больше или меньше чем во второй
фазе во столько раз, во сколько удельный
объем, второй фазы больше или меньше
чем в первой.
Другой
случай: температура одинакова, а давление
различно:
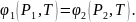
При изменении температуры в системе на , она перейдет в новое равновесное состояние только тогда, когда давление в первой фазе изменится на , а со второй фазе на , тогда для нового равновесного состояния системе:

В рад Маклорена:
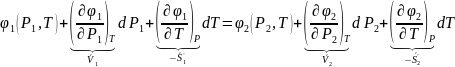
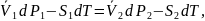 знаем
знаем
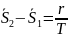
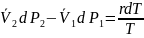
Лекция №4
Основы химической термодинамики.
На основе законов химической термодинамики можно дать положительную оценку термодинамическим процессам, протекающим в горных породах с изменением их химического состава и количества – это окислительно-восстановительные термохимические и деструктивные процессы.
Основой химической термодинами являются I и II закон:
I закон позволяет определить тепловые эффекты реакции.
II закон позволяет определить условия при которых будет протекать химическая реакция.
Химическая реакция с выделением тепла называется ЭКЗОТЕРМИЧЕСКАЯ с поглощением тепла называется ЭНДОТЕРМИЧЕСКАЯ.
Количество тепла, выделяющееся или поглощающееся в результате химической реакции при постоянном объеме и температуре или давлении и температуре и отсутствии внешней работы называется ТЕПЛОВЫМ ЭФЕКТОМ ХИМИЧЕСКОЙ РЕАКЦИИ.
Тепловые эффекты бывают:
С V=const, T=const –изохорно-изотермические Qv
C P=const, T=const – изобарно-изотермические Qp
Для изохорно-изотермические Qv
dV=0 и первый закон термодинамики имеет вид:
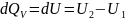 ,
т.е.
тепловой эффект равен изменению
внутренней энергии системы в результате
химической реакции
,
т.е.
тепловой эффект равен изменению
внутренней энергии системы в результате
химической реакции
Для изобарно-изотермические Qp
dP=0 и I закон имеет вид
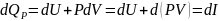
Т.е. тепловой эффект равен изменению ЭНТАЛЬПИИ системы в результате протекания химической реакции: