- •1. Предмет физической химии и ее значение. Основные разделы. Роль выдающихся ученых в развитии физической химии. Прикладное значение физической и коллоидной химии
- •Разделы:
- •Роль выдающихся ученых в развитии физической химии
- •Прикладное значение физической и коллоидной химии
- •2. Агрегатные состояния вещества, их различия с точки зрения кинетической энергии частиц. Плазменное состояние вещества
- •3. Газообразное состояние вещества. Модель идеального газа. Газовые законы. Уравнение Клапейрона - Менделеева. Универсальная газовая постоянная, её физический смысл.
- •4. Газовые законы. Их графическое выражение.
- •5. Реальные газы. Причины отклонения в поведении реальных газов от законов идеальных газов. Уравнение состояния реального газа Ван-дер-Ваальса. Изотерма реального газа.
- •6. Критическое состояние и критические параметры вещества. Газовые смеси. Состав смеси по массовым, объемным и молярным долям. Парциальное давление. Закон Дальтона.
- •8. Твердое состояние вещества. Кристаллическое и аморфное состояние. Основные типы кристаллических решеток
- •9. Предмет термодинамики и его значение для изучения химических процессов. Основные термодинамические понятия: система, процесс, функция состояния.
- •10. Первое начало термодинамики и его математическое выражение. Значение первого начала термодинамики. Термохимия.
- •11. Теплоемкость веществ. Молярная, удельная и объемная теплоемкость. Зависимость теплоемкости от температуры и давления. Связь между различными видами теплоемкости.
- •12. Работа расширения газа при изобарическом, изохорическом, изотермическом и адиабатическом процессах.
- •13. Тепловые эффекты химических превращений. Факторы, влияющие на тепловой эффект. Закон Кирхгофа. Связь между тепловыми эффектами при постоянном давлении и постоянном объеме.
- •Следствия из закона Гесса
- •Стандартная энтальпия образования
- •15. Второе начало термодинамики. Его значение и формулировки. Математическое выражение. Энтропия как характеристическая функция состояния системы.
- •Формулировки
- •16. Энергия Гиббса. Направление химических процессов. Расчет изменения энергии Гиббса по справочным данным.
- •17. Обратимые и необратимые реакции. Состояние химического равновесия. Различные способы выражения констант равновесия. Связь между ними.
- •18. Обратимые и необратимые реакции. Состояние химического равновесия. Связь между Кр и Кс. Максимальная работа обратимого процесса.
- •19. Факторы, влияющие на положение равновесия. Связь константы равновесия с энергией Гиббса. Принцип Ле Шателье, его практическое применение.
- •37. Электрохимическая коррозия металлов. Способы защиты от нее.
- •38. Основные понятия химической кинетики.
- •56. Состав, получение, классификация полимеров. Механические свойства полимеров. Взаимодействие полимеров с растворителями.
- •57. Растворы высокомолекулярных соединений. Их классификация. Свойства разбавленных растворов. Применение полимеров.
3. Газообразное состояние вещества. Модель идеального газа. Газовые законы. Уравнение Клапейрона - Менделеева. Универсальная газовая постоянная, её физический смысл.
Газ (газообразное состояние) — агрегатное состояние вещества, характеризующееся очень слабыми связями между составляющими его частицами (молекулами, атомами или ионами), а также их большой подвижностью. Частицы газа почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения.
Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. В отличие от жидкостей, газы не имеют фиксированного объёма[1] и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуда).
Идеальный газ — газ, в котором взаимодействие между молекулами сводится к парным столкновениям, причём время межмолекулярного столкновения много меньше среднего времени между столкновениями. Идеальный газ является простейшим модельным объектом молекулярной физики.
Уравнение
состояния идеального газа ![]()
Поведение идеальных газов описывают следующие законы: 1) при постоянной температуре изменение объема газа обратно пропорционально изменению давления (закон Бойля - Мариотта); 2) при постоянном давлении изменение объема газа прямо пропорционально изменению абсолютной температуры (закон Шарля - Гей-Люссака); 3) при постоянных температуре и давлении изменение объема прямо пропорционально изменению количества вещества (закон Авогадро). Эти законы можно представлены в уравнение Клапейрона – Менделеева: PV = nRT, где Р - давление газа (Па), V - его объем (м3), Т - абсолютная температура (К), n - число молей газа, R - универсальная газовая постоянная, равная 8,314 Дж/K*моль. Физический смысл универсальной газовой постоянной в том, что она показывает, какую работу совершает один моль идеального газа при изобарном расширении при нагревании на 1 К.
4. Газовые законы. Их графическое выражение.
Три процесса: изотермический, изохорный и изобарный.
Изопроцессом называют процесс, происходящий с данной массой газа при одном постоянном параметре — температуре, давлении или объеме. Из уравнения состояния как частные случаи получаются законы для изопроцессов.
1) Изотермическим называют процесс, протекающий при постоянной температуре. Т = const. Он описывается законом Бойля—Мариотта: pV = const.
2) Изохорным называют процесс, протекающий при постоянном объеме. Для него справедлив закон Шарля: V = const, p/T = const.
3) Изобарным называют процесс, протекающий при постоянном давлении. Уравнение этого процесса имеет вид V/T = const и называется законом Гей-Люссака.
Все процессы можно изобразить графически
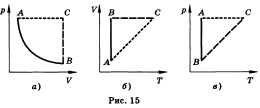
5. Реальные газы. Причины отклонения в поведении реальных газов от законов идеальных газов. Уравнение состояния реального газа Ван-дер-Ваальса. Изотерма реального газа.
Реальные газы не подчиняются законам идеального газа. Отклонения от этих законов увеличиваются с ростом давления и уменьшением температуры газа.
Й. Ван-дер-Ваальс (1873) предложил уравнение состояния реального газа, аналогичное уравнению Клапейрона—Менделеева для идеального газа, в которое введены поправочные параметры, учитывающие собственный объем молекул газа и их взаимное притяжение.
Уравнение Ван-дер-Ваальса для одного моля газа имеет вид
![]()
Слагаемое а/V2 характеризует внутреннее давление газа; параметр а — способность молекул к взаимному притяжению; параметр Ь учитывает собственный объем молекул и их взаимное отталкивание при малых расстояниях.
Изотермы реального
газа (схематично)
Синие
— изотермы при температуре ниже
критической. Зелёные участки на них
— метастабильные
состояния.
Участок
левее точки F — нормальная жидкость.
Точка
F — точка
кипения.
Прямая
FG — равновесие жидкой и газообразной
фазы.
Участок
FA — перегретая
жидкость.
Участок
F′A — растянутая
жидкость (p<0).
Участок
AC — аналитическое
продолжение изотермы,
физически невозможен.
Участок
CG — переохлаждённый
пар.
Точка
G — точка
росы.
Участок
правее точки G — нормальный газ.
Площади
фигуры FAB и GCB равны.
Красная
— критическая
изотерма.
K
— критическая
точка.
Голубые
— сверхкритические изотермы