
Билет №1
Идеальный газ - это газ, в котором собственным объёмом молекул и межмолекулярным
взаимодействием (кроме процессов столкновений) можно пренебречь. Идеальным газом можно считать газ, находящийся при не большом давлении и не высокой температуре. Давление такого газа будет определяться ударами молекул о стенки сосуда. Сила удара зависит от скорости движения молекул, их массы и концентрации молекул сосуда. Идеальным принято считать газ, если:
а) между молекулами отсутствуют силы притяжения.
б) газ очень разряжен, т.е. расстояние между молекулами намного больше размеров самих молекул;
в) молекулы сталкиваются друг с другом как абсолютно упругие шары, движение которых
описывается законами механики.
На
основании использования основных
положений молекулярно-кинетической
теории было получено основное уравнение
МКТ идеального газа ( уравнение Клаузиуса
):![]() . Р – давление идеального газа. m0
– масса молекулы. n
– концентрация молекул.
. Р – давление идеального газа. m0
– масса молекулы. n
– концентрация молекул.
![]() -
среднее значение. Средняя кинетическая
энергия одной молекулы вычисляется по
формуле :
-
среднее значение. Средняя кинетическая
энергия одной молекулы вычисляется по
формуле :
![]() .
Подставив
.
Подставив
![]() в уравнение Клаузиуса, получаем
в уравнение Клаузиуса, получаем
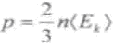 .
Уравнение Клайперона- Менделеева:
.
Уравнение Клайперона- Менделеева:
![]() .
.
Уравнение Клапейрона - Менделеева показывает, что возможно одновременное изменение трех параметров, характеризующих состояние идеального газа. Особую роль в физике и технике играют три процесса: изотермический, изохорный и изобарный.
Изопроцессом называют процесс, происходящий с данной массой газа при одном постоянном параметре — температуре, давлении или объеме.
Изотермическим называют процесс, протекающий при постоянной температуре. Т = const. Он описывается законом Бойля—Мариотта: pV = const.
Изохорным называют процесс, протекающий при постоянном объеме. Для него справедлив закон Шарля: V = const, р/Т = const.
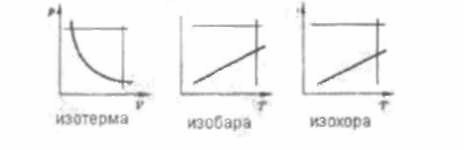
Изобарным называют процесс, протекающий при постоянном давлении. Уравнение этого процесса имеет вид V/T = const и называется законом Гей-Люссака.
Основные положения МКТ:
1)Все ве-ва состоят из молекул, между которыми имеются промежутки
2)Молекулы находятся в непрерывном беспорядочном движении(тепловом)
3)Между молекулами есть силы взаимодействия--- притяжения или отталкивания, в зависимости от расстояния между ними
Билет №2
Внутренняя энергия - это энергия, которая обладает термодинамической системой. Состоит из потенциальной и кинетической энергии. Потенциальная - энергия взаимодействия частиц или тел. Кинетическая - энергия движения. Изменить внутреннюю энергию тела можно за счёт:
I) теплообмена; 2) совершения механической работы над системой.
Теплообмен бывает:
Теплопроводность - это передача тепла от более нагретого к более холодному.
Конвекция - передача тепла с помощью газа или жидкости.
Тепловое излучение - нагревание с помощью электромагнитного излучения. Количество теплоты (Q): Это скалярная физическая величина которая является мерой изменения внутренней энергии системы ( тела ) в процессе теплообмена ( теплопередачи ). Первая единица измерения количества теплоты определялась как количество теплоты необходимое для нагревания 1г. дистиллированной воды на 1 градус - это была калория. 1кал.=4,186 Дж. Джеймс Джоуль установил, что процесс передачи теплоты - это способ передачи энергии. Калориметр - прибор для измерения количества теплоты, выделяющейся или поглощающейся при физических, химических или биологических процессах.
1 начало термодинамики--- закон сохранения энергии в термодинамических процессах. Q=(дельта)U+A
1 начало термодинамики для изопроцессов:
1) в изотермическом: Q=A, т.е. все количество теплоты, получаемое системой, расходуется на совершение работы(КПД процесса n(ню)=1), причём если Q>0, то система совершает работу, а если Q<0, то работа совершается над системой.
2)в изохорном: Q=(дельта)U, т.е. всё кол-во теплоты, сообщённое системе, расходуется на изменение её внутренней энергии (КПД процесса n(ню)=0)
3)в изобарном: Q=(дельта)U+A, где A=p(дельта)V--- работа, совершаемая системой при изменении ее объёма (КПД процесса 0<n(ню)<1)
