
- •2.Физико-химические свойства углеводородосодержащих веществ и методы их расчета
- •2.1. Контроль качества нефтей
- •2.2. Классификация нефтей
- •2.3. Плотность и молекулярная масса
- •2.4. Вязкость нефтей и нефтепродуктов
- •2.5. Особенности свойств нефтеконденсатных смесей
- •Температура, с
- •2.6. Фазовые состояния углеводородных систем при изменении давления и температуры
- •2.6.1. Критические параметры углеводородов
- •Давление
- •2.6.2. Давление насыщенных паров
- •2.7. Теплофизические свойства нефти и нефтепродуктов в процессах тепломассопереноса
-10 -6 -2
2 6 10
14 18Температура, с
Р
78
ка наблюдаются на участке, характеризующемся наиболее низкой температурой нефти в зимний период.
Выбору формул для определения статического напряжения сдвига посвящены работы Абузовой Ф.Ф., Мукук К.В., Тугунова П.И., Губина В.Е., Новоселова В.Ф., Арменского Е.А., Скрипникова Ю.В., Пиядина М.Н., Абрамзона Л.С., Дегтярева В.Н., Диденко В.С. и др.
Н
(2.29)![]()
где рП – пусковое давление; l и D – длина и диаметр трубопровода; τm – минимальное начальное напряжение сдвига нефти, соответствующее температуре нефтепровода и продолжительности его остановки.
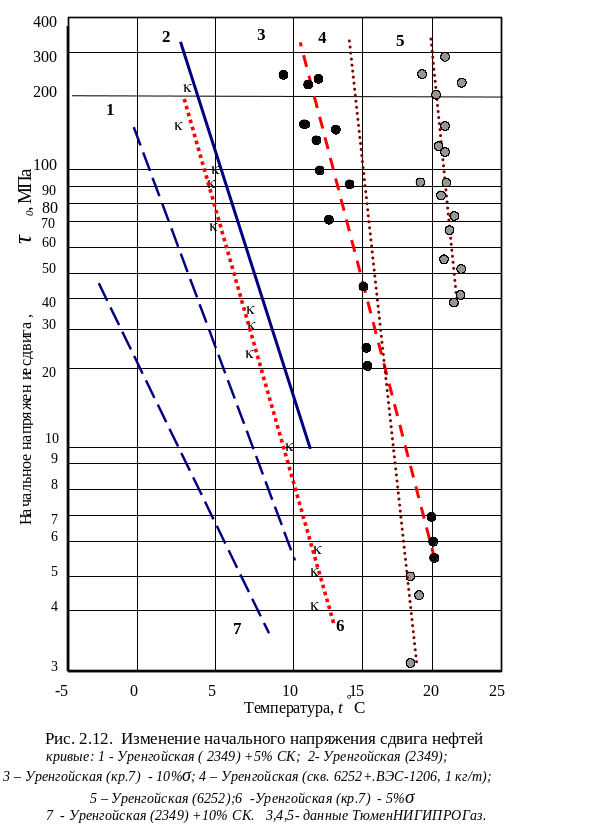
Согласно данным ТюменНИИГИПРОгаза и ТюмГНГУ, приведенным на рис. 2.9÷2.12 и (2.29) например, для нефти скважины 6252 (при условии создания в трубопроводе перепада давления 4÷7МПа) запуск трубопровода возможен лишь при охлаждении нефти не ниже 21С, а с присадкой ВЭС-1206 в концентрации 1 кг/т – не ниже +18С. Таким образом, в случае остановки трубопровода (например, при нарушении его герметичности) и охлаждении до температуры грунта (около 0С) повторный запуск нефтепровода в эксплуатацию явно нереален и практически невозможен без применения специальных мероприятий (разогрев, опорожнение и т.п.).
Необходимо отметить, что на сегодняшний день в России проблема выбора рациональной технологии перекачки неньютоновских нефтей с разбавителями окончательно не решена. Не решена проблема сбора нефтеконденсатных смесей с дневной поверхности при нарушении герметичности трубопроводов. Не изучены динамика распространения загрязнений с учетом изменяющихся свойств углеводородных смесей. Экспериментальные исследования испарения нефтеконденсатных смесей по методике описанной в предыдущей главе, позволяют утверждать, что в случае выхода на открытую поверхность за 30÷40 часов испаряется около 60% ДК и практически полностью легкие фракции нефти. Как видно из экспериментальных данных, представленных на рис 2.10, вследствие потерь от испарения σ = 5% легких фракций начальное напряжение сдвига «релаксируется» до исходных значений при содержании в нефти всего 10% СК. При величине потерь более σ > 10% смеси эксплуатация трубопровода может оказаться практически нереальной.
Таким образом, релаксации напряжений, деформаций в аномальных нефтеконденсатных смесях сложны и математическое описание их практически невозможно.
79
80
Представляется актуальным совершенствование методов и приборного обеспечения для изучения реологических параметров нефтей, что позволит создать корректные методики расчета напряжений сдвига и вязкости смесей в зависимости от концентрации разбавителя, возможных потерь, температуры смеси и т.п.
2.6. Фазовые состояния углеводородных систем при изменении давления и температуры
2.6.1. Критические параметры углеводородов
Отдельные газы или многокомпонентные смеси могут находиться в одно-, двух- или трехфазном состоянии (в газообразном, жидком или твердом).
Жидкости (в широком смысле слова) отличаются от твердых тел легкой подвижностью частиц, в то время как для изменения формы твердого тела к нему нужно приложить конечные, иногда очень большие силы. Изменение формы жидкости может происходить под действием самых малых сил (жидкость течет под действием собственного веса).
Жидкости по своим механическим свойствам разделяются на два класса: малосжимаемые и сжимаемые. С позиций физики капельная жидкость значительно отличается от газа, с позиций механики жидкости различие между ними не так велико, и законы, справедливые для капельных жидкостей, могут быть приложены также и к газам, когда сжимаемостью последних можно пренебречь. В связи с отсутствием специального термина, который обозначал бы жидкость в широком смысле слова, в дальнейшем мы будет пользоваться терминами «капельная жидкость» (жидкость), «сжимаемая жидкость» (газ).
Капельная жидкость обладает вполне определенным объемом, который практически не изменяется под действием сил. Газы же, занимая все предоставленное им пространство, могут значительно изменять объем, сжимаясь и расширясь под действием сил. Таким образом, капельные жидкости легко изменяют форму (в отличие от твердых тел) и незначительно – объем. Газы легко изменяют как объем, так и форму.
Индивидуальные газы изменяют свой объем в зависимости от давления и температуры. Если вещество находится в однофазном состоянии, то его объем V определяют по температуре Т и давлению р. Рассмотрим подробно приведенную на рис. 2.13 диаграмму давление-удельный объем для метана.
П
81
Иначе говоря, при изменении величины давления или температуры все газы могут быть превращены в жидкость или из жидкости в пар. Для каждого газа существует определенная (критическая) температура, выше которой, несмотря на применение любого высокого давления, он не может быть переведен в жидкое состояние. Иными словами, критическая температура чистых веществ ТКР – это та же максимальная температура, при которой жидкая и паровая фазы еще могут существовать в равновесии. Давление паров при этой температуре называется критическим давлением рКР, а объем единицы плотности вещества – критическим объемом VКР 1.
Приведенные выше определения критических параметров справедливы для индивидуальных газов. Природные газы в большинстве случаев представляют собой сложные смеси, критическая температура которых всегда выше критической температуры самого низкокипящего компонента и ниже критической температуры высококипящих компонентов. Критические параметры газовой смеси могут быть подсчитаны по правилу смешения (закону аддитивности), т.е. путем суммирования произведения отдельных компонентов, входящих в газовую смесь, на их мольную концентрацию, например:
ТКР = у1ТКР1 + у2ТКР2 + …+ уnТКРn = уiТКРi, (2.30)
где ТКР1, ТКР2, …, ТКРn – критические параметры компонентов, входящих в газовую смесь; у1, у2, …, уn – объемные или весовые концентрации компонентов газовой смеси в долях единицы.
Подсчитанные по правилу смешения критические параметры газовой смеси получили названия псевдокритических или среднекритических.
82
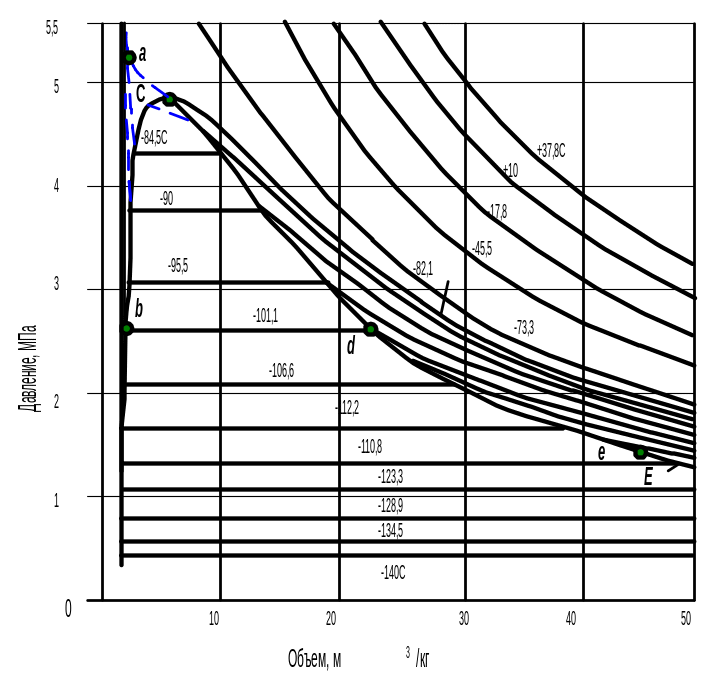
Рис. 2.13. Диаграмма фазового состояния р-V для метана
Если состояние газа близко к состоянию сжижения, то его следует называть паром. Критические параметры рКР (Па) и ТКР (ºС) для нефтяных паров фракций определяются по эмпирическим формулам:
ТКР = 1,05tСР + 160, (2.31)
(2.32)![]()
где tСР – средняя температура
кипения нефтяной фракции, ºС;
![]() – молекулярная масса; k – коэффициент,
равный 5,2 для парафиновых углеводородов,
0,6 – для нафтеновых, 6,8 – для ароматических.
– молекулярная масса; k – коэффициент,
равный 5,2 для парафиновых углеводородов,
0,6 – для нафтеновых, 6,8 – для ароматических.
Отношение абсолютных значений физических констант вещества к их критическим параметрам получило название приведенных параметров:
ТПР = Т/ТКР; рПР = р/рКР; VПР = V/VКР. (2.33)
Эти уравнения были названы обобщенными уравнениями состояния.
Экспериментально было установлено, что все газы при одинаковых приведенных температурах и давлениях имеют одинаковый приведенный объем, т.е. приведенный объем газов есть функция приведенной температуры и приведенного давления:
VПР = ƒ (ТПР; рПР). (2.34)
У
83
(р + а/V²)(V – b) = RT, (2.35)
где R – универсальная газовая постоянная R = 8,317 Дж/град.; a и b – поправки на внутреннее давление молекул и на объем.
Следует обратить внимание на то, что для характеристики степени отклонения идеальных газов от реальных можно использовать не только «обычное» определение сжимаемости z (или не идеальности):
![]() (2.36)
(2.36)
но и «остаточный» объем ΔV, т. е.
![]() (2.37)
(2.37)
Рис. 2.14.
Сжимаемость газов при 0ОС
1–СО2;
2–СН4;
3–О2;
4–N2;
5–Не;
6–Н2.

И
84
Ркр

ГАЗ
 К
Ткр
К
Ткр
 ПАР
ПАР
кривая метастабильная
 испарения
паровая фаза
испарения
паровая фаза
 метастабильная
метастабильная
 твердая точка
твердая точка
 ЖИДКОСТЬ
ЖИДКОСТЬ
Т


кривая сублимации
кривая
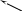 ТВЕРДАЯ
плавления D
ТВЕРДАЯ
плавления D
переохлаждение ФАЗА
А жидкости
