
- •Глава 1.
- •1.1.1 Предмет и задачи ферментного катализа и инженерной энзимологии
- •1.1.2. Первичная структура белка
- •1.1.3. Основы термодинамики. Типы связей в белках и энергетика.
- •1.1.4. Конформация пептидов. Вторичная структура белков
- •1.1.5. Структура глобулярных белков. Третичная и четвертичная структура.
- •1.2.2. Методы выделения и очистки ферментов
- •1.2.3. Единицы активности ферментов. Методы определения активности ферментов.
- •1.3.1.Класссификация ферментов.
- •1.3.2.Коэнзимы и другие кофакторы
- •1.3.3.Фермент-субстратные комплексы и механизм действия ферментов.
- •1.3.4.Кинетика ферментативных реакций.
- •1.3.5. Влияние температуры на ферментативные реакции.
- •1.3.6. Влияние рН на ферментативные реакции.
- •14.1. Эффекторы ферментов. Механизмы регуляции ферментных реакций.
- •1.4.2 Механизмы конкурентного ингибирования ферментативных реакций.
- •1.4.3. Механизмы неконкурентного (аллостерического) ингибирования ферментных реакций.
- •1.4.4.Кинетика ферментных реакций при конкурентном ингибировании.
- •1.4.5. Экспериментальная оценка кинетических параметров ферментативных реакций при полном конкурентном ингибировании
- •1.4.6. Кинетика ферментативной реакций при неконкурентном ингибировании.
- •1.4.7. Экспериментальная оценка кинетических параметров ферментативных реакций при полном неконкурентном ингибировании.
- •1.4.8. Субстратное торможение.
- •Глава 2.
- •2.1.Носители для иммобилизации ферментов и клеток
- •2.2.1.Физические методы иммобилизации ферментов
- •2.2.2. Химические методы иммобилизации
- •2.3.1. Гидролитические ферменты
- •2.3.2. Применение лиаз.
- •2.3.3. Применение изомераз.
- •2.3.4.Применение оксидоредуктаз.
- •2.4.Применение иммобилизованных ферментов в микроанализе.
- •2.5 Применение иммобилизованных биокатализаторов в медицине
2.2.2. Химические методы иммобилизации
Методы иммобилизации ферментов с помощью ковалентного связывания основаны на образовании химической связи между молекулами фермента и носителем. При этом важно, чтобы аминокислоты, необходимые для проявления каталитической активности ферментов, не участвовали в ковалентной связывании с носителем. Избежать этого, как правило, трудно, поэтому способ ковалентной иммобилизации обычно приводит к снижению ферментативной активности. Однако инактивацию фермента можно предотвратить, если проводить иммобилизацию в присутствии субстрата, который защищает активный центр.
Основных принципов конструкции конечного препарата методом химической иммобилизации - три. Это связано с тем, что независимо от характера процесса в иммобилизацию включают три компонента: собственно молекула биокатализатора (Ф), носитель (Н), и сшивающий реагент (С). Последний реагент называют еще – «вставка», «ножка», «сшивка» и т.д.
Иными словами такая иммобилизация подразумевает создание конструкций из связанных химическими связями 3-х элементов: Н-С-Ф, Н-Ф, С-Ф. говоря образно Н-Ф можно использовать термин «пришивка», для Н-С-Ф - «сшивка», для СФ- «вшивка».
Теперь рассмотрим подробнее принципы конструирования. Если на поверхности носителя имеются функциональные группы способные вступить в химические реакции с функциональными группами фермента с образованием ковалентных связей, то процесс иммобилизации сводится к необратимой «пришивке» фермента и носителю, за счет простой адсорбции.
Может также получиться, что из-за стерических и диффузионных ограничений тесный контакт фермента и носителя нежелателен. Тогда применяют специальные сшивающие реагенты различной длины. Это очень удобный метод, поскольку за счет сшивающего агента можно изменить каталитические характеристики биокатализатора, изменять характер связи в агенте в нужном русле и т.д.
В ряде случаев для ковалентной иммобилизации используют системы изначально не содержащие носитель, а только фермент и сшивающий агент. Т.е. это вначале, а в процессе иммобилизации или носитель формируется как твердое тело или же сам фермент служит одновременно и носителем. Имеется в виду ковалентное вшивание молекулы фермента в различные типы «сеток». Образование ферментативных сеток (ретикуляция ферментов) обусловлено полифункциональностью самого фермента, т.е. наличием помимо активного центра большого количества реакционно-способных групп. За счет этого в растворе фермента, при наличии биофункционального сшивающего агента, отдельные молекулы фермента сшиваются друг с другом и образуют агрегаты сетчатой структуры, где узлами служат сами ферменты.
Интересен способ ретикуляции ферментов, предварительно модифицированных ковалентно реагентами, содержащими двойную связь, например акрилоилхлоридом. При сополимеризации ферментного (белкового) макромономера с низкомолекулярными мономерами (например, с акриламидом) образуются сетчатые полимерные гели, сшитые белком или дополнительными сшивающим мономером (например, N,N,N-Метилен-бис акриламидом). Причем исходное состояние системы – жидкость, а конечные (после полимеризации) – гель (твердое тело), в форме сосуда в котором идет реакция. Потом этот трехмерный гель – блок можно измельчить.
Часто, для увеличения прочности уже иммобилизованные ферменты дополнительно обрабатывают сшивающим агентом, как бы привязывают ферменты друг другу. В дальнейшем, освободившись от твердого носителя можно получить сшитую ферментную пленку. Связывание фермента с носителем может осуществляться с образованием различных химических связей:
а- реакции с образованием амидной связи
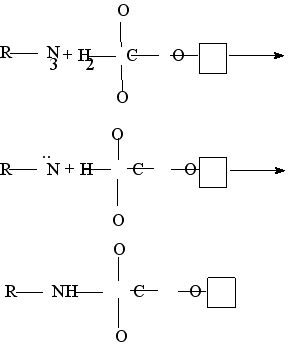
Присоединить белок (Ф) к носителю (Н) или сшивающему агенту (С) посредством амидной связи можно многими путями и при участии различных функциональных групп. Наиболее часто применяют реакцию ацилирования аминогрупп фермента. В качестве ацилирующих агентов используются ангидриды.

С помощью ангидридного метода получено более 20 новых препаратов иммобилизованных ферментов, таких как пенициллинамидаза, пепсин, и т.д. Носителями служат в основном сополимеры малеиновой кислоты с ненасыщенными соединением – этиленом, акриловой кислотами или сополимеры малеинового ангидрида.
Одним из вариантов ангидридного метода является использование полимеров, содержащих ангидридные группы в качестве предшественников для получения носителей с разнообразными функциональными группами.
В качестве ацилирующих агентов применяют также активированные эфиры. Например, сополимеризацией 2-оксиэтилметакрилатан производными метакриловой кислоты получают n–нитрифениловые эфиры полимеров типа «сферон»

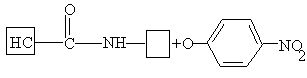
Эта реакция интересна тем, что в процессе модификации белка высвобождается нитрофенил-ион, по которому можно контролировать за ходом реакции спектрофотометрическим методом.
б- реакции образования карбомидных связей (производные мочевины)
Изоцианаты способны эффективно взаимодействовать с различными функциональными группами белков с образованием производных мочевины – диалкилмочевина, уретан, уреид. Наиболее реакционными группами белков здесь являются аминогруппы
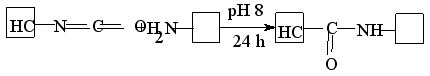
Изоцианаты используют для активации неорганических (гидроокись титана, кремния, алюминия) носителей и целлюлозных носителей. В первом случае реакцию неорганического носителя с изоцианатом проводят в органическом растворителе, причем часть изоцианатных групп образует с гидрооксидом карбонат, а оставшиеся активные группировки могут реагировать в водном растворе с амино- и гидрооксидными группами белка соответственно в щелочных и слабощелочных средах. Таким образом, были иммобилизованные глюкозоамилаза, лактоза и т.д.
Бромциановый метод один из самых распространенных методов химической иммобилизации ферментов. При обработке бромцианом на полисахаридных носителях формируются реакционно-способные цианатные, имидокарбонатные группы. При взаимодействии фермента с образованным полисахаридом образуются изомочевины и уретаны.
В2СN + полисахарид полиакриламид
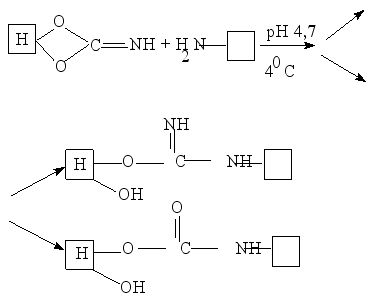
Обработка неорганических носителей (стекло, оксид титана, оксид алюминия) также существенно повышает – 10, 15 раз количество связанного фермента. Помимо этого время функционирования иммобилизованного фермента, например глюкозоамидазы, существенно повышается.
в- реакции образования азометиновых связей
На практике широко применяемым методом специфической модификации аминогрупп белков является образование азометиновых связей в реакциях белков с альдегидами:

При применении глутарового альдегида необходимо учитывать возможность образования побочных продуктов поликонденсации и полимеризации. Азометиновые связи легко разрушаются в кислых средах с регенерацией исходных веществ. Это свойство используют для удаления с носителя ковалентно иммобилизованного фермента путем простого изменения рН среды. Для устойчивости к кислым средам проводят реакции восстановления азометиновой группировки. За последние годы глутаровый альдегид был использован для иммобилизации пенициллинамидазы, пепсин и др. Носителями служили целлюлозы и производные, кремнеземы и т.д.
г- реакции азосочетания
Соли диазолина могут вступать в различные реакции сочетания. В реакциях азосочетания могут участвовать различные группы, но чаще NH2.
В слабощелочной среде основной мишенью в белке является фенольный радикал тирозина.
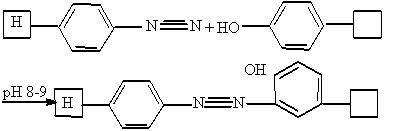
Носитель с белком связывается очень прочно. Носители, содержащие связь –N≡N получают обработкой полимера 2-(амилофенил) – диоксиланом и диазотриванием полученной аминогруппы.
д- реакции связыванием по сульфгидрильным группам (- S-S -).
Сульфгидрильные группы в белках встречаются довольно редко, т.к. они быстро окисляются с образованием тиоловых дисульфидных мостиков. Вот это свойства и используются для ковалентной иммобилизации. Если имеется фермент с SH группой и носитель с SH группой, то в присутствии кислорода они образуют прочную дисульфидную связь.
![]()
Для увеличения возможности протекания такой иммобилизации есть две пути.
1 - увеличение числа сульфгидрильных групп в белке. Это можно сделать обработав белок некоторыми восстановителями - меркаптоэтанолом, цистеином, боргидратом натрия.
2 - использование носителей с большим количеством тиолов. Для этого используют аминопроизводные сефарозы и сефадекса модифицированные гомоцистеинтиолактоном, сополимеры акриламида с тиолосодержащими мономерами и т.д.
е - радикальные реакции
При фотохимическом распаде алкил- и арилазидов образуются очень реакционноспособные короткоживущие радикалы нитрены.
![]()
Часто, эти алкил- и арилазиды входят в состав носителей и сшивающих агентов (например аминоэтилсульфанат). А нитрены реагируют с очень многими группами белка. Если смесь носитель или сшивающий агент с алкил- и арилазидом и белок облучают УФ лучами, то образуется очень прочная связь между нитренами и ферментом.
Однако здесь нужно быть очень осторожным. Поскольку часто длина волны максимума поглощения в УФ области алкил- и арилазидов может совпадать с длиной волны при котором разрушаются белки 250-300 нм.
