
- •Глава 1.
- •1.1.1 Предмет и задачи ферментного катализа и инженерной энзимологии
- •1.1.2. Первичная структура белка
- •1.1.3. Основы термодинамики. Типы связей в белках и энергетика.
- •1.1.4. Конформация пептидов. Вторичная структура белков
- •1.1.5. Структура глобулярных белков. Третичная и четвертичная структура.
- •1.2.2. Методы выделения и очистки ферментов
- •1.2.3. Единицы активности ферментов. Методы определения активности ферментов.
- •1.3.1.Класссификация ферментов.
- •1.3.2.Коэнзимы и другие кофакторы
- •1.3.3.Фермент-субстратные комплексы и механизм действия ферментов.
- •1.3.4.Кинетика ферментативных реакций.
- •1.3.5. Влияние температуры на ферментативные реакции.
- •1.3.6. Влияние рН на ферментативные реакции.
- •14.1. Эффекторы ферментов. Механизмы регуляции ферментных реакций.
- •1.4.2 Механизмы конкурентного ингибирования ферментативных реакций.
- •1.4.3. Механизмы неконкурентного (аллостерического) ингибирования ферментных реакций.
- •1.4.4.Кинетика ферментных реакций при конкурентном ингибировании.
- •1.4.5. Экспериментальная оценка кинетических параметров ферментативных реакций при полном конкурентном ингибировании
- •1.4.6. Кинетика ферментативной реакций при неконкурентном ингибировании.
- •1.4.7. Экспериментальная оценка кинетических параметров ферментативных реакций при полном неконкурентном ингибировании.
- •1.4.8. Субстратное торможение.
- •Глава 2.
- •2.1.Носители для иммобилизации ферментов и клеток
- •2.2.1.Физические методы иммобилизации ферментов
- •2.2.2. Химические методы иммобилизации
- •2.3.1. Гидролитические ферменты
- •2.3.2. Применение лиаз.
- •2.3.3. Применение изомераз.
- •2.3.4.Применение оксидоредуктаз.
- •2.4.Применение иммобилизованных ферментов в микроанализе.
- •2.5 Применение иммобилизованных биокатализаторов в медицине
1.4.7. Экспериментальная оценка кинетических параметров ферментативных реакций при полном неконкурентном ингибировании.
Рассмотрим уравнение (13). Для того, чтобы перейти на координаты Лайнувера-Бэрка нужно обратить это уравнение:
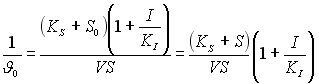
Работаем с этим уравнением, чтобы найти точку пересечения прямой на оси абсцисс и на оси ординат.
Вначале еще немного преобразуем последнее уравнение более удобную форму.
![]() (15)
(15)
Если
![]() то, произведение справа также равно 0.
Но с связи с тем, что
то, произведение справа также равно 0.
Но с связи с тем, что
![]() не может быть равно 0, а иначе теряла бы
смысл все наши рассуждения (наличие
ингибитора), то
не может быть равно 0, а иначе теряла бы
смысл все наши рассуждения (наличие
ингибитора), то
![]() ,
,
![]() ,
,
![]() отсюда
отсюда
![]() (16)
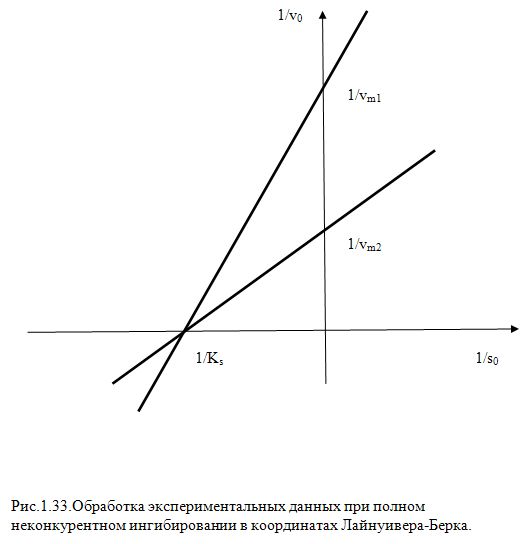
т.е. при различных значениях
[I] наши прямые будут пересекаться в
общей точки на оси абсцисс в точки
(16)
т.е. при различных значениях
[I] наши прямые будут пересекаться в
общей точки на оси абсцисс в точки
![]() (Рис .1.33)
(Рис .1.33)
Ели же
![]() то из уравнения (15) следует:
то из уравнения (15) следует:
![]()
Итого
![]() (17)
(17)
Из (17) следует, что обратные величины VМ. при различных концентрациях ингибитора, будут отличаться на величину т.е. имеют различные величины.
Т.о. при полном неконкурентным ингибировании в координатах Л-В, для опытов с различными значениями [I] получаются пучок прямых пересекающих ось ординат в различных точках равных 1/Vm1 , 1/Vm2 и т.д.
Из уравнения (14) можно переписать в таком виде
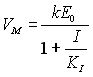
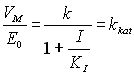 или
или
![]() (18)
(18)
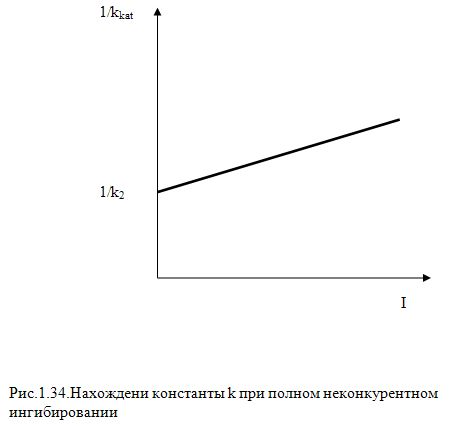
Из этого уравнения следует, что в серии
экспериментов по определению υ0 при
различных S0 и Е0 в координатах
![]() должна получиться прямая отсекающая
на оси ординат отрезок равный 1/к
(Рис.1.34) - проверить самостоятельно
должна получиться прямая отсекающая
на оси ординат отрезок равный 1/к
(Рис.1.34) - проверить самостоятельно
.
Для обработки серии опытов по измерению
υ0 при различных S0 и I можно использовать
координаты Диксона
![]()
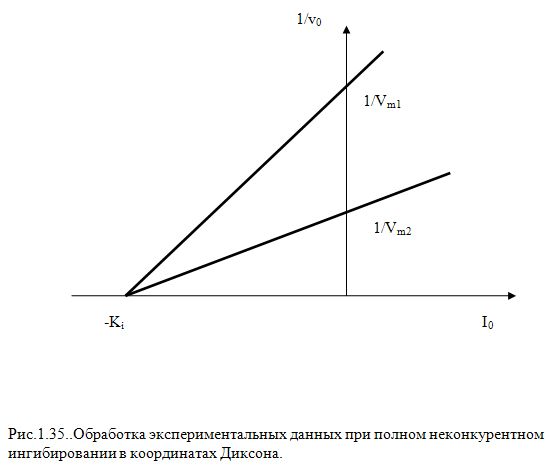
Как и в случае с полным конкурентным ингибированием преобразуем (13) для неконкурентного ингибирования.
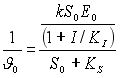 (13)
(13)
обращаем уравнения
![]()
![]() (19)
(19)
Если
![]() ,то заменим
,то заменим
![]() на
на
![]() в уравнение (19)
в уравнение (19)
![]() (20)
(20)
Т.е. при все прямые описываемые зависимостью пересекаются в общей точки на оси абсцисс. Это позволяет легко находить константу нестойкости комплекса фермента с полным неконкурентным ингибитором, а также удобно для количественного определения типа ингибитора. Вспомним пучок прямых в координатах Диксона пересекается во втором квадрате (а не на абсциссе) при полном конкурентном ингибировании и в общей точке на оси абсцисс при полном неконкурентном ингибировании. В обоих случаях абсцисса точки пересечения равна –КI (Рис.1.35).
1.4.8. Субстратное торможение.
Экспериментально установлено, что скорость ферментативных реакций, при увеличении концентрации субстрата, достигнув максимума начинает падать (Рис.1.36.).
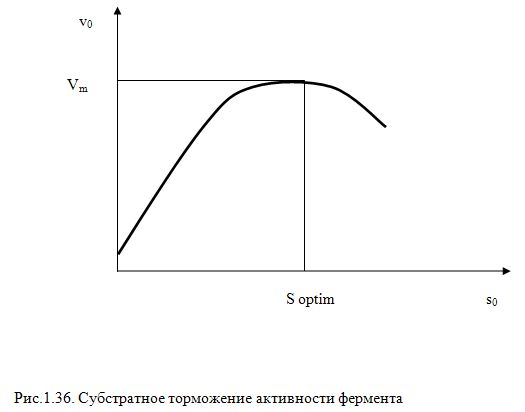
Такой вид торможения активности фермента носит название субстратного торможения.
Если S больше Sопт, соответствующего Vmax , то снижение концентрации субстрата вызывает повышение скорости реакции. Автокаталитический характер реакций такого типа может оказывает существенное влияние на работу биологических реакторов.
Причиной снижения скорости ферментативной реакции под влиянием избытка субстрата является взаимодействие промежуточных соединений еще с одной молекулой субстрата, в результате чего образуется неактивное соединение, т.е. комплекс, не дающий конечных продуктов реакции. Другими словами фермент связывает вторую молекулу субстрата, причем в результате присоединения S к ЕS образуется нереакционноспособное промежуточное соединение.
В простейшим случае такой механизм субстратного торможение может быть выражен следующей схемой:
E+S ↔ES (1) KS=(k-1)/(k+1)
ES+S↔ ES2 (2) Ki=(k-3)/(k+3)
ES →E+P (3) медленная стадия
Скорость образования активного комплекса ES может быть выражена уравнением:
![]() (21)
(4)
(21)
(4)
При стационарном течение процесса, когда ES=const,
То
![]()
Принимаем во внимание, что
![]() (22)
(22)
и выразив концентрацию неактивного
комплекса [ES2] через константу его
диссоциации KS=(k-3)/(k+3) или
через концентрацию
 (23) путем нескольких преобразований,
аналогичных при выводе уравнений Х-Б
(сделать самостоятельно) получим
(23) путем нескольких преобразований,
аналогичных при выводе уравнений Х-Б
(сделать самостоятельно) получим
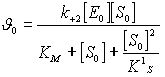 (24)
(24)
Видно, что уравнение (7) по
форме аналогично основному уравнению
ферментативной кинетики и отмечается
от него добавлением в знаменателе
![]()
Проанализируем уравнение (24):
а) при низких концентрациях субстрата,
т.е при
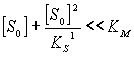 скорость линейно возрастает с ростом
S.
скорость линейно возрастает с ростом
S.
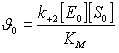 (25)
(25)
б) при очень высоких концентрациях
субстрата, т.е.
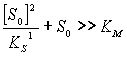 скорость реакции почти линейно падает
с увеличением [S0].
скорость реакции почти линейно падает
с увеличением [S0].
 (26)
(26)
При некотором промежуточном значении концентрации субстрата (оптимальная концентрация [S0].опт) наблюдается максимальная скорость. Значение [S0].опт является характерным для каждой ферментативной реакции и определяется константами КМ и КS1
Для того, чтобы установить [S0].опт нужно
найти производную
![]() и приравнять ее нужно. В результате
получится выражение:
и приравнять ее нужно. В результате
получится выражение:
![]() (27)
(27)
Для анализа экспериментальных данных
ферментативной реакции при субстратном
торможение используют графическое
выражение в форме двойных обратных
величин. Поскольку
![]() то наше уравнение (7) перепишем в таком
виде:
то наше уравнение (7) перепишем в таком
виде:
 (28)
(28)
Возьмем обратные величины (обратим уравнение)
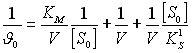 (29)
(29)
Если провести эксперименты с различными
концентрациями субстрата, охватывающим
все области зависимости
![]() то зависимость
то зависимость
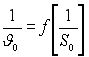 будет иметь вид кривой с минимумом
(Рис.1.37).
будет иметь вид кривой с минимумом
(Рис.1.37).
Как видно из рисунка правая ветвь кривой
в областях малых [S0], где выполняется
уравнение М.М. и член
![]() не играет существенной роли носит
линейный характер. Продолжение линейного
участка до пересечения с осью ординат
отсекает отрезок равный
не играет существенной роли носит
линейный характер. Продолжение линейного
участка до пересечения с осью ординат
отсекает отрезок равный
![]() тангенс угла наклона линейного участка
равен
тангенс угла наклона линейного участка
равен
![]() Таким образом графически можно определить
КМ
и V.
Таким образом графически можно определить
КМ
и V.
Для определения КS удобнее
(в области высоких концентраций [S0])
экспериментальные данные выражать в
форме зависимости
![]() В этом случае также получается кривая
с минимумом (Рис.1.38) переходящая в прямую
в области высоких концентраций субстрата,
где член
В этом случае также получается кривая
с минимумом (Рис.1.38) переходящая в прямую
в области высоких концентраций субстрата,
где член
![]() уравнения
(29) не имеет существенной роли, т.е.
уравнения
(29) не имеет существенной роли, т.е.
![]() (30)
(30)
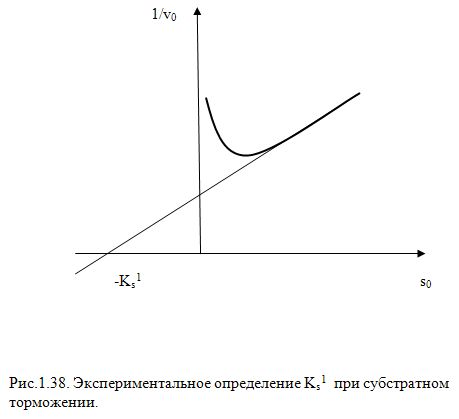
Продолжение линейного участка кривой
до пересечения с осью абсцисс отсекает
на этой оси отрезок равный КS. Для более
сложных по механизму ферментативных
реакций зависимость
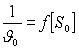 ,
а также [S0].опт не могут быть выражены
вышеприведенными простыми соотношениями.
,
а также [S0].опт не могут быть выражены
вышеприведенными простыми соотношениями.
