
- •Глава 1.Основы биоэнергетики
- •1.1.Общие принципы биоэнергетики
- •1.2.Биоэнергетические процессы в животных клетках
- •1.2.1.Цепь переноса электронов и окислительное фосфорилирование
- •1.2.2.Гликолиз
- •1.2.3.Окисление жирных кислот
- •1.2.4.Цикл трикарбоновых кислот
- •1.3.Фотосинтез. Фотосинтетическое фосфорилирование
- •1.3.1.Световые стадии фотосинтеза
- •1.3.2.Темновые стадии фотосинтеза
1.2.Биоэнергетические процессы в животных клетках
1.2.1.Цепь переноса электронов и окислительное фосфорилирование
Рис.
8.2. Структура
митохондрий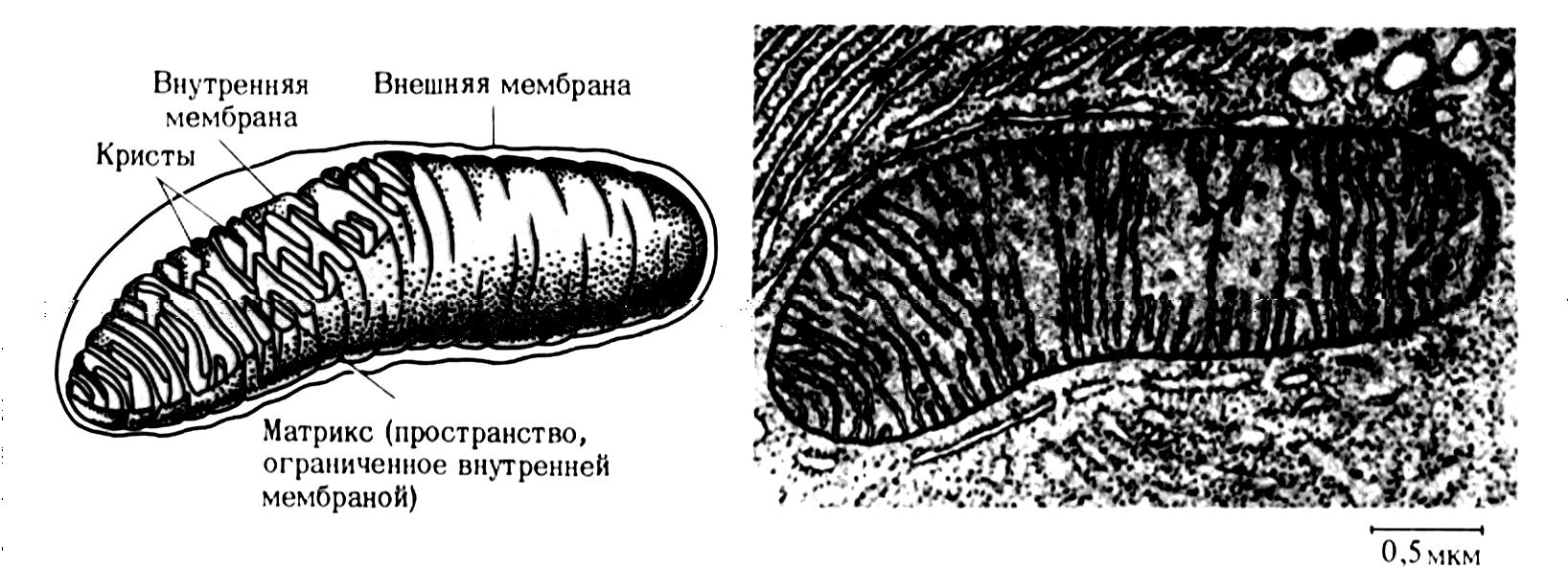
Систему окислительного фосфорилирования удается разделить на несколько сохраняющих активность комплексов, каждый из которых осуществляет одну из главных стадий цепи переноса электронов. Обычно эти комплексы обозначают как комплексы I, II, III и IV.
Комплекс I катализирует двухэлектронное окисление NADH специальным промежуточным переносчиком электронов — убихиноном или коферментом Q. Последний может существовать в окисленной хиноидной и восстановленной гидрохинонной формах, в дальнейшем обозначаемых сокращенно как CoQ и CoQH:
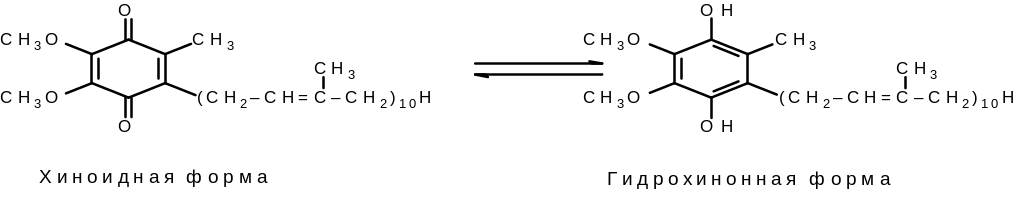
Рис. 8.3. Строение убихинона (коэнзима Q)
Суммарный процесс, катализируемый комплексом I, описывается стехиометрическим уравнением
![]()
Комплекс II представляет собой систему, катализирующую окисление сукцината в фумарат по реакции

Таким образом, и в этом случае перенос электронов осуществляется в конечном итоге на окисленную форму кофермента Q. Следует отметить, что аналогичная реакция с ацильными остатками, связанными с коферментом А, являющаяся одним из этапов окислительной деструкции жирных кислот, происходит с участием растворимого, т. е. не связанного с мембраной фермента.
Комплекс III катализирует окисление восстановленного кофермента Q цитохромом с. При этом степень окисления входящего в его состав иона железа уменьшается от (III) до (II). Уравнение реакции, катализируемой комплексом III, записывается в виде
![]()
Наконец, комплекс IV представляет собой цитохром с оксидазу, т. е. катализирует перенос электронов от ферроцитохрома с (II) (Рис. 8 .4) непосредственно на кислород по реакции
![]()
Каждый из комплексов содержит набор белков, несущих те или иные кофакторы. Основные компоненты представлены тремя группами белков — флавопротеидами, содержащими флавинадениндинуклеотид (FAD) или флавинмононуклеотид (или FMN), гемопротеидами, содержащими железопорфириновые комплексы, и железосерными белками. В состав цитохром-оксидазы входит медьсодержащий белок.
Рис.
8.4. Строение
гема, входящего в состав цитохромов b
и с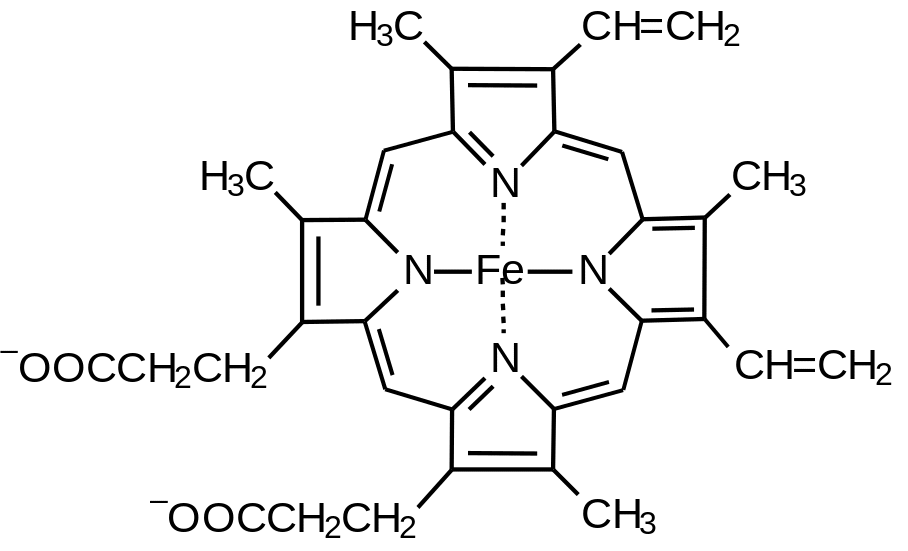
Помимо комплексов, катализирующих основные окислительно-восстановительные процессы в цепи переноса электронов, при достаточно мягком разрушении внутренней митохондриальной мембраны из нее выделяется комплекс белков, обладающий способностью в изолированном состоянии катализировать гидролиз АТР до ADP и ортофосфата. Гидролиз ингибируется макроциклическим антибиотиком олигомицином, в связи с чем этот фермент получил название олигомицин-чувствительной АТРазы. Главная функция олигомицин-чувсвительной АТРазы заключается в осуществлении обратной реакции — фосфорилировании ADP ортофосфатом с образованием АТР. Поэтому ее часто называют АТР синтетазой.
В изолированных митохондриях, содержащих неповрежденную мембрану, при окислении каждой молекулы NADH сопровождается образованием 3 молекул АТР (по одной в комплексе I, III и IV), а при окислении одной молекулы CoQ — 2 молекул АТР (в компплексе III и IV). Протекающая в комплексе II реакция образованием АТР не сопровождается.
Сопряженное фосфорилирование
Практически общепринятой, имеющей под собой фундаментальные экспериментальные основания гипотезой, объясняющей механизм сопряжения, является хемиосмотическая гипотеза Митчелла. Согласно этой гипотезе реакции), сопровождающиеся расходованием или образованием протонов, протекают на внутренней митохондриальной мембране таким образом что протоны переносятся с внутренней стороны мембраны на внешнюю, т.е. перенос электронов сопровождается возникновением трансмембранного градиента концентрации протонов (совершением осмотической работы). Этот градиент, создающий разность химических и электрических потенциалов, и является источником энергии для фосфорилирования ADP. Олигомицин-чувствительная АТРаза согласно этой гипотезы является ферментом, способным использовать градиент концентрации протонов для обращения процесса гидролиза АТР.
