
- •Глава 1.Биохимия иммунной системы
- •1.1.Иммунитет
- •1.2.Антигены
- •1.2.1.Искусственные антигены
- •1.2.2. Рис. 11.1. Строение искусственного антигена Природные антигены
- •1.2.3.Чужие антигены
- •1.3.Иммуноглобулины
- •1.3.1.Идентичность антител и иммуноглобулинов
- •1.3.2.Химическая структура иммуноглобулинов
- •1.3.3. Рис. 11.3. Структура иммуноглобулинов Образование иммуноглобулинов
- •1.4.Взаимодействие антигена с антителом
- •1.4.1.Преципитация и агглютинация
- •1.5.Комплемент и пропердиновая система
1.2.2. Рис. 11.1. Строение искусственного антигена Природные антигены
К природным антигенам относятся все белки организма, которые являются выражением генетической информации. Таким образом, сюда относятся белки биологических жидкостей, клеточных структур, и в первую очередь плазматических мембран. Примером служат групповые антигены крови (Рис. 11 .2). Все они являются производными основной структуры, называемой глобозидом (продукт гена Н). В ней есть концевой остаток галактозы, к которому могут присоединяться сахара под действием специфической гликозилтрансферазы, являющейся выражением гена, соответствующего данной группе крови. Так, ген Н контролирует синтез фукозилтрансферазы, ген IА — синтез N-галактозаминилтрансферазы, а ген IВ — синтез галактозилтрансферазы. Другие природные антигены происходят от основного комплекса гистосовместимости, который расположен на хромосоме VI. К его основным компонентам относятся гены, отвечающие за систему антигенно в лейкоцитов человека и расположенные в локусах А, В и С. Локусы А и В определяют по 15 специфичностей, а локус С — пять. Каждый локус содержит аллели, обозначенные индексом w и числовым кодом.
Рис.
11.2. Групповые
антигены крови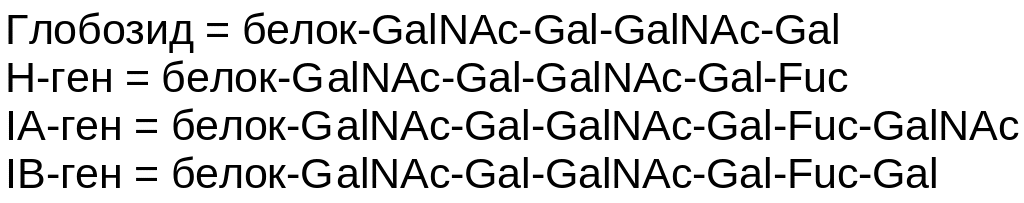
1.2.3.Чужие антигены
Примерами чужих антигенов служат два белка вируса гриппа, расположенные на поверхности вириона — нейраминидаза и гемагглютинин. Они проникают в организм и вызывают образование специфических антител.
1.3.Иммуноглобулины
1.3.1.Идентичность антител и иммуноглобулинов
Антитела к различным антигенам представляют собой довольно однородную группу белков, которые при электрофорезе при рН 8,6 образуют так называемую зону -глобулинов. Отдельные компоненты этой смеси были выделены и названы иммуноглобулинами G, А, М, D и Е, сокращенно IgG, IgA, IgM, IgD и IgE. Впоследствии обнаружили, что молекула каждого иммуноглобулина представляет собой тетрамер, образованный четырьмя полипеп-тидными цепями. Эти цепи попарно идентичны и называются легкой L- (существует в двух видах — и ) и тяжелой Н-цепями (пять видов — , , , и ). Классификация иммуноглобулинов основана на типе тяжелой цепи. В зависимости от вида Н-цепь содержит разное число аминокислотных остатков (их последовательность установлена) и, следовательно, имеет различную молекулярную массу (50000-70000), а для L-цепей — 22500. Иммуноглобулины существуют в виде мономеров, димеров и тримеров (IgA) или пентамеров (IgM). Их состав, содержание в сыворотке и полупериод жизни приведены в таблице.
Табл. 11.1. Состав некоторые свойства иммуноглобулинов
Тип |
Состав |
Молекулярная масса·10–3 |
Содержание в сыворотке крови, г/л |
Полупериод жизни, сут |
IgC |
22 22 |
143–149 |
9–15 |
23 |
IgM |
22)5 22)5 |
800–950 |
0.7–1.8 |
5.1 |
IgA |
22)1–3 22)1–3 |
158–162 |
1.5–2.6 |
5.8 |
IgD |
22 22 |
175–180 |
0.03 |
2.8 |
IgE |
22 22 |
185–190 |
0.05 |
2.5 |
